Carbon: Diferență între versiuni
| Linia 141: | Linia 141: | ||
===Forme alotropice=== |
===Forme alotropice=== |
||
{{Articol principal|Alotropii carbonului}} |
|||
Carbonul [[atom]]ic este o specie chimică cu o durată de viață foarte scurtă, de aceea carbonul, ca și element, se stabilizează prin intermediul unor structuri multi-atomice, cu diferite configurații moleculare, numite ''[[alotropie|alotropi]]'' sau ''forme alotrope''. Cele mai cunoscute trei forme alotrope ale carbonului sunt [[grafit]]ul, [[diamant]]ul și carbonul amorf. Deși în trecut erau considerate forme exotice, [[fulerenă|fulerenele]] sunt în prezent sintetizate în mod comun și utilizate în cercetare; din această clasă fac parte [[Buckminsterfullerenă|buckminsterfullerenele]],<ref name="buckyballs"/><ref name="nanotubes">{{cite book|editor=Ebbesen, T. W.|date=1997|title=Carbon nanotubes—preparation and properties|publisher=CRC Press|location=Boca Raton, Florida|isbn=0-8493-9602-6}}</ref> [[nanotub de carbon|nanotuburile de carbon]],<ref name="nanotubes2">{{cite journal|editor=Dresselhaus, M. S.|editor2= Dresselhaus, G.|editor3= Avouris, Ph.|date=2001|title=Carbon nanotubes: synthesis, structures, properties and applications|journal=Topics in Applied Physics|volume=80|isbn=3-540-41086-4|publisher=Springer|location=Berlin}}</ref> și nanofibrele de carbon.<ref>{{cite journal|date=2007|title=Investigations of NanoBud formation|journal=Chemical Physics Letters|volume=446|pages=109–114|doi=10.1016/j.cplett.2007.08.050|last1=Nasibulin|first1=A.|last2=Anisimov|first2=Anton S.|last3=Pikhitsa|first3=Peter V.|last4=Jiang|first4=Hua|last5=Brown|first5=David P.|last6=Choi|first6=Mansoo|last7=Kauppinen|first7=Esko I.|bibcode=2007CPL...446..109N }}</ref><ref>{{cite journal|date=2004|title=Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C{{sub|2}}H{{sub|6}}/H{{sub|2}} over nickel catalyst|journal=Applied Catalysis A: General|volume=274|pages=1–8|doi=10.1016/j.apcata.2004.04.008|author=Vieira, R|last2=Ledoux|first2=Marc-Jacques|last3=Pham-Huu|first3=Cuong}}</ref> Alți câțiva alotropi au fost descoperiți, precum lonsdaleitul,<ref name="lonsdaletite">{{cite journal|date=1967|title=Lonsdaleite, a new hexagonal polymorph of diamond|journal=Nature|volume=214|pages=587–589|doi=10.1038/214587a0|first=Frondel|last=Clifford|last2=Marvin|first2=Ursula B.|issue=5088|bibcode=1967Natur.214..587F }}</ref> carbonul sticlos,<ref name="glassy carbon"/> nanospuma de carbon<ref>{{cite journal|date=1999|title=Structural analysis of a carbon foam formed by high pulse-rate laser ablation|journal=Applied Physics A: Materials Science & Processing|volume=69|pages=S755–S758|doi=10.1007/s003390051522|author=Rode, A. V.|last2=Hyde|first2=S. T.|last3=Gamaly|first3=E. G.|last4=Elliman|first4=R. G.|last5=McKenzie|first5=D. R.|last6=Bulcock|first6=S.|issue=7}}</ref> și carbonul acetilenic liniar, numit și carbină.<ref name=LAC>{{cite book|author=Heimann, Robert Bertram|author2=Evsyukov, Sergey E.|author3=Kavan, Ladislav|last-author-amp=yes|title=Carbyne and carbynoid structures|url=https://books.google.com/books?id=swSQZcTmo_4C&pg=PA1|accessdate=2011-06-06|date=28 February 1999|publisher=Springer|isbn=978-0-7923-5323-2|pages=1–}}</ref> |
|||
Din [[2009]], [[grafenă|grafenele]] par a fi cele mai puternice materiale testate vreodată.<ref name="lee">{{cite journal|last=Lee|first=C.|last2=Wei|first2=X.|last3=Kysar|first3=J. W.|last4=Hone|first4=J.|date=2008|title=Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene|journal=Science|volume=321|issue=5887|pages=385–8|bibcode=2008Sci...321..385L|doi=10.1126/science.1157996|pmid=18635798|laysummary=https://web.archive.org/web/20090531134104/http://www.aip.org/isns/reports/2008/027.html}}</ref> Procedeul de separare al grafenei din [[grafit]] necesită o viitoare dezvoltare tehnologică, pentru a fi potrivit economic pentru procedee industriale.<ref name="nypost">{{cite web|url=http://www.nypost.com/seven/08252008/news/regionalnews/toughest_stuff__known_to_man_125993.htm|title=Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator|last=Sanderson|first=Bill|date=2008-08-25|publisher=nypost.com|accessdate=2008-10-09}}</ref> Dacă cercetările vor fi de succes, grafenele ar putea fi utilizate pentru eventuala construcție a unui [[lift spațial]]. De asemenea, o altă utilizare a lor ar putea fi cea de rezervor pentru hidrogen în automobilele care au motoare pe bază de hidrogen.<ref>{{Cite journal|last=Jin|first=Zhong|last2=Lu|first2=Wei|last3=O’Neill|first3=Kevin J.|last4=Parilla|first4=Philip A.|last5=Simpson|first5=Lin J.|last6=Kittrell|first6=Carter|last7=Tour|first7=James M.|date=2011-02-22|title=Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage|url=http://dx.doi.org/10.1021/cm1025188|journal=Chemistry of Materials|volume=23|issue=4|pages=923–925|doi=10.1021/cm1025188|issn=0897-4756}}</ref> |
|||
==Proprietăți chimice== |
==Proprietăți chimice== |
||
Versiunea de la 13 august 2017 20:19
| Carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Grafitul (stânga) și diamantul (dreapta), doi dintre cei mai cunoscuți alotropi ai carbonului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Liniile spectrale ale carbonului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume, Simbol, Număr | Carbon, C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | nemetale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă, Perioadă, Bloc | 14, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 2267 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | negru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7440-44-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | 12,0107 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 70 (67) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază de covalență | 77 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază van der Waals | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | [He] 2s2 2p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electroni pe nivelul de energie | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | -4, 0, +2, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | acid slab | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | hexagonală | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 3500 °C; 3773 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 4826,9 °C; 5100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de fuziune | n/a kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de evaporare | 355,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volum molar | 5,29×10-6 m³/kmol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiune de vapori | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 18.350 m/s la 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate (Pauling) | 2,55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldură specifică | 710 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate electrică | 61×103 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 129 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 1086,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | 2352,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | 4620,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | 6222,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | 37.831,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | 47.277,0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | {{{potențial_de_ionizare_7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | {{{potențial_de_ionizare_8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | {{{potențial_de_ionizare_9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | {{{potențial_de_ionizare_10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifică text |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Carbonul (din latină: carbo, „cărbune”) este un element chimic cu simbolul C și numărul atomic 6. Este un element nemetalic tetravalent, ceea ce înseamnă că poate forma legături covalente prin punerea în comun a patru electroni. În natură sunt răspândiți trei izotopi, 12C și 13C fiind stabili, iar 14C este un izotop radioactiv cu un timp de înjumătățire de aproximativ 5.730 de ani.[1] Carbonul este unul dintre puținele elemente cunoscute din antichitate.[2]
Carbonul este al 15-lea cel mai abundent element din scoarța terestră, și al patrulea cel mai răspândit element din univers după masă, primele fiind hidrogenul, heliul și oxigenul. Răspândirea naturală mare a carbonului, diversitatea specifică a compușilor săi organici și abilitatea sa unică de a forma polimeri la temperaturi terestre i-au permis carbonului să fie elementul chimic comun al lumii vii. Este al doilea cel mai abundent element din corpul uman, după oxigen, reprezentând aproximativ 18,5% în procente de masă.[3]
Atomii de carbon se pot lega între ei în diferite moduri, formând alotropii carbonului. Cele mai cunoscute exemple de alotropi sunt grafitul, diamantul și fulerenele.[4] Proprietățile fizice ale carbonului variază mult în funcție de aceste forme alotropice. De exemplu, grafitul este negru, moale și opac, în timp ce diamantul este transparent și extrem de dur (mai exact, cel mai dur material natural cunoscut). Grafitul este un bun conductor electric, în timp ce diamantul are o conductivitate electrică scăzută. În condiții normale de temperatură și presiune, diamantul, nanotuburile de carbon și grafenul sunt materialele cu cea mai mare stabilitate termodinamică cunoscută. În aceste condiții, toți alotropii carbonului sunt materiale solide, grafitul fiind cel mai stabil termodinamic. Sunt puțin reactivi, de aceea au nevoie de o temperatură ridicată chiar și pentru a reacționa cu oxigenul.
Cel mai întâlnit număr de oxidare al carbonul este +4 și se regăsește în compușii anorganici, în timp ce +2 se regăsește în monoxidul de carbon și în complecșii carbonilici ai metalelor tranziționale. Cele mai mari surse naturale de carbon anorganic sunt calcarul, dolomitul și dioxidul de carbon, iar majoritatea carbonului se găsește în materiile organice, în depozitele de cărbune, turbă, petrol și clatrați de metan. Carbonul formează un număr mare de compuși chimici, mai mulți decât orice alt elemente, existând aproximativ zece milioane de compuși descriși până în prezent,[5] acest număr fiind mic în comparație cu numărul teoretic de compuși posibili pe care carbonul îi poate forma. Din acest motiv, carbonul a fost numit și „regele elementelor”.[6]
Istoric

Carbonul a fost descoperit încă din Preistorie și a fost cunoscut în forma sa alotropică de cărbune încă din cele mai îndepărtate timpuri, anume la începutul civilizațiilor umane. O altă formă a sa, diamantul, a fost cel mai probabil cunoscut începând cu anii 2500 î.Hr. în China, în timp ce cărbunele era fabricat în perioada romană prin aceeași metodă folosită și în prezent, anume prin carbonizarea lemnului într-o atmosferă controlată (prin arderea materialului organic în spații fără mult oxigen) cu ajutorul argilei.[7][8][9]
În 1722, René-Antoine Ferchault de Réaumur a demonstrat că fierul putea fi transformat în oțel prin absorbția unei anumite substanțe, iar ulterior s-a înțeles că aceasta era de fapt carbonul.[10] În 1772, Antoine Lavoisier a arătat că diamantele reprezintă o formă rară de carbon; acesta a ars bucăți de cărbune și de diamant și a ajuns la concluzia că niciuna dintre ele nu a eliminat apă (deci nu conțineau hidrogen), însă ambele au eliminat aceeași cantitate de dioxid de carbon per gram. În 1779,[11] Carl Wilhelm Scheele a demonstrat că grafitul, despre care se credea că este o formă de plumb, era de fapt identic din punct de vedere chimic cu cărbunele, dar cu o mică cantitate de fier, întrucât prin tratarea cu un amestec de acid azotic se obținea dioxid de carbon.[12] În 1786, savanții francezi Claude Louis Berthollet, Gaspard Monge și C. A. Vandermonde au confirmat faptul că grafitul era în majoritate alcătuit din carbon, oxidându-l cu oxigen prin aceeași metodă folosită mai devreme de Lavoisier pentru diamant.[13] De asemenea, în urma arderii a rămas un reziduu de fier, despre care savanții au crezut că era necesar pentru structura grafitului. În lucrarea publicată, aceștia au propus numele de carbon (latină carbonum) pentru elementul constituent al grafitului, care elimina gazul de dioxid de carbon prin încălzire. Ulterior, Antoine Lavoisier a introdus carbonul în lista de elemente chimice în cartea sa din 1789.[14]
O formă alotropică relativ nouă a carbonului, fulerenele, a fost descoperită mai recent, în 1985[15], și include forme nanostructurale precum Buckminsterfullerenele și nanotuburile de carbon.[16] Savanții care au descoperit fulerenele, Robert Curl, Harold Kroto și Richard Smalley, au primit Premiul Nobel pentru Chimie în anul 1996.[17] Rezultatele au dus treptat la mărirea interesului legat de noile forme ale carbonului, iar recent au fost descoperiți alotropi „exotici”, precum carbonul sticlos sau grafenele.[18]
Etimologie
Denumirea de carbon provine din termenul francez charbone, care, la rândul său, provine din latinescul carbo, care înseamnă cărbune.[19] O adaptare interesantă pentru denumirea elementului este întâlnită în limba germană, daneză și olandeză, unde Kohlenstoff, kulstof și koolstof înseamnă, literal, „substanță de cărbune”.
Structură atomică

Carbonul este cel de-al șaselea element chimic din Sistemul periodic al elementelor, și are în forma sa fundamentală următoarea configurație electronică: 1s22s22p2. Se poate remarca faptul că cei patru electroni din stratul 2 sunt electronii de valență ai elementului. Razele covalente ale carbonului sunt de obicei considerate a fi 77,2 pm (C–C), 66,7 pm (C=C) și respectiv 60,3 pm (C≡C), deși acestea pot varia în funcție de numărul de coordinare și de atomul de care se leagă carbonul. În general, raza covalentă decrește cu scăderea numărului de coordinare și cu creșterea ordinului de legătură.[20]
Prin apartenența sa la perioada a doua, carbonul este singurul element din grupa a 14-a care este capabil să fie hibridizat sp2 și sp, dând naștere la legături duble (sigma-pi) și la legături triple (sigma-2pi), spre deosebire de restul elementelor din grupă. În combinațiile carbonului cu numărul de coordinare 4, cei patru orbitali din configurația fundamentală hibridizează, formând patru orbitali echivalenți sp3.[21]
Carbonul formează aproape în totalitate patru legături chimice cu alți atomi, în special în compușii organici, conferindu-i geometria specifică tetraedrică,[22] totuși au fost întâlnite excepții. În 2016, a fost confirmat faptul că hexametilbenzenul conține un atom de carbon ce formează șase legături, față de numărul obișnuit de patru.[23]
Proprietăți fizice
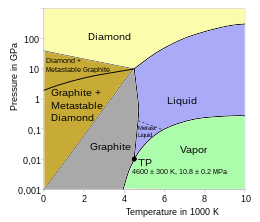
Printre formele alotropice diferite ale carbonului se numără una dintre cele mai moi substanțe cunoscute, anume grafitul, și cea mai dură substanță întâlnită în natură, anume diamantul. Carbonul este un element remarcabil din mai multe motive, unul dintre acesta fiind capacitate deosebită de a forma legături chimice cu alți atomi mici, incluzând atomii de carbon, iar mărimea sa îl face capabil de a forma legături covalente multiple cu atomi multivalenți. Datorită acestor proprietăți, carbonul poate forma aproape zece milioane de compuși chimici diferiți, majoritatea compușilor care există.[5] De asemenea, carbonul are cel mai mare punct de sublimare dintre toate elementele. La presiunea atmosferică, nu are niciun punct de topire, iar punctul triplu este la 10,8 ± 0,2 MPa și 4.600 ± 300 K (~4,330 °C),[24][25] așadar sublimează la aproximativ 3.900 K.[26][27]
Carbonul sublimează într-un arc de carbon ce are o temperatură de aproximativ 5.530 °C. Astfel, el rămâne solid la temperaturi mai înalte decât cele mai mari puncte de topire ale metalelor, precum wolframul sau reniul, indiferent de forma sa alotropică. Deși are din punct de vedere termodinamic o tendință de oxidare, carbonul rezistă la oxidare mai bine decât elemente precum fierul sau cuprul, care sunt agenți reducători mai slabi la temperatura camerei.
Valorile pentru primele patru energii de ionizare ale carbonului, 1086,5 kJ/mol, 2352,6 kJ/mol, 4620,5 kJ/mol și 6222,7 kJ/mol, sunt cu mult mai mari decât în cazul celorlalte elemente mai grele din grupa a 14-a. Electronegativitatea carbonului este 2,5, cu mult mai mare decât a elementelor mai grele din aceeași grupă, a căror electronegativitate variază între 1,8 și 1,9, dar destul de apropiată de cea a nemetalelor vecine și de a unor metale tranziționale din perioadele 5 și 6.
Cele mai reprezentative proprietăți fizice extreme ale formelor alotropice ale carbonului au fost aranjate în tabelul de mai jos:
| Grafitul este unul dintre cele mai moi materiale cunoscute. | Diamantul nanocristalin sintetic este cel mai dur material cunoscut.[28] |
| Grafitul este un lubrifiant foarte bun, fiind un superlubrifiant.[29] | Diamantul este unul dintre cele mai bune abrazive. |
| Grafitul este un conductor al electricității.[30] | Diamantul este un izolator electric excelent.[31] |
| Unele forme de grafit sunt utilizate ca și izolator termic, dar unele sunt conductori termici buni. | Diamantul este cel mai bun conductor termic întâlnit în natură. |
| Grafitul este opac. | Diamantul este puternic transparent. |
| Grafitul cristalizează în sistemul hexagonal.[32] | Diamantul cristalizează în sistemul cubic. |
| Carbonul amorf este complet izotrop. | Nanotuburile de carbon sunt printre cele mai anizotrope materiale cunoscute. |
Forme alotropice
Carbonul atomic este o specie chimică cu o durată de viață foarte scurtă, de aceea carbonul, ca și element, se stabilizează prin intermediul unor structuri multi-atomice, cu diferite configurații moleculare, numite alotropi sau forme alotrope. Cele mai cunoscute trei forme alotrope ale carbonului sunt grafitul, diamantul și carbonul amorf. Deși în trecut erau considerate forme exotice, fulerenele sunt în prezent sintetizate în mod comun și utilizate în cercetare; din această clasă fac parte buckminsterfullerenele,[16][33] nanotuburile de carbon,[34] și nanofibrele de carbon.[35][36] Alți câțiva alotropi au fost descoperiți, precum lonsdaleitul,[37] carbonul sticlos,[18] nanospuma de carbon[38] și carbonul acetilenic liniar, numit și carbină.[39]
Din 2009, grafenele par a fi cele mai puternice materiale testate vreodată.[40] Procedeul de separare al grafenei din grafit necesită o viitoare dezvoltare tehnologică, pentru a fi potrivit economic pentru procedee industriale.[41] Dacă cercetările vor fi de succes, grafenele ar putea fi utilizate pentru eventuala construcție a unui lift spațial. De asemenea, o altă utilizare a lor ar putea fi cea de rezervor pentru hidrogen în automobilele care au motoare pe bază de hidrogen.[42]
Proprietăți chimice

Grafitul este mult mai reactiv decât diamantul, în condiții standard, în ciuda faptului că este mai stabil din punct de vedere termodinamic. Însă acesta este alcătuit dintr-un sistem pi-delocalizat, cu atomii de carbon hibridizați sp2, ceea ce induce o anumită vulnerabilitate. De exemplu, grafitul poate fi oxidat de acidul azotic concentrat la încălzire (acid azotic fumans), cu obținerea acidului melitic, C6(CO2H)6, un acid hexacarboxilic în a cărui structură sunt păstrate unitățile hexagonale ale grafitului.[43][44]
Compușii de carbon reprezintă baza vieții pe Pământ și ciclul carbon-azot produce o parte din energia radiată de Soare și de alte stele. Deși formează o varietate extraordinară de compuși, majoritatea formelor de carbon sunt destul de nereactive în condiții normale. În condiții standard de temperatură și presiune, carbonul este rezistent la acțiunea agenților oxidanți, cu excepția oxidanților puternici. Carbonul nu reacționează cu acidul sulfuric, acidul clorhidric, clorul sau metalele alcaline.
Reacția cu nemetale și oxizi nemetalici
La temperaturi ridicate, carbonul reacționează cu oxigenul formând oxizii de carbon.Monoxidul de carbon se obține prin combinarea carbonului cu o cantitate insuficientă de oxigen, sau prin efectuarea reacției la o temperatură înaltă, la care dioxidul de carbon nu este stabil:[45]
- C(s) + O2(g) → 2 CO(g)
Carbonul reacționează cu sulful cu obținerea de sulfură de carbon:
- C(s) + S(s) → CS2(l)
O reacție specifică este reacția de formare a gazului de apă, prin care se suflă aburi (apă în stare gazoasă) printr-un strat de cărbune incandescent, formându-se amestecul de oxizi de carbon și hidrogen gazos:[45]
- C(s) + H2O(g) → CO(g) + H2(g)
Reacția cu metale și oxizi metalici
Carbonul preia oxigenul din oxizii metalici, cu obținerea metalului elementar. Această reacție exotermă este folosită în industria fierului și oțelului pentru obținerea fierului și în vederea controlării conținutului de carbon din oțel:
- Fe
3O
4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
Carbonul se combină cu unele metale și oxizi metalice la temperaturi înalte cu formare de carburi metalice. Un exemplu este carbura de wolfram, un compus utilizat pe larg ca și abraziv și pentru fabricarea unor unelte de tăiat.
Carbura de calciu, numită și carbid, un alt exemplu de carbură importantă din punct de vedere industrial, se obține la nivel industrial prin reducerea varului nestins (oxidul de calciu) cu cărbune de lemn sau cocs, la o temperatură de 2500°C:[46]
- CaO + 3 C → CaC2 + CO
Izotopi
Carbonul are doi izotopi naturali stabili: carbon-12, sau 12C, (98.89%) și carbon-13, sau 13C, (1.11%), și un radioizotop natural, dar instabil, carbon-14 sau 14C. Există 15 izotopi cunoscuți ai carbonului, iar cel care există cel mai puțin este 8C, care dispare prin emisie de protoni și degradare alpha. Are un timp de înjumătățire de 1,98739x10−21 s.
În 1961, Uniunea Internațională de Chimie Pură și Aplicată a adoptat izotopul carbon-12 ca bază pentru masele atomice.
Carbonul-14 are un timp de înjumătățire de 5730 ani și este folosit intens pentru datarea materialelor pe bază de carbon.
Compuși
Carbonul este elementul capabil să formeze cel mai mare număr de compuși: aproximativ zece milioane de compuși posibili. Întrucât chimia organică este adesea denumită „chimia carbonului”, deoarece aceasta studiază majoritatea compușilor carbonului (în combinație cu hidrogenul și alte elemente), sunt puțini compuși așa-zis anorganici ai carbonului, precum: oxizii de carbon, carbonații, cianurile, cianații, tiocianații, fulminații, precum și acizii corespunzători. De asemenea, mai sunt luate în considerare și carburile.
Compuși organici


Carbonul are capacitatea de a forma lanțuri sau catene foarte lungi prin legături carbon-carbon. Această proprietate se numește concatenare, și este restrânsă doar la câteva elemente (în afară de carbon, siliciul, borul și azotul). Legăturile carbon-carbon sunt destul de puternice și anormal de stabile. Această caracteristică este importantă deoarece permite carbonului să formeze un număr extrem de mare de compuși; de fapt, există mai mulți compuși chimici care conțin carbon decât toți compușii celorlalte elemente chimice la un loc. [47][48]
Cea mai simplă formă de moleculă organică este hidrocarbura - o familie mare de molecule organice care sunt alcătuite din atomi de hidrogen legați de un lanț de atomi de carbon. Lungimea catenei, catenele laterale (ramificațiile) și grupele funcționale influențează proprietățile moleculelor organice. Cea mai simplă hidrocarbură și, respectiv, cel mai simplu compus organic este metanul.
După natura atomilor din compuși, există două clase majore de compuși organici: hidrocarburile, compuși formați prin saturarea cu hidrogen a catenelor saturate sau nesaturate de carbon și compușii organici cu funcțiuni, o categorie care conține extrem de multe clase de substanțe importante din punct de vedere industrial și biologic, după cum se poate vedea în continuare. Compușii cu funcțiuni simple, monovalente sunt compușii hidroxilici (alcoolii, enolii, fenolii), nitroderivații, derivații halogenați și aminele, compușii cu funcțiuni divalente sunt compușii carbonilici (aldehidele și cetonele), iar compușii cu funcțiuni trivalente sunt acizii carboxilici. De asemenea, există și derivați ai acestor categorii, precum esterii, anhidridele acide, amidele și biomoleculele (proteinele, polizaharidele, lipidele și acizii nucleici), toate acestea având ca element de bază carbonul.[49][50]
Carbonul este răspândit în toate viețuitoare și formele de viață, reprezentând elementul central al chimiei organice. Când se unește cu hidrogenul, se obțin forme variate de hidrocarburi importante din punct de vedere industrial, fiind agenți frigorifici, lubrifianți, solvenți și ca precursori în procesele de fabricație ale materialelor plastice, produselor petrochimice și a combustibililor fosil.
Când se combină cu hidrogenul și oxigenul, carbonul poate forma o mare varietate de categorii de compuși importanți din punct de vedere biologic, printre care se numără zaharidele, chitinele, alcoolii, grăsimile, esterii aromatici, carotenoizii și terpenele. Cu azotul formează alcaloizi, iar prin adăugarea de sulf se obțin antibioticele, aminoacizii și cauciucurile. Prin adăugarea de fosfor la aceste elemente, se obțin acizii nucleici, ADN-ul și ARN-ul, esențiali pentru codificarea informației genetice specifice fiecărei viețuitoare. De asemenea, ATP-ul (adenozintrifosfatul) este cea mai importantă moleculă de transfer și de stocare a energiei din celulele vii.
Compuși anorganici

În categoria compușilor anorganici ai carbonului intră acei compuși care sunt asociați cu mineralele și nu conțin hidrogen sau fluor, însă această definiție lasă deschise anumite interpretări. Printre cei mai simpli compuși anorganici ai carbonului se numără oxizii de carbon. Cel mai cunoscut și important oxid al carbonului este dioxidul de carbon (CO2). Este un component minor al atmosferei Pământului, un compus volatil produs și folosit de toate ființele vii, și care era principalul component al paleoatmosferei.[51] Dizolvat în apă formează urme de acid carbonic (H2CO3), dar ca majoritatea compușilor cu mai mulți atomi de oxigen la un singur carbon, acesta este instabil.[52] Totuși, prin acest intermediar, sunt produși ioni carbonat, structuri stabilizate prin rezonanță. Unele minerale importante sunt carbonați, precum calcitul și azuritul. Disulfura de carbon (CS2) are o structură similară.[43]
Celălalt oxid comun al carbonului este monoxidul de carbon (CO), compus ce se formează prin combustia incompletă a carbonului și este un gaz incolor și inodor. Fiecare moleculă conține o legătură triplă, care este foarte puțin polară, rezultând tendința de a se atașa permanent de moleculele de hemoglobină, înlocuind oxigenul și formând carboxihemoglobina. Se poate concluziona astfel că gazul este foarte toxic.[53][54] Ionul cianură (CN-), are o structură similară și se comportă ca un ion halogenură. De exemplu, poate forma cianogenul ((CN)2, zis și dician), cu o structură similară halogenurilor diatomice. Printre ceilalți oxizi mai puțin comuni se numără suboxidul de carbon (C
3O
2),[55] monoxidul de dicarbon, instabil (C2O),[56][57] trioxidul de carbon (CO3),[58][59] ciclopentanpentona (C5O5),[60] ciclohexanhexona (C6O6),[60] și anhidrida melitică (C12O9).
Cu metalele reactive, precum wolframul, carbonul formează fie carburi metalice (C-), fie acetiluri metalice (C22-). De asemenea, formează aliaje cu puncte de topire foarte înalte. Acești anioni sunt astfel asociați cu metanul și acetilena, ambii fiind acizi foarte slabi. Cu o electronegativitate de 2,5,[61] carbonul are o preferință de a forma legături covalente. Unele carburi au matrice covalente, de exemplu carbura de siliciu sau carborundul (SiC), fiind asemănătoare cu diamantul. Totuși, chiar și cele mai polare și saline carburi nu sunt complet ionice.[62]
Compuși organometalici
Prin definiție, compușii organometalici conțin cel puțin o legătură de tipul carbon-metal. Există o varietate largă de astfel de compuși, iar printre principalele clase se numără: compuși simpli alchil-metal (de exemplu, tetraetilplumbul), compuși η2-alchene (de exemplu, sarea lui Zeise) și compuși η3-alil (de exemplu, dimerul clorurii de alilpaladiu); metalocenele sunt acei compuși care conțin liganzi de tip ciclopentadienil (de exemplu, ferocenul). Există mulți carbonilici metalici (de exemplu, tetracabonilul de nichel).
Deși se credea că carbonul formează exclusiv patru legături, a fost recent descoperit un compus complex organometalic ce conține un atom de carbon hexacoordinat, cu geometrie octaedrică. Cationul acestui compus este [(Ph3PAu)6C]2+, cu denumirea hexakis(trifenilfosfanaurio)metan. Se crede că acest fenomen este cauzat de aurofilicitatea pentru liganzii de aur.[63]
În natură
Formarea în stele
Carbonul nu a fost creat în timpul Big Bang-ului, deoarece are nevoie de producerea unei coliziuni triple de particule alfa (nuclee de heliu). Universul s-a extins inițial și apoi s-a răcit prea repede pentru ca acest lucru să fie posibil. Oricum, este produs în interiorul stelelor în ramura orizontală, unde un nucleu de heliu este transformat în carbon prin procesul triplu-alfa. A fost de asemenea creat în stări multi-atomice.
Răspândire
Rol biologic
Circuitul carbonului
Obținere
Preparare în laborator
Producere la scară industrială
Aplicații
Combustibil
Diamante
Măsuri de protecție
Carbonul este în general sigur. Inhalarea de funingine în cantități mari poate fi periculoasă. Carbonul poate lua foc la temperaturi înalte și poate arde puternic (ca în accidentul nuclear din Windscale, Marea Britanie, pe 10 octombrie 1957).
Există numeroși compuși chimici pe bază de carbon; unii sunt letali (cianurile, CN-), iar alții sunt esențiali vieții (glucoză).
Vezi și
- Cărbuni: antracit, cocs, huilă, lignit, turbă
- Diamant
- Fulerenă
- Grafen
- Grafit
- Nanotub de carbon
- Stea de carbon
Referințe
- ^ „Carbon – Naturally occurring isotopes”. WebElements Periodic Table. Accesat în .
- ^ „History of Carbon”. Accesat în .
- ^ „Biological Abundance of Elements”. The Internet Encyclopedia of Science. Accesat în .
- ^ „World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)”. Accesat în .
- ^ a b Chemistry Operations (). „Carbon”. Los Alamos National Laboratory. Arhivat din original la . Accesat în .
- ^ Deming, Anna (). „King of the elements?”. Nanotechnology. 21. doi:10.1088/0957-4484/21/30/300201. Accesat în .
- ^ „Chinese made first use of diamond”. BBC News. . Accesat în .
- ^ van der Krogt, Peter. „Carbonium/Carbon at Elementymology & Elements Multidict”. Accesat în .
- ^ „Carbunele de lemn – metode vechi, utilizari noi”, destepti.ro, accesat în
- ^ Ferchault de Réaumur, R.-A. (). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago.
- ^ „Carbon”. Canada Connects. Accesat în .
- ^ Senese, Fred. „Who discovered carbon?”. Frostburg State University. Accesat în .
- ^ Giolitti, Federico (). The Cementation of Iron and Steel. McGraw-Hill Book Company, inc.
- ^ Senese, Fred (). „Who discovered carbon”. Frostburg State University. Accesat în .
- ^ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (). „C60: Buckminsterfullerene”. Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ^ a b Unwin, Peter. „Fullerenes(An Overview)”. Accesat în .
- ^ „The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"”. Accesat în .
- ^ a b Harris, PJF (). „Fullerene-related structure of commercial glassy carbons” (PDF). Philosophical Magazine. 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. doi:10.1080/14786430410001720363.
- ^ „Carbon” la DEX online - Etimologia cuvântului carbon; accesat la 13 august 2017
- ^ Eroare la citare: Etichetă
<ref>invalidă; niciun text nu a fost furnizat pentru referințele numiteGreenwood276 - ^ Nenițescu, Chimie Generală, p. 786
- ^ Reid, Danielle. „The 4 Types of Bonds Carbon Can Form”. study.com.
- ^ Ritter, Stephen K. „Six bonds to carbon: Confirmed”. Chemical & Engineering News.
- ^ Eroare la citare: Etichetă
<ref>invalidă; niciun text nu a fost furnizat pentru referințele numitetriple2 - ^ Eroare la citare: Etichetă
<ref>invalidă; niciun text nu a fost furnizat pentru referințele numitetriple3 - ^ Greenville Whittaker, A. (). „The controversial carbon solid−liquid−vapour triple point”. Nature. 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ^ Zazula, J. M. (). „On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam” (PDF). CERN. Accesat în .
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (). „Materials: Ultrahard polycrystalline diamond from graphite”. Nature. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (). „Superlubricity of Graphite” (PDF). Physical Review Letters. 92 (12). Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101.
- ^ Deprez, N.; McLachan, D. S. (). „The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction”. Journal of Physics D: Applied Physics. Institute of Physics. 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ^ Collins, A. T. (). „The Optical and Electronic Properties of Semiconducting Diamond”. Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ^ Delhaes, P. (). Graphite and Precursors. CRC Press. ISBN 90-5699-228-7.
- ^ Ebbesen, T. W., ed. (). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 0-8493-9602-6.
- ^ Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., ed. (). „Carbon nanotubes: synthesis, structures, properties and applications”. Topics in Applied Physics. Berlin: Springer. 80. ISBN 3-540-41086-4.
- ^ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (). „Investigations of NanoBud formation”. Chemical Physics Letters. 446: 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (). „Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst”. Applied Catalysis A: General. 274: 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ Clifford, Frondel; Marvin, Ursula B. (). „Lonsdaleite, a new hexagonal polymorph of diamond”. Nature. 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ^ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (). „Structural analysis of a carbon foam formed by high pulse-rate laser ablation”. Applied Physics A: Materials Science & Processing. 69 (7): S755–S758. doi:10.1007/s003390051522.
- ^ Heimann, Robert Bertram; Evsyukov, Sergey E.; Kavan, Ladislav (). Carbyne and carbynoid structures. Springer. pp. 1–. ISBN 978-0-7923-5323-2. Accesat în . Parametru necunoscut
|last-author-amp=ignorat (ajutor) - ^ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (). „Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene”. Science. 321 (5887): 385–8. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798. Sumar pentru neinițiați.
- ^ Sanderson, Bill (). „Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator”. nypost.com. Accesat în .
- ^ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (). „Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage”. Chemistry of Materials. 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ^ a b Greenwood and Earnshaw, pp. 289–292
- ^ Nenițescu, Chimie Generală, pp. 791-792
- ^ a b Nenițescu, Chimie Generală, pp. 806-820
- ^ Nenițescu, Chimie Generală, pp. 827-829
- ^ Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. (). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press. p. 70. ISBN 978-0-19-873380-5. Accesat în .
- ^ Nenițescu, Costin D. (). Chimie organică (ed. VII). Editura Didactică și Pedagogică. p. 12.
- ^ „Functional Groups and Classes of Organic Compounds”, Chemistry LibreTexts, , accesat în
- ^ Arsene, Paraschiva; Popescu, Ștefan (). Chimie și probleme de chimie organică. București: Editura Tehnică. pp. 23–25.
- ^ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (). „The prebiological paleoatmosphere: stability and composition”. Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894.
- ^ Loerting, T.; et al. (). „On the Surprising Kinetic Stability of Carbonic Acid”. Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- ^ Haldane J. (). „The action of carbonic oxide on man”. Journal of Physiology. 18 (5–6): 430–462. doi:10.1113/jphysiol.1895.sp000578. PMC 1514663
 . PMID 16992272.
. PMID 16992272.
- ^ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (). „The clinical toxicology of carbon monoxide”. Toxicology. 187 (1): 25–38. doi:10.1016/S0300-483X(03)00005-2. PMID 12679050.
- ^ „Compounds of carbon: carbon suboxide”. Accesat în .
- ^ Bayes, K. (). „Photolysis of Carbon Suboxide”. Journal of the American Chemical Society. 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ^ Anderson D. J.; Rosenfeld, R. N. (). „Photodissociation of Carbon Suboxide”. Journal of Chemical Physics. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ^ Sabin, J. R.; Kim, H. (). „A theoretical study of the structure and properties of carbon trioxide”. Chemical Physics Letters. 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G.; Clutter D. R.; Thompson W. E. (). „Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2”. Journal of Chemical Physics. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ^ a b Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. (). „Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)” (PDF). Journal of Research of the National Bureau of Standards Section A. 67A: 153–162. doi:10.6028/jres.067A.015.
- ^ Pauling, L. (). The Nature of the Chemical Bond (ed. 3rd). Ithaca, NY: Cornell University Press. p. 93. ISBN 0-8014-0333-2.
- ^ Greenwood and Earnshaw, pp. 297–301
- ^ Scherbaum, Franz; et al. (). „"Aurophilicity" as a consequence of Relativistic Effects: The Hexakis(triphenylphosphaneaurio)methane Dication [(Ph3PAu)6C]2+”. Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi:10.1002/anie.198815441.
Bibliografie
- Greenwood, Norman N.; Earnshaw, Alan (). Chemistry of the Elements (ed. 2nd). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Costin D. Nenițescu Chimie generală (ed. 1). București, Editura Didactică și Pedagogică.
Legături externe
| Puteți găsi mai multe informații despre Carbon prin căutarea în proiectele similare ale Wikipediei, grupate sub denumirea generică de „proiecte surori”: | |
| Definiții și traduceri în Wikționar | |
| Imagini și media la Commons | |
| Manuale la Wikimanuale | |
| Resurse de studiu la Wikiversitate | |
- Carbonul de la sistemul-periodic.go.ro
- Incredibila poveste a carbonului, 3 august 2008, Diac. Dr. Adrian Sorin Mihalache, Ziarul Lumina
- Carbon pe In Our Time la BBC. (ascultă acum)
- Carbon de la The Periodic Table of Videos (Universitatea din Nottingham, engleză)
- Carbon de la Britannica (engleză)
- Pagina despre carbon de la asu.edu
- Electrochemical uses of carbon[nefuncțională] (engleză)
- Carbon—Super Stuff. Animation with sound and interactive 3D-models.
