Apă (moleculă)
| Apă | |
 | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Oxidan [1] |
| Identificare | |
| Număr CAS | 7732-18-5 |
| Informații generale | |
| Formulă chimică | H2O |
| Aspect | lichid incolor |
| Masă molară | 18,01528(33) g/mol |
| Starea de agregare | lichid |
| Solubilitate | nu este solubil in nimic[necesită citare] |
| Anion | Oxigen |
| Cation | Hidrogen |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
- Acest articol se concentrează asupra apei ca substanță chimică. Pentru studiul apei în general, vedeți articolul Apă.
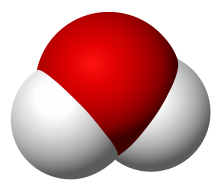
Apa este un compus anorganic polar cu formula chimică H2O.
Descriere[modificare | modificare sursă]
Molecula sa este formată prin combinarea a doi atomi de hidrogen și un atom de oxigen, fiind astfel oxidul hidrogenului și cea mai simplă hidrură de calcogen. Este de departe cel mai studiat compus chimic, astfel că unii biochimiști numesc apa ca fiind un „solvent universal”, pentru abilitatea sa de a dizolva multe substanțe.[2][3] Această proprietate îi dă apei posibilitatea să fie și „solventul lumii vii”.[4] Este singura substanță comună care există sub toate cele trei forme de agregare în natură: solidă (gheață), lichidă (apă lichidă ) și gazoasă (abur).[5]
Moleculele de apă formează legături de hidrogen între ele, fiind puternic polare. Polaritatea moleculei de apă permite separarea în ioni și formarea de legături puternice cu alte substanțe polare, precum alcoolii și acizii, astfel dizolvându-le. Legăturile de hidrogen sunt motivul pentru multe proprietăți speciale ale apei, precum faptul că forma sa solidă este mai puțin densă decât forma sa lichidă, punctul de fierbere de 100 °C este relativ mare pentru masa sa moleculară mică, și capacitatea termică, care este ridicată.
Apa este o substanță amfoteră (numit și amfolit), ceea ce înseamnă că poate fi atât acid, cât și bază, adică produce ionii H+ și HO- prin ionizare (proces denumit și autoprotoliză).
Vȃrsta apei în univers[modificare | modificare sursă]
Cercetători de la University of Illinois at Urbana-Champaign (Illinois, USA) au descoperit recent (2021) molecule de apă în cele 2 galaxii cu numele SPT0311-58 (depistate în anul 2017) la 12,88 miliarde ani-lumină, deci la 780 milioane ani după Big Bang (ceea ce reprezintă abia 5% din vȃrsta curentă a universului)[6]. Descoperirea a avut loc la Observatorul ALMA (Atacama Large Millimeter Array) din deșertul Atacama (Chile).
Nomenclatură[modificare | modificare sursă]
Denumirea acceptată de IUPAC pentru oxidul de hidrogen este apă sau oxidan,[1] sau echivalentele sale în alte limbi. Cea mai simplă denumire sistematică pentru apă este (mon)oxid de dihidrogen. Termenul pentru apa ce prezintă in compozitia sa cantitati semnificante de ioni ai calciului este acela de apă dură, iar pentru apa ce conține izotopul deuteriu al hidrogenului o denumire acceptată este aceea de apă grea.
Ionizarea apei[modificare | modificare sursă]
Din reacțiile de mai sus, rezultă că apa poate funcționa și ca acid (în prima), și ca bază (în a doua). Asemenea substanțe, care se comportă ca acizi față de baze și ca baze față de acizi se numesc substanțe amfotere sau amfoliți. Deci apa este un amfolit.
Datorită acestei proprietăți, producerea reacției dintre două molecule de apă este posibilă, ea fiind reversibilă.
Reacția de mai sus se numește reacția de ionizare a apei, pentru că moleculele se transformă în ioni. Deoarece este o reacție reversibilă, avem constanta de echilibru:
Apa este un acid și o bază foarte slabă, de aceea echilibrul reacției de ionizare este mult deplasat spre stânga. Cantitatea de apă are valoare mare și se poate introduce în Kc, obținându-se astfel o constantă nouă, Kw, care se numește produsul ionic al apei.
La o temperatură t=25 °C, . În cazul apei distilate, .
În funcție de concetrațiile ionilor de hidroniu dintr-o soluție, ele se împart în:
- soluții acide, unde ;
- soluții bazice, unde ;
- soluții neutre, unde .
Există două mărimi cu ajutorul cărora se apreciază caracterul soluțiilor:
; ; .
Bibliografie[modificare | modificare sursă]
- V Vasilescu, Biofizică medicală Editura Didactică și Pedagogică 1977
Referințe[modificare | modificare sursă]
- ^ a b Leigh, G. J.; et al. (). Principles of chemical nomenclature: a guide to IUPAC recommendations (PDF). Blackwell Science Ltd, UK. p. 34. ISBN 0-86542-685-6. Arhivat (PDF) din originalul de la .
- ^ Greenwood, Norman N.; Earnshaw, Alan (). Chemistry of the Elements (ed. 2nd). Oxford: Butterworth-Heinemann. p. 620. ISBN 0080379419.
- ^ „Water, the Universal Solvent”. USGS.
- ^ Reece, Jane B. (). Campbell Biology (ed. 10). Pearson. p. 48. ISBN 9780321775658.
- ^ Reece, Jane B. (). Campbell Biology (ed. 10). Pearson. p. 44. ISBN 9780321775658.
- ^ Sreevani Jarugula et al, „Molecular line observations in two dusty star-forming galaxies at z=6,9“, The Astrophysical Journal, 2021 (abstract)
Legături externe[modificare | modificare sursă]
- Water Structure and Behaviour A comprehensive and up-to-date NPOV resource maintained by Prof Martin Chaplin of South Bank University, UK
- en A spoof site on the "dangers" of dihydrogen monoxide
- en Stockholm International Water Institute (SIWI)
- en Explanation of the anomalous properties of water
- en Computational Chemistry Wiki Arhivat în , la Wayback Machine.
- en Chemical of the Week Arhivat în , la Wayback Machine.

![{\displaystyle H-Cl+H-{\begin{matrix}..\\O\\..\end{matrix}}-H\longrightarrow \left[{\begin{matrix}&..&\\:&Cl&:\\&..&\end{matrix}}\right]^{-}+\left[H_{3}O\right]^{+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b34f6488ea1ddf7a1deb10da25f965f9cf266d54)


![{\displaystyle K_{c}={\frac {\left[HO^{-}\right]\cdot \left[H_{3}O^{+}\right]}{\left[H_{2}O\right]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe8a988e964641de9f259ec927770f2aecffb7d5)
![{\displaystyle K_{c}\cdot \left[H_{2}O\right]^{2}=K_{w}=\left[HO^{-}\right]\cdot \left[H_{3}O^{+}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6420c1e49c6022c773b93d6101453aa77078857d)

![{\displaystyle \left[H_{3}O^{+}\right]=\left[HO^{-}\right]=10^{-7}mol/l}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0227dd61d8662c591414d5202ceccf4a3d01e037)
![{\displaystyle \left[H_{3}O^{+}\right]>\left[HO^{-}\right]\Rightarrow \left[H_{3}O^{+}\right]>10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f62f93e4d1f8bd63cbf21dccc40926cfadf64d3)
![{\displaystyle \left[H_{3}O^{+}\right]<\left[HO^{-}\right]\Rightarrow \left[H_{3}O^{+}\right]<10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75a5f870fbb360bc85a4f1b5190fc8bd9ea47a92)
![{\displaystyle \left[H_{3}O^{+}\right]=\left[HO^{-}\right]\Rightarrow \left[H_{3}O^{+}\right]=10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63faaf46d61d5ad684a52bf272a829f37d9320fc)
![{\displaystyle P_{H}=-\lg \left[H_{3}O^{+}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b06eb9cd12aa7176dde066e60a1ba5ac0ecbb2dd)
![{\displaystyle P_{OH}=-\lg \left[HO^{-}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cc2bbc91972c3335ab987aad11de86dda99e689)

