Plutoniu
| Plutoniu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume, Simbol, Număr | Plutoniu, Pu, 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | Actinide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă, Perioadă, Bloc | 3, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 19820 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | alb argintie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7440-07-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | (244) u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază de covalență | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | [Rn] 5f6 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electroni pe nivelul de energie | 2, 8, 18, 32, 24, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | (+7), +6, +5, +4, +3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | Pu2O3 PuO2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 639,4 °C = 912,5 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 3228 °C = 3505 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de evaporare | 333,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiune de vapori | 325 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 2260 m/s la 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate (Pauling) | 1,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate electrică | 1,460 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 6,74 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 584,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | {{{potențial_de_ionizare_2}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | {{{potențial_de_ionizare_3}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | {{{potențial_de_ionizare_4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | {{{potențial_de_ionizare_5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | {{{potențial_de_ionizare_6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | {{{potențial_de_ionizare_7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | {{{potențial_de_ionizare_8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | {{{potențial_de_ionizare_9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | {{{potențial_de_ionizare_10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifică text |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Plutoniul este un element chimic metalic radioactiv din grupa actinidelor, având numărul atomic 94 și simbolul chimic Pu. A fost descoperit în 1940 în urma reacției de bombardare a 238U cu deuteroni, dar – din cauza războiului – descoperirea sa a fost comunicată abia în 1948. A fost „botezat” în martie 1942,[1] numele elementului provenind de la cel al planetei pitice Pluto, în analogie cu uraniul și neptuniul.
Chiar dacă urme de plutoniu sunt prezente în mod natural pe Pământ (fiind cel mai greu element prezent în natură anterior erei atomice), el este considerat ca fiind un produs antropogen.[2] Dintre cei 20 de radioizotopi existenți se remarcă 238Pu (sursă termoenergetică) și 239Pu (izotop fisil).
Plutoniul este un element pentru care electronii 5f sunt situați la limita de tranziție delocalizare–localizare. În tăietură proaspătă are culoarea gri–argintie, care se acoperă rapid cu un strat de oxohidroxid de culoare gri (uneori cu tentă verzuie) în prezența umidității.[3] Este unul din puținele elemente metalice a cărui densitate crește prin topire; în plus, metalul topit suferă o descreștere a densității odată cu creșterea temperaturii. Din punct de vedere chimic, în stare metalică prezintă nu mai puțin de șapte forme alotropice, iar în compuși multiple stări de oxidare (până la +7).[1] Reacționează cu carbon, halogeni, azot, siliciu, hidrogen etc.
Plutoniul a fost produs în cantități semnificative tehnologic în timpul Proiectului Manhattan. Bombele Fat Man utilizate în cadrul testului nuclear Trinity și la bombardarea orașului japonez Nagasaki (în august 1945) au utilizat plutoniu drept material exploziv. Testele nucleare efectuate în anii 1950-1960 au utilizat la scară extinsă plutoniu. Plutoniul produs în scopuri militare și cel format în reactori nucleari prin procese de activare ridică în prezent probleme majore de proliferare nucleară. Puterea specifică rezultată ca urmare a evenimentelor de dezintegrare (0,57 W/g) a 238Pu este suficientă pentru utilizarea sa ca stimulator cardiac, surse de putere pentru generatoarele termoelectrice, balize de navigare, vehicule spațiale etc.[4]
Având în vedere comportamentul fizico-chimic și perspectivele tehnologice, plutoniul este considerat a fi unul dintre cele mai complexe și fascinante elemente din sistemul periodic, jucând un rol unic în istoria recentă a omenirii.[1] La mai puțin de cinci ani de la izolarea sa, acesta a fost folosit în una dintre cele două bombe atomice utilizate în scopuri beligerante, către sfârșitul celui de-al Doilea Război Mondial. De asemenea, o parte importantă a energiei de origine nucleară este produsă în reactori nucleari prin fisiunea nucleelor atomilor de plutoniu. Au fost efectuate mai multe experimente de iradiere a unor subiecți umani care studiază plutoniu, fără consimțământul acestora,[5] iar mai multe accidente critice, unele letale (iradiere acută), au avut loc după război.[6][7]
Practic, era atomică este asociată plutoniului (alături de uraniu): „Plutoniul evocă toată gama de emoții umane, de la bine la rău, de la speranță la disperare, de la salvarea omenirii la distrugerea sa totală. Nu există alt element în sistemul periodic care să fi avut un impact atât de profund în conștiința umanității”.[1]
Descoperirea elementului[modificare | modificare sursă]
În 1934,[8] Enrico Fermi a raportat descoperirea elementului Hesperium (Z=94), incluzând aceste rezultate în prelegerea susținută în fața Comitetului Nobel în 1938.[9] De fapt, probele analizate erau amestecuri conținând bariu, kripton și alte fragmente de fisiune,[10] reprezentând o interpretare eronată a fenomenului de fisiune nucleară evidențiat ulterior (în 1938) de către Otto Hahn și Fritz Strassmann.
Plutoniul (izotopul 238) a fost produs și izolat în urma experimentelor din 14 decembrie 1940 realizate de către Glenn T. Seaborg, Edwin McMillan, Joseph W. Kennedy și Arthur Wahl.[11][12] Ei au bombardat 238U cu deuteroni în ciclotronul de 1,5 m al Universității Berkeley din California. A fost astfel produs 238Np (cu un timp de înjumătățire de 2,1 zile), care se transformă prin emisie de particule β– în 238Pu (cu un timp de înjumătățire de 87,7 ani):[13]

Identificarea chimică a elementului a avut loc la data de 23 februarie 1941.[13] Imediat, grupul de cercetare a scris un articol care a fost trimis spre publicare la Physical Review (martie 1941),[14] dar publicarea a fost amânată până după sfârșitul războiului din motive de securitate.[15]
Imediat apoi,[16] s-a descoperit că 239Pu fisionează sub neutroni lenți, stabilindu-se că 239Pu poate fi utilizat drept sursă de energie de origine nucleară.
Astfel, la Cavendish Laboratory din Cambridge, Egon Bretscher și Norman Feather au demonstrat că un reactor nuclear cu uraniu sub neutroni lenți va produce o cantitate semnificativă de 239Pu ca produs secundar de activare. Ei au calculat că 239Pu este fisil, prezentând avantajul că – fiind diferit din punct de vedere chimic de uraniu – poate fi separat facil de acesta.[17]
Elementul a fost denumit Plutoniu în martie 1942,[1] numele elementului provenind de la cel al planetoidului Pluto, în analogie cu elementele precedente în sistemul periodic, uraniul și neptuniul. Seaborg a propus inițial numele Plutium. Alte denumiri considerate pentru acest element au fost Ultimium și Extemium, nume provenind din convingerea (greșită) că acesta ar fi ultimul element posibil a exista în sistemul periodic al elementelor.[18] Interesant este faptul că simbolul elementului (Pu) nu respectă normele în domeniu (conform normelor, acesta ar fi trebuit să fie Pl).[19]
Caracteristici[modificare | modificare sursă]
Caracteristici fizice[modificare | modificare sursă]



În condiții normale, plutoniul metalic este prezent în șase forme alotropice; o a șaptea (zeta, ζ) poate fi obținută la temperaturi înalte și într-un interval îngust de presiune.[20] Acesta face ca plutoniul să fie extrem de sensibil la schimbări de temperatură, presiune sau compoziție chimică, variații minore conducând la schimbări dramatice de volum (de până la 25%) sau structură cristalină, fenomene care însoțesc tranzițiile de fază.[21] Spre deosebire de majoritatea elementelor/materialelor, densitatea plutoniului crește prin topire cu 2,5%, iar metalul topit suferă o descreștere a densității odată cu creșterea temperaturii. În funcție de starea alotropică are densitatea cuprinsă între 16,00 și 19,86 g/cm3, fiind un metal greu.[21]
Acest comportament complicat face ca prelucrarea plutoniului metalic să fie foarte dificilă, cu schimbări greu de controlat între fazele de temperatură joasă. Faza delta (δ-phase) există în metalul pur doar în intervalul 310–452 °C, dar poate fi stabilizată la temperatura camerei prin aliere cu mici cantități de galiu, aluminiu sau ceriu. Aceasta conduce la îmbunătățirea proprietăților prelucrative pentru aplicații militare. Faza delta are un caracter metalic mai pronunțat, fiind aproximativ la fel de rezistentă și maleabilă precum aluminiul. Plutoniul este un element actinid transuranian, în stare metalică având culoarea alb-argintie (asemănătoare nichelului). În prezența aerului umed se acoperă rapid cu un strat de oxohidroxid de culoare gri, uneori cu tentă verzuie.[3][22] La temperatura camerei plutoniul apare în forma sa α (alfa). Aceasta este forma structurală cea mai comună a elementului, este aproximativ la fel de dură și fragilă precum fonta atunci când nu este aliată cu alte metale. Spre deosebire de cele mai multe metale, plutoniul nu este un bun conducător de căldură sau electricitate. Are un punct de topire scăzut (640 °C) și un punct de fierbere neobișnuit de ridicat (3228 °C).[3]
Din cauza dezintegrării alfa, piesele metalice de plutoniu se încălzesc; evident, cu cât timpul de viață a izotopului este mai redus, cu atât efectul termic asociat este mai puternic. O masă de 5 kg de 239Pu conține aproximativ 12,5 × 1024 atomi. Pentru un timp de înjumătățire de 24100 de ani, aproximativ 11,5 × 1012 din atomii săi se descompun în fiecare secundă prin emiterea unei particule alfa de 5,157 MeV. Aceasta corespunde unei puteri de 9,68 watt. Căldura produsă de decelerarea acestor particule alfa se simte la atingerea probei.[23][24]
Tot din cauza autoiradierii, eșantioanele de plutoniu amorfizează (parțial sau total) în timp,[25] într-un proces asemănător celui de metamictizare a mineralelor. Structura cristalină poate fi recuperată în urma tratamentelor termice.[25]
Rezistivitatea plutoniului la temperatura camerei este foarte ridicată pentru un metal și devine și mai ridicată la temperaturi mai scăzute, ceea fapt neobișnuit pentru metal.[26] Această tendință continuă până la 100 K, sub care rezistivitatea scade rapid pentru probele proaspăt preparate. Rezistivitatea crește în timp la aproximativ 20 K cu o viteză dictată de compoziția izotopică a eșantionului analizat.[26]
În condiții normale, plutoniul metalic este prezent în șase forme alotropice; o a șaptea (zeta, ζ) poate fi obținută la temperaturi înalte și într-un interval îngust de presiune.[27] Acesta face ca plutoniul să fie extrem de sensibil la schimbări de temperatură, presiune sau compoziție chimică, variații minore conducând la schimbări dramatice de volum (de până la 25%) sau structură cristalină, fenomene care însoțesc tranzițiile de fază.[25] Spre deosebire de majoritatea elementelor/materialelor, densitatea plutoniului crește prin topire cu 2,5%, iar metalul topit suferă o descreștere a densității odată cu creșterea temperaturii. În funcție de starea alotropică are densitatea cuprinsă între 16,00 și 19,86 g/cm3, fiind un metal greu.[25]
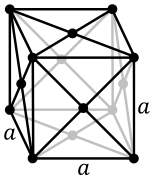
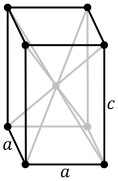
- Sistemele de cristalizare pentru plutoniul pur
-
Monoclinic (α)
-
Monoclinic cu baze centrate (β)
-
Ortorombic cu fețe centrate (γ)
-
Cubic cu fețe centrate (δ)
-
Tetragonal centrat (δ’)
-
Cubic centrat (ε)
Acest comportament complicat face ca prelucrarea plutoniului metalic să fie foarte dificilă, cu schimbări greu de controlat între fazele de temperatură joasă. Faza delta (δ-phase) există în metalul pur doar în intervalul 310–452 °C, dar poate fi stabilizată la temperatura camerei prin aliere cu mici cantități de galiu, aluminiu sau ceriu. Aceasta conduce la îmbunătățirea proprietăților prelucrative pentru aplicații militare. Faza delta are un caracter metalic mai pronunțat, fiind aproximativ la fel de rezistentă și maleabilă precum aluminiul.[25]
Caracteristici chimice[modificare | modificare sursă]
Structura electronică[modificare | modificare sursă]
Plutoniul este un element pentru care electronii 5f sunt situați la limita de tranziție delocalizare–localizare; și din acest punct de vedere, este un element extrem de complex.[28] Comportamentul anormal al plutoniului are la bază structura sa electronică; diferența energetică dintre substraturile 6d și 5f este extrem de mică. Dimensiunea substratului 5f abia este suficientă pentru a permite electronilor să formeze legături în interiorul rețelei cristaline, la limita dintre comportamentul localizat și cel delocalizat. Vecinătatea acestor nivele energetice conduce la configurații electronice multiple de energie joasă, cu energii aproape egale. Aceasta are drept rezultat competiția dintre configurațiile 5fn7s2 și 5fn−16d17s2, cu consecințe în ceea ce privește complexitatea comportamentului chimic. Natura direcțională a orbitalilor 5f este responsabilă de natura direcțională a legăturii covalente în diverși compuși anorganici sau complecși coordinativi ai plutoniului.[25][29]
Plutoniul metalic și aliaje[modificare | modificare sursă]

Plutoniul metalic poate fi preparat prin reducerea unor compuși ai plutoniului. Sunt cunoscute destule astfel de reacții, dar nu toate conduc la un produs suficient de pur. Dintre metodele pirochimice, cea mai utilizată este reducerea în topitură cu calciu metalic a PuF4, PuF3, PuCl3, PuO2 sau a amestecului PuO2–PuF4, metalul rezultat neavând nevoie de purificare ulterioară. Pentru separarea plutoniului metalic din amestecuri metalice este utilizată reacția acestuia cu H2, care conduce la hidruri de tip PuHx (x= 1,9-3,0) care – prin reîncălzire în vid – trec din nou în Pu0.[1]
Plutoniul este un metal foarte reactiv în contact cu oxigenul (este piroforic la 500°C)[3] sau cu aerul umed. Din cauza autoiradierii, suferă un proces de „îmbătrânire” (similar cu metamictizarea mineralelor). Metalul se dizolvă ușor în acid clorhidric sau percloric. Reacționează cu borul, carbonul, halogenii, azotul, fosforul, siliciul, oxigenul, hidrogenul etc.[1] Creuzetele utilizate la reducerea plutoniului trebuie construite din materiale care să reziste caracterului puternic reducător al acestuia. Metale refractare precum tantal sau wolfram, precum și oxizii, borurile, carburile, nitrurile stabile ale acestora, îndeplinesc acesta calitate. De asemenea, reacția în arc electric poate fi utilizată drept metodă alternativă pentru producerea a mici cantități de plutoniu metalic.[1]
În ceea ce privește aliajele, acestea pot fi obținute prin adăugare unui sau mai multe metale la o topitură de plutoniu; cele mai comune sunt cele cu galiu și aluminiu. Multe alte diagrame de fază au fost studiate și sistematizate în 1980.[30] Exemple de astfel de aliaje sunt:
- Plutoniu-galiu, utilizat pentru stabilizarea fazei δ (în vederea eliminării problemelor specifice fazei α) este aliajul cel mai utilizat pentru armele nucleare de implozie.[31]
- Plutoniu-aluminiu reprezintă o alternativă la aliajul Pu-Ga. Aluminiul a fost primul element considerat pentru stabilizarea fazei δ, dar tendința de a se activa ca urmare a bombardamentului cu particule alfa (cu emitere de neutroni) a redus în timp utilizarea sa. Aliajul Pu-Al poate fi utilizat – de asemenea – drept component al combustibilului nuclear.[32]
- Plutoniu-galiu-cobalt (PuCoGa5) este un supraconductor neconvențional, prezentând supraconductibilitate la 18,5 K, un ordin de mărime mai mult decât majoritatea altor astfel de materiale.[33]
- Plutoniu-zirconiu, la rândul său utilizat drept combustibil nuclear.[34]
- Plutoniu-ceriu și plutoniu-ceriu-cobalt, cu aceeași utilizare (combustibil pentru reactorul nuclear).[35]
- Plutoniu-uraniu (15–30% Pu) poate fi utilizat pentru reactori reproducători (care produc mai mult material fisil decât consumă). Este piroforic și susceptibil de coroziune aproape de punctul de autoaprindere, trecând în formă pulverulentă după expunere la aer; din aceste cauze, este necesară alierea cu alte componente. Aluminiul, carbonul sau cuprul nu îmbunătățesc rata de trecere în formă pulverulentă; aliajele ce conțin zirconiu și fier prezintă rezistență sporită la coroziune, dar trec în formă de pulbere după câteva luni de la expunerea la aer. Adăugarea de titan și/sau zirconiu ridică semnificativ punctul de topire al aliajului.[36]
- Plutoniu-uraniu-titan și plutoniu-uraniu-zirconiu au fost aliaje investigate drept combustibil nuclear. Adăugarea celui de-al treilea component crește rezistența la coroziune, reduce inflamabilitatea și îmbunătățește proprietăți precum ductilitatea, prelucrabilitatea, rezistența și expansiunea termică. Plutoniu-uraniu-molibden este aliajul cu cea mai bună rezistență la coroziune, formând un strat protector de oxid, dar titanul și zirconiul sunt preferate din motive fizice.[36]
- Thoriu-uraniu-plutoniu a fost investigat drept combustibil pentru reactori reproducători.[36]
Plutoniul în soluție[modificare | modificare sursă]

În soluții apoase[1] plutoniul prezintă patru stări de oxidare stabile, o a cincea disproporționând rapid. Culorile diferite ajută la recunoașterea facilă a stării de oxidare în care plutoniul este prezent: Pu(III), ca Pu3+; Pu(IV), ca Pu4+; Pu(V), ca PuO2+; Pu(VI), ca PuO22+; Pu(VII), ca PuO4–.
PuO2+ este instabil în soluție și disproporționează în Pu4+ și PuO22+; Pu4+ astfel format oxidează PuO2+ rămas, fiind redus la Pu3+. Astfel, soluțiile de PuO2+ au tendința de a se transforma în timp în amestecuri de Pu3+ și PuO22+.[17] O astfel de reacție – care implică patru stări de oxidare diferite ale aceluiași element – este unică în chimie:
Culorile soluțiilor de plutoniu depind atât de starea de oxidare a acestuia, cât și de natura anionului acid.[37] Acesta din urmă influențează gradul de complexare (adică modul în care atomii donori se leagă de atomul central) al speciei de plutoniu. În plus față de stările de oxidare amintite, starea de oxidare formală +2 este cunoscută pentru compusul de coordinație [K(2,2,2-cryptand)] [PuIICp″3], Cp″ = C5H3(SiMe3)2.[38]
Izotopi și proprietăți nucleare[modificare | modificare sursă]

Plutoniul este un element radioactiv, toți izotopii săi fiind radioactivi. Sunt cunoscuți 20 izotopi ai plutoniului cu masa cuprinsă între 228 și 247.[39]
Izotopul 238Pu este un emițător alfa (t1/2= 87,7 ani, produs de dezintegrare 234U, Eα=5,5 MeV).
Cel mai răspândit izotop este 239Pu, care se dezintegrează alfa (t1/2 de circa 24000 de ani, produs de dezintegrare 235U, Eα=5,2 MeV). 239Pu este un izotop fisil (fisionabil sub neutroni termici), ceea ce face ca utilizarea acestuia să fie strict controlată, din motive de proliferare nucleară.[40]
Izotopul 240Pu este un emițător alfa (t1/2 de circa 6560 de ani, produs de dezintegrare 236U, Eα=5,3 MeV). Este un izotop fertil, transformându-se – în urma activării sub neutroni rapizi – în 241Pu.[1][40]
Izotopul 241Pu este un emițător beta (timp de înjumătățire de 14,4 ani, produs de dezintegrare 241Am, Eβ=0,02 MeV). 241Pu este un izotop fisil, contribuind la randamentul total de fisiune. Totuși, transmutația sa relativ rapidă în 241Am, face ca prezența sa să fie nedorită în plutoniul militar sau pentru uz sub formă de combustibil nuclear de tip MOX.[40]
Izotopul 242Pu este un emițător alfa (t1/2 de circa 273000 ani, produs de dezintegrare 238U, Eα=5,0 MeV).[40]
Sistemul periodic al elementelor indică izotopul cosmogenic 244Pu ca fiind cel mai stabil izotop al plutoniului (t1/2 de circa 80,8 milioane de ani, produs de dezintegrare 240U).[40]
Pentru circa o treime din evenimentele de ciocnire a 239Pu cu neutroni se produce 240Pu. În funcție de conținutul de 240Pu (care nu fisionează sub neutroni lenți) în amestecul izotopic, plutoniul se clasifică în:[40]
- plutoniul pentru arme nucleare (eng. weapon grade plutonium), care conține mai puțin de 7% 240Pu;
- plutoniu pentru combustibil nuclear (eng. fuel grade plutonium), care conține 7–18% 240Pu;
- plutoniul de reactor, (eng. reactor grade plutonium), care conține mai mult de 18% 240Pu.
Răspândire[modificare | modificare sursă]
Este considerat a fi un element chimic sintetic, chiar dacă urme de 239Pu se găseau în natură în zăcămintele bogate în uraniu și înainte de 1945.[41] Acest izotop este produs ca urmare a proceselor de activare neutronică a 238U cu neutroni emiși în urma fisiunii spontane a altor nuclee de 238U.[40] Prezența sa a fost semnalată în zona reactorilor naturali de fisiune de la Oklo. Raportul 239Pu/U-nat în minereul uranifer de la Cigar Lake variază între 2,4×10−12 și 44×10−12.[42] Cantități și mai reduse de 238Pu se pot forma ca urmare a unei dezintegrări beta duble a nucleelor de 238U.[43]
De asemenea, 244Pu (cu timp de înjumătățire de 80,8 milioane de ani) este un radioizotop primordial[44] și a jucat probabil un oarecare rol în formarea mineralelor în primul miliard de ani de existență a Pământului; evidențe ale fisiunii spontane ale acestui radioizotop au putut fi găsite în meteoriți.[45] Prezența anterioară a 244Pu în Sistemul Solar a fost confirmată în baza excesului actual de produși ai seriei de dezintegrare 4n, fie 232Th (din dezintegrarea alfa), fie izotopi ai xenonului (din fisiune spontană). Din punct de vedere chimic, aceștia din urmă sunt mai ușor de pus în evidență comparativ cu raportul 244Pu/232Th (cele două actinide prezintă proprietăți chimice asemănătoare, astfel că excesul de thoriu nu conduce la concluzia evidentă că acesta ar rezulta ca fiică a plutoniului).[46] 244Pu are cel mai mare timp de înjumătățire dintre toți izotopii elementelor transuraniene, fiind produs doar în urma proceselor-r în supernove și în coliziunea stelelor neutronice; atunci când sunt ejectate nuclee de mare viteză în urma unor astfel de procese – nuclee care ajung pe Pământ – dintre nucleele elementelor transuraniene doar 244Pu mai poate fi detectat, mulțumită timpului său de înjumătățire îndelungat. Din acest motiv, urme de 244Pu de origine interstelară pot fi găsite pe fundul oceanelor. Cum 240Pu apare ca produs de dezintegrare al 244Pu, acesta trebuie să fie prezent la rândul său în echilibru secular cu părintele său, chiar dacă în cantități mult mai reduse.[47]
Inventarul de plutoniu a crescut semnificativ odată cu începutul erei atomice, fiind produs de activare a uraniului atât în reactori nucleari, cât și în bombele atomice în baza reacției nucleare:
Urme de plutoniu pot fi detectate în organismul uman,[14] prezența sa datorându-se contaminării radioactive (în natură sunt disperate câteva tone de plutoniu[40] ca urmare a testelor și accidentelor nucleare). Concentrația de plutoniu este estimată a fi de 0,37 Bq/kg sol și între 6ˑ10-8–1,4ˑ10-7 Bq/m3 aer.[48]
Producție[modificare | modificare sursă]
Proiectul Manhattan[modificare | modificare sursă]

În timpul celui de-Al Doilea Război Mondial, guvernul SUA a implementat proiectul Manhattan, cu rolul de a dezvolta arme nucleare. Locurile în care au fost implementate facilitățile de cercetare și de producție sunt Hanford (Washinton) și ceea ce sunt acum cunoscute ca fiind Oak Ridge National Laboratory (Tennessee), respectiv Los Alamos National Laboratory (New Mexico).[13][49]
239Pu a fost obținut în scopuri militare pentru prima oară prin bombardarea neutronică a 238U în reactorul moderat cu grafit „X-10” (Oak Ridge), care a intrat în regim critic pe 4 noiembrie 1943 și a produs pentru prima oară plutoniu la începutul anului următor. În noiembrie 1943, o primă probă de câteva micrograme de plutoniu metalic a fost produsă prin reducerea trifluorurii de plutoniu.[26] Astfel, plutoniul a devenit primul element sintetic vizibil cu ochiul liber.[26]
Ideal, plutoniul pentru aplicații militare ar trebui să fie monoizotopic, 239Pu. Probele transferate la Los Alamos în aprilie 1944 au indicat însă faptul că acestea conțineau concentrații ridicate de 240Pu (izotop care prezintă o probabilitate crescută de fisiune spontană) comparativ cu plutoniul produs în ciclotron.[24] Acest fapt conduce la prezența unei cantități însemnate de neutroni, crescând riscul de pre-detonare. Din acest motiv, proiectul prin care se dorea realizarea unei arme nucleară de tip proiectil (cu nume de cod „Thin Man” – Slăbuțul) a fost abandonat.[24] Acesta a fost înlocuit cu proiectul de implozie „Fat Man” – Grăsanul, mai complicat din punct de vedere tehnic.[24]

În martie 1945 a fost terminată construcția „Handford B”, primul reactor de producție izotopică a plutoniului la scară industrială.[50] Aici s-a produs materialul fisil necesar bombei nucleare „Fat Man”. În ianuarie 1945, plutoniul înalt purificat a fost supus unei concentrări finale și a fost apoi trimis la Los Alamos începând din februarie 1945, unde au fost definitivate bombele nucleare pe bază de plutoniu.[24]
Prima dintre acestea (în greutate totală de circa 4 tone, conținând 6,2 kg plutoniu) a fost detonată sub numele de cod Trinity la 16 iulie 1945 lângă Alamogordo (New Mexico). Succesul testului nuclear (circa 20% din plutoniu a fisionat în regim divergent) a condus la detonarea bombei „Fat Man” deasupra orașului Nagasaki (Japonia) în 9 august 1945.[24]
Era atomică[modificare | modificare sursă]
SUA și URSS au produs cantități însemnate (de ordinul sutelor de tone)[51] de plutoniu pentru aplicații militare prin activarea cu neutroni a 238U în reactori de iradiere.[49] La nivelul anului 2003, a fost estimat că pe Pământ ar fi existat o cantitate de circa 1830 t plutoniu,[1][49] rezultată atât din activități militare cât și civile. Alte aproximativ 70-75 t se adaugă anual la acest inventar (fiind obținute ca produs secundar în reactori nucleari comerciali prin activarea combustibilului nuclear).[52] Practic, 35 de țări dețin în prezent plutoniu, printre acestea numărându-se și România. Cantitatea de plutoniu estimată a exista în combustibilul nuclear epuizat rezultat din centrala nucleară de la Cernavodă era în 2003 de circa 2,4 t[49] (de câteva ori mai mare în prezent).
Plutoniul civil era distribuit în 2003 astfel: circa 1340 t este conținut de către în combustibilul nuclear epuizat și circa 330 t combustibil neiradiat (incluzând aici aproximativ 100 t de plutoniu militar declarat de către SUA și Rusia drept exces, în urma tratatelor de dezarmare).[49] Aproximativ 155 t se regăseau în componența armelor nucleare (existente sau dezasamblate).[14] Pentru a înțelege semnificația acestei cantități, acesta trebuie raportată la masa critică a 239Pu. Este evident deci că acest inventar trebuie administrat cu prudență pentru mult timp de acum înainte, într-un context politic, socioeconomic și tehnologic complex.[1]
[modificare | modificare sursă]
238Pu este obținut prin bombardarea cu neutroni a 237Np provenit din reactori de cercetare sau ținte de iradiere. 238Np, odată format, se dezintegrează rapid, formând 238Pu.
În prezent există foarte puține locuri în care se mai produce 238Pu. Rezerva NASA a scăzut la 35 kg, ceea ce ar fi suficient pentru misiunile asumate până în 2025.[40] Începând din 2019, Oak Ridge National Laboratory urmează să producă anual circa 1,5 kg 238Pu.[40]
Compuși ai plutoniului[modificare | modificare sursă]
Sunt cunoscuți diverși compuși binari cu:[1][30]
- hidrogenul (PuHx, x= 1,9-3,0): există diverse hidruri ale plutoniului, în general nestoechiometrice; toate sunt formate prin reacția directă a elementelor la temperaturi de sub 200 °C. De asemenea, astfel de compuși se formează (alături de Pu2O3 și PuO2) în urma reacției dintre plutoniul metalic și aerul umed la 200–350 °C.
- borul (PuB2, PuB4, PuB6, PuB12 și PuB66): borurile se formează prin reacția directă a elementelor la temperaturi de 800–1200 °C în atmosferă inertă la presiune scăzută.
- carbonul (Pu3C2, PuC1-x, Pu2C3 și PuC2): carburile se formează fie prin reacția dintre elemente, fie prin descompunerea unor compuși ai plutoniului (precum oxalați, acetați etc.) în atmosferă inertă. Carburile de plutoniu sunt considerate ca fiind potențiali combustibili nucleari sub formă de soluții solide cu uraniul: U1-xPuxC sau U1-xPuxC2.
- azotul (PuN) – posibil combustibil nuclear sub forma nitrură U1-xPuxN, fosforul (PuP), sulful (PuS, Pu3S4, PuS2), seleniul (PuSe, Pu3Se4, Pu2Se3, PuSe1,8–2,0), telurul (PuTe, Pu3Te4, PuTe3, PuTe1,81–2,02), siliciul (Pu5Si3, Pu3Si2, PuSi, Pu3Si5 și PuSi2).
- oxigenul (PuO, Pu2O3, PuO2 etc.): oxizii se formează la arderea plutoniului în aer sau la descompunere termică sau hidrotermală a unor compuși (de exemplu, oxalați). Dioxidul de plutoniu este un combustibil nuclear des utilizat sub formă de soluții solide cu uraniul: U1-xPuxO2 (MOX).
- halogenii: fluoruri și oxofluoruri (PuF3, PuOF, PuF4, PuF6), cloruri (PuCl3, PuCl4), bromuri și oxobromuri (PuBr3, PuOBr), ioduri și oxoioduri (PuI3, PuOI) etc. Halogenurile duble de plutoniu și metale alcaline (de exemplu, NaPuF4, KPuF4 etc.) sunt considerate precum combustibil nuclear sub formă de săruri topite.
Dintre compușii în stare solidă cei mai cunoscuți sunt:[1][53][54]
- plutonații (plutoniul apare sub formă anionică), în care plutoniul poate prezenta diverse stări de oxidare:
- Pu(IV): BaPuO3, SrPuO3, Li8PuO6, Ba2CePuO6 etc.;
- Pu(V): Li3PuO4, Ba3PuO5,5 etc.
- Pu(VI): K2PuO4, Rb2PuO4, Cs2PuO4, SrPuO4, Li4PuO5, Na4PuO5, L6PuO6, Na6PuO6, Ba3PuO6 etc.
- Pu(VII): Li5PuO6, Na5PuO6.
- combinații în formă cationică cu elemente ale blocului p și d:
- Pu(III): PuAlO3, PuScO3, PuVO3, PuCrO3, PuAsO4, PuPO4 etc.
- Pu(IV): PuSiO4, PuGeO4, Pu(TeO3)2, Pu(TaO3)4, PuP2O7 etc.
Extrem de importanți sunt oxalații, care se descompun termic la dioxid de plutoniu de dimensiuni nanometrice (ceea ce conduce la pulberi de combustibil cu sinterabilitate foarte bună). O metodă recentă demonstrează că oxalatul de Pu(IV) poate fi descompus hidrotermal la PuO2 la numai 95 °C.[55]
-
Structura PuO2
-
Structura PuB2
-
Structura PuB6
-
Structura PuBr3
-
Structura PuF4
-
Structura PuPO4
-
Structura PuP2O7
Compuși coordinativi: având în vedere multiplele stări de oxidare și geometrii posibile, chimia de coordinație a plutoniului este extrem de diversă. Astfel, au fost sintetizați din soluții apoase sau neapoase diverși compuși ai Pu(III), Pu(IV) și Pu(VI) cu liganzi extrem de diverși din punct de vedere al tipului atomului donor și al denticității (halogenură, fosfat, nitrat, amină, amidă, salen, etc.).[56][57][58]
Utilizare[modificare | modificare sursă]
Material exploziv[modificare | modificare sursă]

Plutoniul este materialul fisionabil esențial pentru armele nucleare moderne. Tonul proliferării nucleare l-a dat competiția SUA-URSS. De atunci au avut loc peste 2000 de teste nucleare, dintre care aproximativ 500 atmosferice.[14] Cu foarte puține excepții (bazate pe uraniu îmbogățit), acestea au utilizat plutoniu ca material exploziv de fisiune. Singurele țări cunoscute că au detonat asemenea dispozitive sunt Statele Unite ale Americii, Uniunea Sovietică, Marea Britanie, Franța, China, India, Pakistan și Coreea de Nord.[40] Producea și testarea armelor nucleare a condus la contaminarea excesivă a anumitor regiuni, peste limitele admisibile (în fosta URSS, SUA, Atolul Bikini etc.), ceea ce le face nelocuibile pentru mult timp de acum încolo.[40]
Plutoniul poate fi folosit pentru fabricarea armelor radiologice (bomba murdară).[59]
Combustibil pentru reactori nucleari[modificare | modificare sursă]
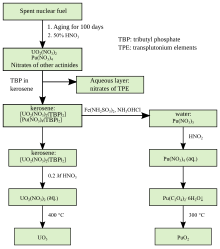
Combustibilul nuclear epuizat rezultat din reactori nucleari răciți cu apă ușoară conține un amestec de izotopi ai plutoniului, anume: 238Pu, 239Pu, 240Pu și 242Pu. Prin reprocesare, acesta poate fi separat și reutilizat sub formă de combustibil (U,Pu)O2 (MOX, eng. „mixed oxides”) în același tip de reactori. Acest tip de combustibil este utilizat la scară largă în scopuri comerciale încă din anii '80.[60] Practic, 5% din combustibilul nuclear utilizat în prezent este de tip MOX, producând circa o treime din totalul de energie de origine nucleară la nivel mondial.[40]
Prin captură neutronică, conținutul de 240Pu și 242Pu devine semnificativ, acest plutoniu „ars”, nemaifisionând sub neutroni termalizați, ci doar sub neutroni rapizi. Acest plutoniu de reactor mai poate fi utilizat doar în reactori cu neutroni rapizi,[61] sau poate fi stocat, constituind componenta de viață lungă (tip C) a deșeurilor radioactive. Cu cât gradul de ardere este mai ridicat, cu atât cantitatea relativă de 239Pu în amestecul izotopic este mai scăzută, ceea ce conduce la reducerea riscului de proliferare nucleară.[61] Cu toate acestea, IAEA clasifică[40] – în mod conservativ – toți vectorii de plutoniu cu potențial uz direct, adică „un material nuclear care poate fi utilizat pentru producerea de explozivi nucleari în absența transmutației nucleare sau a îmbogățirii izotopice”.
În vederea reutilizării, plutoniul este supus unor operații tehnologice de separare și purificare. Impuritățile care însoțesc plutoniul în combustibilul nuclear epuizat sunt alte actinide (uraniul și actinidele minore: neptuniu, americiu, curiu) și produși de fisiune (bariu, ceriu, cesiu, lantan, molibden, paladiu, praseodim, samariu, stronțiu, xenon, zirconiu etc.).[1] Procesul industrial prin care uraniul și plutoniul sunt izolate de produșii de fisiune și celelalte materiale ce intră în compoziția combustibilul uzat se numește reprocesare.[62]
Metodele de separare a plutoniului (și a altor actinide) din combustibilul iradiat pot fi clasificate în două grupe majore: procese apoase și neapoase.[1] Procesele apoase sunt de tip lichid–lichid (extracție cu solvenți), de schimb ionic și de precipitare. Exemple de procese neapoase sunt electrorafinarea în săruri topite și volatilizarea fluorurilor. Aproape toate metodele de separare se bazează pe stările de oxidare multiple pe care plutoniul le poate adopta în forme chimice diferite. Cel mai cunoscut proces de separare a plutoniului este PUREX (Plutonium, Uranium, Reduction, EXtraction), un proces de extracție cu tributil fosfat. Un alt proces apos foarte eficient este precipitarea cu acid oxalic a PuIV.[63]
Sursă de energie[modificare | modificare sursă]



Dintre cei peste 2900 de radioizotopi cunoscuți în prezent, doar 22[4] prezintă un cumul de proprietăți nucleare care să-i recomande pentru utilizarea lor ca surse de putere ca generatoare termoelectrice radioizotopice (eng. „Radioisotope Thermoelectric Generators”, RTG) utilizate la sondele spațiale (în baza efectului Seebeck).[40] 238Pu este scump, relativ greu de obținut în prezent și ridică probleme de radioprotecție pentru operatori. Chiar și așa, acesta este considerat în continuare de către NASA ca fiind cel mai indicat pentru astfel de aplicații.[40]
Puterea specifică rezultată ca urmare a evenimentelor de dezintegrare (0,57 W/g) este suficientă pentru utilizarea sa ca stimulator cardiac, surse de putere pentru generatoarele termoelectrice, balize de navigare etc. 238Pu a fost utilizat ca sursă de putere pentru circa 30 de vehicule spațiale ale NASA. De exemplu, sonda spațială Cassini-Huygens are trei generatori cu 33 kg 238PuO2, care produc o 870 W.[40] În misiunile recente se utilizează generatoarele termoelectrice radioizotopice pentru misiuni multiple (eng. „Multi-Mission Radioisotope Thermoelectric Generators”, MMRTG).[4]
Sursă de neutroni[modificare | modificare sursă]
Dezintegrarea alfa a 239Pu a fost utilizată de-a lungul timpului pentru producerea de surse de neutroni de tip plutoniu-beriliu în baza reacției nucleare:[64]
Energia acestei reacții nucleare este de 5,7 MeV și se împarte între produșii de reacție. Prezența unei cantități oarecare de 241Pu este binevenită, întrucât acesta se dezintegrează în 241Am, la rândul său emitor alfa. astfel, fluxul de neutroni va crește în prima parte a vieții sursei.[64]
Precauții[modificare | modificare sursă]
Aspectele legate de piroforicitatea metalului au fost deja semnalate, iar cele referitoare la siguranța reactorilor nucleari nu fac obiectul acestui articol.
Masa critică[modificare | modificare sursă]
Prin masă critică se înțelege cea mai mică cantitate de material fisionabil, care este capabil a întreține o reacție nucleară în lanț. Masa critică a unui material fisionabil depinde de numeroase caracteristici ale elementului (sau ale izotopului acestuia). Masa critică a plutoniului este de ordinul kilogramelor, depinzând de compoziția amestecului izotopic, geometria sistemului și materialele reflectoare utilizate. Ideal, 4 kg de 239Pu sunt suficiente pentru întreținerea reacției nucleară în lanț.[40] În practică însă, acesta este mai mare (de exemplu, Fat Man a conținut 6,19 kg plutoniu).[65]
Sunt necesare precauții suplimentare atunci când se manipulează cantități de plutoniu cu o masă apropiată de cea critică, având în vedere faptul că acesta este de doar o treime din cea corespunzătoare izotopului 235U.[23] O masă critică de plutoniu emite cantități letale de neutroni și radiații gama.[26] În soluție plutoniul formează mai ușor o masă critică comparativ cu aceeași cantitate în formă solidă, întrucât este moderat de atomii de hidrogen din apă.[52]
Câteva accidente de criticalitate (unele fatale, ca urmare a iradierii acute) au fost raportate de-a lungul timpului în SUA (Hanford, Idaho Falls, Los Alamos, Oak Ridge, Wood River Junction), URSS (Electrostal, Mayak, Novosibirsk, Obninsk, Tomsk), Marea Britanie (Windscale) și Japonia (Tokay-mura).[66]
Toxicitate[modificare | modificare sursă]

Plutonul ridică probleme de toxicitate din două puncte de vedere: radiotoxicitatea, respectiv toxicitatea plutoniului ca metal greu.
Având în vedere răspândirea redusă,[48] expunerea la cantități semnificative din punct de vedere toxicologic poate fi întâlnită doar în cazul lucrătorilor expuși profesional sau al persoanelor aflate în raza de acțiune a unui accident/test nuclear; astfel, informații asupra (radio)toxicologiei plutoniului provin din studiul supraviețuitorilor dezastrului de la Nagasaki, al militarilor implicați în testele nucleare și al personalului expus profesional.[67] S-a raportat și un număr redus de subiecți umani injectați cu câteva micrograme de plutoniu, în absența consimțământului acestora; acest episod este considerat o abatere majoră de la etica medicală.[5]
Aspectele de expunere externă sunt similare expunerii la oricare alt radioizotop ca sursă de radiații ionizante. Astfel, expunerea acută sau cronică poate produce probleme de sănătate, incluzând aici sindromul iradierii acute, alterarea materialului genetic sau diverse forme de cancer radioindus.[68] Dimpotrivă, dezintegrarea predominant alfa și timpii de înjumătățire ridicați fac ca izotopii plutoniului să fie mai puțin periculoși decât – de exemplu – cei cu uz medial.[69]
Doar 0,04% din plutoniul ingerat este absorbit de către organismul uman. Odată încorporat însă, este excretat foarte greu, cu un timp biologic de înjumătățire de circa 200 de ani; compușii plutoniului se acumulează în măduva osoasă; de asemenea, acesta este colectat și concentrat în ficat. Astfel de cazuri de contaminare internă au fost detectate și relaționate cu incidența cancerului pulmonar semnalat în cazul lucrătorilor expuși profesional.[69] Pentru limitarea expunerii externe și a reducerii riscului încorporării, manipularea plutoniului se face fără contact direct.
Referințe[modificare | modificare sursă]
- ^ a b c d e f g h i j k l m n o p D.L. Clark, S.S. Hecker, G.D. Jarvinen, M.P. Neu. Plutonium. Cap. VII, in: Chemistry of the actinide and transactinide elements, 4th edition, eds. L.R. Morss, N.M. Edelstein, J. Fuger. Springer.
- ^ Herman V. Henderickx, Plutonium: blessing or curse?, Copper Beech, 1999 - Nuclear energy - 119 pages
- ^ a b c d M.A. Haschke, T.H. Allen, L.A. Morales, Surface and corrosion chemistry of plutonium, Los Alamos Science 26 (2000) 257
- ^ a b c „World Nuclear Association - Nuclear Reactors and Radioisotopes for Space”. Accesat în .
- ^ a b W. Moss, R. Eckhardt. „The Human Plutonium Injection Experiments, Los Alamos Science 23 (1995) 178-233”. Accesat în .
- ^ Johnston, Wm. Robert. „K-19 submarine reactor accident, 1961”. Database of radiological incidents and related events. Johnston's Archive. Arhivat din original la . Accesat în .
- ^ Johnston, Wm. Robert. „K-27 submarine reactor accident, 1968”. Database of radiological incidents and related events. Johnston's Archive. Arhivat din original la . Accesat în .
- ^ N.E. Holden. „A short history of nuclear data and its evaluation, 51st Meeting of the USDOE Cross Section Evaluation Working Group at BNL November 5-7, 2001”. Accesat în .
- ^ Enrico Fermi. „Artificial radioactivity produced by neutron bombardment: Nobel Lecture”. Accesat în .
- ^ L. Darden, Lindley. The Nature of Scientific Inquiry. College Park: Department of Philosophy, University of Maryland. Retrieved 3 ianuarie 2008
- ^ „Nuclear reactions. Why the americans faar nuclear power? Interviu cu Glenn Seaborg”. Accesat în .
- ^ Jeremy Bernstein: Plutonium: A History of the World's Most Dangerous Element. Cornell University Press, 2009. ISBN [./https://en.wikipedia.org/wiki/Special:BookSources/0-8014-7517-1 0-8014-7517-1]
- ^ a b c G.T. Seaborg. „Plutonium story, Actinides-1981 conference, Pacific Grove, CA, USA, 10 Sep 1981”. Accesat în .
- ^ a b c d J. Emsley. „"Plutonium". Nature's Building Blocks: An A–Z Guide to the Elements. Oxford (UK) Oxford University Press, 2001”. Accesat în .
- ^ G.T. Seaborg, E. Seaborg, Adventures in the Atomic Age: From Watts to Washington. Farrar, Straus and Giroux, 2001
- ^ J. W. Kennedy, G. T. Seaborg, E. Segrè, and A. C. Wahl. „Properties of 94(239), Phys. Rev. 70 (1946) 555–556”.
- ^ a b D.L. Clark. „The chemical complexity of plutonium, Los Alamos Science, 26 (2000) 364-381”. Accesat în .
- ^ Public Broadcasting Service, 1999. „Frontline interview with Seaborg”. Accesat în .
- ^ Alegerea evidentă a simbolului ar fi fost Pl, dar Seaborg a sugerat Pu, așa cum un copil ar exclama: „Pee-yoo!” când miroase ceva rău. Seaborg a crezut că va fi dojenit pentru această sugestie, dar comitetul de numire a acceptat simbolul fără probleme.
- ^ R.D. Baker, S.S. Hecker, D.R. Harbur. „Plutonium: a wartime nightmare but a metallurgist's dream, Los Alamos Science. Los Alamos National Laboratory, 148 (1983) 150-151”. Accesat în .
- ^ a b S.S. Hecker. „Plutonium and its alloys: from atoms to microstructure, Los Alamos Science, 26 (2000) 290-335” (PDF). Accesat în .
- ^ Actinide Research Quarterly. Los Alamos (NM): Los Alamos National Laboratory (semestrul al treilea, 2008), 09/02/2010: „În timp ce dioxidul de plutoniu este, în mod normal, de culoarea uleiului de măsline, probele pot avea diferite culori. Se consideră, în general, că aceasta (culoarea) este o caracteristică a purității chimice, a stoichiometriei, a dimensiunii particulelor și a metodei de preparare, deși culoarea care rezultă dintr-o metodă dată de preparare nu este întotdeauna reproductibilă.”
- ^ a b Heiserman, David L. (1992). "Element 94: Plutonium". Exploring Chemical Elements and their Compounds. New York (NY): TAB Books. pp. 337–340.
- ^ a b c d e f L. Hoddeson, P.W. Henriksen, R.A. Meade, C. Westfall (). Critical assembly: a technical history of Los Alamos during the Oppenheimer years, 1943-1945. New York: Cambridge University Press.
- ^ a b c d e f S.S. Hecker. „Plutonium and its alloys: from atoms to microstructure, Los Alamos Science, 26 (2000) 290-335” (PDF). Accesat în .
- ^ a b c d e W.N. Miner, F.W. Schonfeld, Plutonium. In C.A. Hampel. The Encyclopedia of the Chemical Elements. New York (NY): Reinhold Book Corporation (1968) 540–546
- ^ R.D. Baker, S.S. Hecker, D.R. Harbur. „Plutonium: a wartime nightmare but a metallurgist's dream, Los Alamos Science. Los Alamos National Laboratory, 148 (1983) 150-151”. Accesat în .
- ^ „Against all odds: a plutonium compound is the latest superconductor,”. Accesat în .
- ^ L. Morss, L.B. Asprey. „Actinoid element - Chemical element group”. Accesat în .
- ^ a b O.J. Wick. „Plutonium Handbook, American Chemical Society, 1980, 966 pp”. Accesat în .
- ^ Kolman, D. G. & Colletti, L. P. (2009). "The aqueous corrosion behavior of plutonium metal and plutonium–gallium alloys exposed to aqueous nitrate and chloride solutions". ECS transactions. Electrochemical Society. 16 (52): 71
- ^ Hurst, D. G.; Ward, A. G. (1956). Canadian Research Reactors. Ottawa: Atomic Energy of Canada Limited.
- ^ Curro, N. J. (2006). Unconventional superconductivity in PuCoGa5. Los Alamos National Laboratory
- ^ McCuaig, Franklin D. Pu–Zr alloy for high-temperature foil-type fuel. U.S. Patent 4,059,439, 22/11/1977
- ^ Jha, D. K. (2004). Nuclear Energy. Discovery Publishing House.
- ^ a b c A. E. Kay, H. B. Waldron (1965). Plutonium 1965: Proceedings of the Third International Conference on Plutonium, London, 1965. Chapman & Hall, 1967.
- ^ G. Matlack, (2002). A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. Los Alamos National Laboratory. LA-UR-02-6594
- ^ C.J. Windorff, G.P. Chen, J.N. Cross, W.J. Evans, F. Furche, A.J. Gaunt, M.T. Janicke, S.A: Kozimor, B.L. Scott, „Identification of the Formal +2 Oxidation State of Plutonium: Synthesis and Characterization of {PuII[C5H3(SiMe3)2]3}−”. J. Am. Chem. Soc. 139 (2017): 3970–3973
- ^ J.B. Roberto, C.W. Alexander, R.A. Boll, J.D. Burns, J.G. Ezold, L.K. Felker, S.L. Hogle, K.P. Rykaczewski. „Actinide targets for the synthesis of super-heavy elements, Nuclear Physics A 944 (2015) 99-116”. Accesat în .
- ^ a b c d e f g h i j k l m n o p q r „World Nuclear Association - Plutonium”. Accesat în .
- ^ G.T. Seaborg, M.L. Perlman. „Search for elements 94 and 93 in Nature. Presence of 94(239) in pitchblende, J. Am. Chem. Soc. 70 (1948) 1571–1573”. Accesat în .
- ^ D. Curtis, J. Fabryka-Martin, D. Paul, J. Cramer, (1999). "Nature's uncommon elements: plutonium and technetium". Geochimica et Cosmochimica Acta. 63(2): 275–285.
- ^ I. Peterson, „Uranium displays rare type of radioactivity”. Science News. Wiley-Blackwell. 140 (23): 373.
- ^ R.M. Hazen, R.C. Ewing, D.S. Sverjensky. „Evolution of uranium and thorium minerals, Am. Mineral. 94 (2009) 1293-1311” (PDF). Accesat în .
- ^ I.D. Hutcheon, B.P. Price, „Plutonium-244 Fission Tracks: Evidence in a Lunar Rock 3.95 Billion Years Old”. Science, 176 (4037): 909–911.
- ^ J. Kunz, T. Staudacher, C.J. Allègre, „Plutonium-Fission Xenon Found in Earth's Mantle”, Science. 280 (5365): 877–880
- ^ A. Wallner, T. Faestermann, J. Feige, C. Feldstein, K. Knie, G. Korschinek, W Kutschera, A. Ofan, M. Paul, F. Quinto, G. Rugel, P. Steiner, P. (30 martie 2014). „Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis”. Nature Communications. 6 (2014)
- ^ a b „Toxicological profile of plutonium, US-DoE Report” (PDF). Accesat în .
- ^ a b c d e D, Albright, K. Kramer. „Plutonium Watch: Tracking Plutonium Inventories” (PDF). Accesat în .
- ^ Darleane C Hoffman, Albert Ghiorso, Glenn T Seaborg, The Plutonium People, pp. 43-99, in The Plutonium People - The Inside Story, Imperial College Press (2000), 564 pp.
- ^ N. Zarimpas. „Building transparency in nuclear-weapon states: the political and technological dimensions, IAEA-SM-367/9/06” (PDF). Accesat în .
- ^ a b Lide, D.R. (). Handbook of Chemistry and Physics (87th ed.). Boca Raton: CRC Press, Taylor & Francis Group.
- ^ S. Cotton, Lanthanide and actinide chemistry, 2006, John Wiley & Sons, Ltd.
- ^ J.-F. Vigier, K. Popa, L. Martel, D. Manara, O. Dieste Blanco, D. Freis, R.J.M. Konings,. „Plutonium and americium aluminate perovskites, Inorg. Chem. 58 (2019) 9118-9126”. Accesat în .
- ^ K. Popa, O. Walter, O. Dieste Blanco, A. Guiot, D. Bouëxière, J.-Y. Colle, L. Martel, M. Naji, D. Manara. „A low-temperature synthesis method for AnO2 nanocrystals (An = Th, U, Np, and Pu) and associate solid solutions, CrystEngComm 20 (2018) 4614-4622”. Accesat în .
- ^ M.P. Neu, J.H. Matonic, D.M. Smith, B.L. Scott. „Structures of plutonium coordination compounds: A review of past work, recent single crystal x-ray diffraction results, and what we're learning about plutonium coordination chemistry, AIP Conference Proceedings 532 (2000) 381”. Accesat în .
- ^ S.D. Reilly, A.J. Gaunt, B.L. Scott, G. Modolo, M. Iqbal, W. Verboom, M.J. Sarsfieldd. „Plutonium(IV) complexation by diglycolamide ligands-coordination chemistry insight into TODGA-based actinide separations, Chem. Commun. 48 (2012) 9732-9734”. Accesat în .
- ^ O. Walter. „Actinide organometallic complexes with π‐ligands, Chem. Eur. J., in press”. Accesat în .
- ^ C. Brown, Transcendental terrorism and dirty bombs: Radiological weapons threat revisited. Occasional Paper: Center for Strategy and Technology. 54 (2006) 24–27
- ^ „World Nuclear Association - Mixed Oxide (MOX) Fuel”. Accesat în .
- ^ a b C.E. Till, Y.A. Chang. „Plentiful energy: The story of the integral fast reactor, the complex history of a simple reactor technology, with emphasis on its scientific basis for non-specialists,” (PDF). Accesat în .
- ^ Anthony Andrews. „Nuclear Fuel Reprocessing: U.S. Policy Development, CRS Report for Congress” (PDF). Accesat în . line feed character în
|titlu=la poziția 39 (ajutor) - ^ O. Walter, K. Popa, O. Dieste Blanco. „Hydrothermal decomposition of actinide(IV) oxalates: a new aqueous route towards reactive actinide oxide nanocrystals, Open Chem. 14 (2016) 170-174” (PDF). Accesat în .
- ^ a b H.R. Vega-Carrillo, V.M. Hernández-Dávila, T. Rivera-Montalvo, A. Sánchez. „Characterization of a 239PuBe isotopic neutron source” (PDF). Accesat în .
- ^ Richard G. Hewlett, Oscar E. Anderson, Jr. „The New World, 1939/1946, A History of The United States Atomic Energy Commission, Volume I” (PDF). Accesat în . line feed character în
|titlu=la poziția 50 (ajutor) - ^ T.P. McLaughlin, S.P. Monahan, N.L. Pruvost, V.V. Frolov, B.G. Ryazanov, V.I.Sviridov. „A review of criticality incidents, 2000 Revision, Los Alamos report LA-13638” (PDF). Accesat în .
- ^ "Radiation Exposure and Contamination - Injuries; Poisoning - Merck Manuals Professional Edition". Merck Manuals Professional Edition. Retrieved 2017-09-06.
- ^ "Radiation Exposure and Contamination - Injuries; Poisoning - Merck Manuals Professional Edition". Merck Manuals Professional Edition. Retrieved 2017-09-06.
- ^ a b J. Grellier, W. Atkinson, P. Bérard, D. Bingham, A. Birchall, E. Blanchardon, R. Bull, I. Guseva Canu, C. Challeton-de Vathaire, R. Cockerill, M.T. Do, H. Engels, J. Figuerola, A. Foster, L. Holmstock, C. Hurtgen, D. Laurier, M. Puncher, A.E. Riddell, E. Samson, I. Thierry-Chef, M. Tirmarche, M. Vrijheid, E. Cardis,. „Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides, Epidemiology 28 (2017) 675-684”. Accesat în .
Vezi și[modificare | modificare sursă]
- Actinide
- Al Doilea Război Mondial
- Armă nucleară
- Centrală nucleară
- Ciclul combustibilului nuclear
- Chimia actinidelor
- Combustibil nuclear
- Combustibil nuclear epuizat
- Contaminare radioactivă
- Deșeu radioactiv
- Distrugere reciprocă asigurată
- Energie nucleară
- Explozie nucleară
- Fat Man
- Fisiune nucleară
- Masă critică
- Material nuclear
- Metallurgical Laboratory
- Poligonul de teste nucleare din Nevada
- Poligonul Semipalatinsk
- Proliferare nucleară
- Radiofobie
- Război nuclear
- Războiul Rece
- Reactor nuclear
- Reacție nucleară în lanț
- Serie de dezintegrare
- Sindromul iradierii acute
- Test nuclear
- Tratatul de Neproliferare Nucleară
- Uraniu
Legături externe[modificare | modificare sursă]
- en IAEA – Atoms for Peace Speech (Dwight D. Eisenhower)
- en IAEA – Nuclear Explosions
- en IAEA – Safe Handling and Storage of Plutonium
- en IAEA – Safety of Uranium and Plutonium Mixed Oxide Fuel Fabrication Facilities
- en International Panel on Fissile Materials – 2016 civilian plutonium reports submitted to IAEA
- en OECD – Plutonium Fuel
- en Plutonium (by V.N. Miner)
- en Plutonium Watch (by D. Albright and K. Kramer)
| |||||||||||||||||||||||||||||||||||||

![{\displaystyle {\begin{aligned}{\ce {{^{238}_{92}U}+{^{2}_{1}D}->}}&{\ce {{^{238}_{93}Np}+2_{0}^{1}n}}\\&{\ce {^{238}_{93}Np->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b584c932e52212178b2befe7a512a7b28f87d35)







![{\displaystyle \mathrm {^{241}_{\ 94}Pu\ {\xrightarrow[{14,35\ a}]{\beta ^{-}}}\ _{\ 95}^{241}Am\ {\xrightarrow {(n,\gamma )}}\ _{\ 95}^{242}Am\ {\xrightarrow[{16,02\ h}]{\beta ^{-}}}\ _{\ 96}^{242}Cm\ \left({\xrightarrow[{162,8\ d}]{\alpha }}\ _{\ 94}^{238}Pu\right)} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6e05aaf59bc4d437fa8fa526b3d79bd33d12568)
![{\displaystyle {\ce {{^{238}_{92}U}+{^{1}_{0}n}->{^{239}_{92}U}->[\beta ^{-}][23.5\ {\ce {min}}]{^{239}_{93}Np}->[\beta ^{-}][2.3565\ {\ce {d}}]{^{239}_{94}Pu}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9ba9e4744226a97ce8a41fd5b5e50b18cc259a9)
![{\displaystyle {\ce {{^{237}_{93}Np}+{^{1}_{0}n}->{^{238}_{93}Np}->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/343cc24d9bee33b698aca91af8a93779ec4ea9c8)








