Alcan

Alcanii (cunoscuți și sub denumirea de parafine) sunt hidrocarburi saturate aciclice, fiind alcătuiți din atomi de carbon și de hidrogen aranjați într-o catenă liniară sau ramificată. Alcanii sunt considerați ca fiind cei mai simpli compuși organici, deoarece în structura lor se regăsesc doar legături simple de tipul carbon-hidrogen și carbon-carbon, iar atomii de carbon se află în starea de hibridizare sp3.[1] Alcanii au formula generală CnH2n+2, iar această clasă de hidrocarburi începe cu cel mai simplu compus organic, metanul (CH4), pentru care n = 1. Așadar, primul reprezentat al seriei omoloage este metanul, iar următorii trei termeni ai seriei omoloage sunt: etanul (C2H6), propanul (C3H8) și butanul (C4H10).[2]
Alcanii sunt adesea priviți ca și compuși de bază în chimia organică, deoarece majoritatea compușilor organici pot fi priviți ca derivați ai alcanilor, în molecula cărora se grefează diverse grupe funcționale. Denumirea de grupă alchil, în general simbolizată R, face referire la acea grupă care provine structural de la catena unui alcan. Alcanii superiori (cei care au catena formată din mai mult de 17 atomi de carbon) reprezintă o categorie aparte de alcani, întrucât aceștia sunt compuși solizi în condiții standard de temperatură și presiune.
Alcanii nu sunt foarte reactivi și au o activitate biologică limitată. Principalele surse comerciale de alcani sunt petrolul și gazele naturale.[3]
Nomenclatură
[modificare | modificare sursă]Nomenclatura IUPAC pentru alcani se bazează pe identificarea catenelor hidrocarbonate. Catenele liniare, neramificate, saturate, se denumesc cu ajutorul unor prefixe numerice de origine greacă, care indică numărul atomilor de carbon, la care se adaugă sufixul -an.[4][2] În 1866, August Wilhelm von Hofmann a sugerat nomenclatura sistematică bazată pe utilizator vocalelor a, e, i, o și u, pentru crearea sufixelor -an, -en, -in, -on, -un pentru hidrocarburile cu formulele generale CnH2n+2, CnH2n, CnH2n−2, CnH2n−4, CnH2n−6.[5]
Mai jos se află un tabel cu prefixele folosite pentru denumirea primilor alcani, și a unor alcani superiori potriviți ca exemple:
| Numărul atomilor de carbon | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 20 | 30 | 40 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Prefix | Met | Et | Prop | But | Pent | Hex | Hept | Oct | Non | Dec | Undec | Dodec | Tridec | Tetradec | Pentadec | Hexadec | Eicos | Triacont | Tetracont | Pentacont |
Alcani liniari
[modificare | modificare sursă]
Alcanii liniari sunt adesea denumiți cu ajutorul prefixului n-, care provine de la normal. Deși acest prefix poate fi omis, acesta ar trebui folosit atunci când este necesară diferențierea dintre un anumit alcan liniar și izomerii de catenă ai acestuia (de exemplu, n-hexan și 2- sau 3-metilpentan). Primii patru alcani ai acestei serii au denumiri speciale (metan, etan, propan, butan). Denumirile au fost menținute pentru valoarea lor istorică, provenind de la metanol, eter, acid propionic și acid butiric. Următorii alcani liniari se denumesc conform regulilor deja discutate, prin adăugarea prefixului ce indică numărul atomilor de carbon și al sufixului -an (pentan, hexan, heptan, etc.).[6]
Alcani ramificați
[modificare | modificare sursă]Alcanii ramificați cu structură simplă au adesea denumiri comune, distincția făcându-se cu ajutorul unui prefix; de exemplu, izomerii n-pentanului sunt izopentanul și neopentanul. Totuși, pentru cei cu structură mai complexă se folosește nomenclatura IUPAC.
Izomerie și radicali
[modificare | modificare sursă]
Biciclo[1.1.0]butanul este singurul cu formula C4H6.
Fiind compuși simpli, alcanii prezintă puține tipuri de izomerie, totuși și în cazul acestora pot apărea destule situații interesante. Alcanii prezintă izomeri de catenă, izomeri de conformație (sau conformeri), iar unii pot fi chiar și chirali, cum este de exemplu 3-metilhexanul.
Izomeria de catenă
[modificare | modificare sursă]Alcanii care au cel puțin patru atomi de carbon prezintă izomeri de structură, întrucât catena poate fi modelată în moduri diferite pentru aceeași formulă chimică moleculară dată. Cel mai simplu izomer al unui astfel de alcan se numește normal-alcan (adesea notat n-alcan) și este acel izomer care prezintă catena liniară, fără nicio ramificație (prin ramificație se înțelege orice grupă alchil grefată pe catena cea mai lungă).[7] Când apar ramificații, izomerii se numesc izo-alcani. Numărul izomerilor posibili pentru un alcan crește direct proporțional cu numărul atomilor de carbon din catenă. De exemplu, pentru alcanii aciclici avem:[8]
- C1: metanul este singurul
- C2: etanul este singurul
- C3: propanul este singurul
- C4: avem 2 izomeri, n-butanul și izobutanul
- C5: avem 3 izomeri, n-pentanul, izopentanul și neopentanul
- C6: avem 5 izomeri, n-hexanul, 2-metilepentanul, 3-metilepentanul, 2,2-dimetilbutanul și 2,3-dimetilbutanul
- C12: avem 355 izomeri
- C32: avem 27.711,253,769 izomeri
- C60: avem 22.158.734.535.770.411.074.184 izomeri
Izomeria de conformație
[modificare | modificare sursă]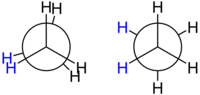
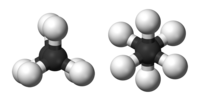
Formulele de structură și unghiurile de legătură nu sunt de cele mai multe ori suficiente pentru descrierea completă a geometriei unei molecule. Există un anumit grad de libertate pentru fiecare legătură carbon-carbon: unghiul de torsiune dintre atomii sau grupele de atomi legate de atomii de la fiecare capăt al legăturii. Aranjamentul spațial descris cu ajutorul unghiurilor de torsiune moleculare este cunoscut sub denumirea de conformație.
Etanul este cel mai simplu compus din seria alcanilor care prezintă izomerie de conformație, din moment ce în molecula sa se află doar o singură legătură carbon-carbon. Dacă, ipotetic, s-ar putea privi înspre axa legăturii C-C, s-ar putea observa ceea ce este descris de către o proiecție Newman. Între atomii de hidrogen legați de atomii de carbon (apropiat și depărtat) există un unghi de 120°, ceea ce se poate observa și dacă se proiectează molecula pe un plan. Totuși, unghiurile de torsiune dintre orice atom de hidrogen legat de un atom de carbon apropiat și un atom de hidrogen legat de un atom de carbon îndepărtat poate varia între 0° și 360°. Aceasta este o consecință a faptului că legătura simplă carbon-carbon prezintă o rotație liberă. În ciuda acestei rotații libere aparente, în realitate există doar două conformații importante: eclipsată și intercalată. Aceste conformații prezintă energii diferite, cea mai mică fiind pentru cea intercalată, de 12,6 kJ/mol, ceea ce indică faptul că aceasta este mai stabilă decât conformația eclipsată.
Diferența dintre energiile celor două conformații, cunoscute ca energii de torsiune, este mică în comparație cu energia termică a moleculei de etan în condiții normale. Există o rotație continuă în jurul legăturii carbon-carbon, iar timpul necesar (în cazul etanului) pentru trecerea din conformația intercalată în următoarea conformație, echivalentul rotației unei grupe CH3 cu 120° una față de cealaltă, este de ordinul 10−11 secunde.
Radicali
[modificare | modificare sursă]Prin îndepărtarea unuia sau a mai multor atomi de hidrogen din molecula unui alcan se obține un radical de hidrocarbură. Convențional , pentru reprezentarea radicalilor se folosește linia de valența(CH3-) ; aceasta simbolizează electronul impar și nu o pereche de electroni ca în scrierea obișnuită. Denumirea radicalilor hidrocarburilor, obținuți prin îndepărtarea atomilor de hidrogen de la un singur atom de carbon , se face prin înlocuirea sufixului -an cu sufixul -il pentru radicalii monovalenți (obținuți prin îndepărtarea unui singur atom de hidrogen), -iliden pentru cei divalenți: CH4 metan CH3- metil -CH2- metiliden /metilen -CH- metilidin /metin; R-CH- alchiliden
Denumirea radicalilor divalenți , obținuți prin îndepărtarea atomilor de hidrogen de la atomi de carbon diferiți se formează prin adăugarea la numele alcanului a sufixul -idiil. Radicalii monovalenți ai alcanilor se numesc generic radicali alchil.
Metode de obținere
[modificare | modificare sursă]Metode industriale
[modificare | modificare sursă]
Una dintre principalele surse la nivel industrial de alcani sunt gaze naturale și petrolul. Separarea alcanilor are loc în rafinăriile de petrol în urma procesului de rafinare prin distilare fracționată.[9]
- Unul dintre procese este cunoscut sub numele de proces Bergius, care presupune transformarea directă prin lichefiere a cărbunelui într-un amestec de hidrocarburi lichide, numit petrol sintetic.[10]
- Un alt proces foarte folositor este procesul Fischer-Tropsch, folositor la sinteza hidrocarburilor lichide, printre care se numără și alcanii lichizi, având ca precursor monoxid de carbon și hidrogen.[11]
Metode de laborator
[modificare | modificare sursă]De obicei, nu este necesară sinteza de laborator a alcanilor, deoarece pot fi comercializați. De asemenea, datorită reactivității lor scăzute, nu suferă foarte multe reacții de interconversie a grupelor funcționale. Adesea, metodele prin care se obțin alcani ce au loc în laborator sunt de fapt reacții în urma cărora alcanii sunt produși secundari nefolositori. Mai jos se regăsesc câteva dintre cele mai cunoscute și relevante metode de obținere ale alcanilor.[12][13]
- Un exemplu ar fi utilizarea n-butillitiului pe post de bază, când în reacția cu apa se obține acidul conjugat al acestuia, n-butanul, împreună cu hidroxid de litiu:
- C4H9Li + H2O → C4H10 + LiOH
- O altă metodă posibilă este reacția de hidrogenare (reacția Senderen și reacția Sabatier de hidrogenare a dioxidului de carbon[14]) care poate fi aplicată mai multor clase de hidrocarburi nesaturate (precum alchenele și alchinele). Reacțiile de hidrogenare sunt mereu realizate cu ajutorul unui catalizator metalic, de nichel, platină sau paladiu (cu R este notat un rest alchil)
- R-CH=CH2 + H2 → R-CH2-CH3 (hidrogenarea alchenelor)
- R-C≡CH + 2H2 → R-CH2-CH3 (hidrogenarea alchinelor)
- Prepararea alcanilor poate fi realizată direct în urma sintezei Corey-House, ce presupune reacția dintre o halogenură de alchil și un dicuprat de litiu și alchil (resturile alchil pot fi identice sau diferite):[15][16][17]
- Li+[R–Cu–R]– + R'–X → R–R' + "RCu" + Li+X–
- Există trei reacții de reducere ale aldehidelor și cetonelor prin care se pot obține alcani: reducerea Clemmensen (realizată cu zinc metalic și acid clorhidric)[18], reducerea Wolff-Kishner (realizată cu hidrazină în mediu bazic)[19][20] și reducerea Mozingo (realizată cu un ditiol, cu intermediar ditioacetal ciclic care se reduce cu nichel Raney)[21]:
- Reacția Wurtz, prin care două halogenuri de alchil (sau aceeași halogenură, depinzând de natura alcanului care se obține) sunt reacționate în prezența sodiului; alcanul obținut conține legate cele două grupe alchil din reactanți:
- Electroliza Kolbe este o reacție de dimerizare decarboxilativă dintre doi acizi carboxilici (sau doi ioni carboxilat) prin care se obține un alcan format din cele două resturi corespunzătoare acizilor:
- Reacția de dezoxigenare Barton-McCombie este o reacție de substituție radicalică care ajută la transformarea unui alcool în alcanul corespunzător:[22][23]
Proprietăți fizice
[modificare | modificare sursă]Toți alcanii sunt compuși incolori și inodori. Cei cu masă moleculară mică sunt gazoși (metanul, etanul, propanul și butanul), cei cu masă intermediară sunt lichizi (începând cu pentanul), iar cei superiori sunt solizi (parafine).[24][25]
| Alcan | Formulă | Punct de fierbere [°C] | Punct de topire [°C] | Densitate [g/cm3] (la 20 °C) |
| Metan | CH4 | -162 | −182 | 0,000656 (gaz) |
| Etan | C2H6 | −89 | −183 | 0,00126 (gaz) |
| Propan | C3H8 | −42 | −188 | 0,00201 (gaz) |
| Butan | C4H10 | 0 | −138 | 0,00248 (gaz) |
| Pentan | C5H12 | 36 | −130 | 0,626 (lichid) |
| Hexan | C6H14 | 69 | −95 | 0,659 (lichid) |
| Heptan | C7H16 | 98 | −91 | 0,684 (lichid) |
| Octan | C8H18 | 126 | −57 | 0,703 (lichid) |
| Nonan | C9H20 | 151 | −54 | 0,718 (lichid) |
| Decan | C10H22 | 174 | −30 | 0,730 (lichid) |
| Undecan | C11H24 | 196 | −26 | 0,740 (lichid) |
| Dodecan | C12H26 | 216 | −10 | 0,749 (lichid) |
| Pentadecan | C15H32 | 270 | 9.95 | 0,769 (lichid) |
| Hexadecan | C16H34 | 287 | 18 | 0,773 (lichid) |
| Heptadecan | C17H36 | 303 | 21.97 | 0,777 (lichid) |
| Icosan | C20H42 | 343 | 37 | solid |
| Triacontan | C30H62 | 450 | 66 | solid |
| Tetracontan | C40H82 | 525 | 82 | solid |
| Pentacontan | C50H102 | 575 | 91 | solid |
| Hexacontan | C60H122 | 625 | 100 | solid |
Punct de fierbere
[modificare | modificare sursă]
Moleculele alcanilor sunt implicate în forțe intermoleculare van der Waals. Cu cât crește catena, cu atât interacțiile de acest tip sunt mai puternice, iar astfel cresc și punctele de fierbere ale alcanilor.[9]
Sunt două proprietăți care determină tăria cu care se manifestă interacțiile van der Waals:
- numărul electronilor din jurul moleculei, care crește odată cu masa moleculară a alcanului
- suprafața totală a moleculei
În condiții standard de temperatură și presiune, termenii de la CH4 la C4H10 sunt compuși gazoși, de la C5H12 la C17H36 sunt compuși lichizi, iar începând cu C18H38 sunt compuși solizi. Considerând că punctul de fierbere al alcanilor este în principal determinat de masa moleculară, nu este de mirare faptul că punctul de fierbere are o dependență aproximativ liniară de masa moleculară. Conform determinărilor empirice, se poate spune că temperatura de fierbere a unui alcan este cu aproximativ 20–30 °C mai ridicată decât pentru termenul inferior.[9]
Un alcan cu catenă liniară va avea un punct de fierbere mai ridicat decât cea a alcanului ramificat cu același număr de atomi de carbon. Acest fapt se datorează suprafeței mai mari de contact dintre molecule în primul caz, ceea ce duce la posibilitatea de a forma mai multe forțe van der Waals între moleculele adiacente.
Punct de topire
[modificare | modificare sursă]Punctele de topire ale alcanilor cresc într-un mod similar cu punctele de fierbere, iar motivele sunt aceleași cu cele prezentate mai sus. Cu alte cuvinte, cu cât este mai mare catena hidrocarbonată, cu atât va fi mai mare punctul de topire al compusului respectiv. Totuși, există o diferență importantă între punctele de fierbere și de topire. Solidele au o structură mai fixă și mai rigidă decât lichidele. Este necesară o anumită energie pentru schimbarea acestei structuri rigide. Astfel, cu cât sunt mai complexe structural, cu atât moleculele vor necesita o energie mai mare pentru a trece în fază lichidă. În cazul alcanilor, acest fapt se poate observa în graficul de mai sus (punctele de topire sunt reprezentat cu linia albastră). Alcanii care conțin un număr impar de atomi de carbon prezintă o tendință generală de a avea puncte de topire mai mici decât alcanii care conțin un număr par de atomi de carbon. Acest fenomen se datorează faptului că alcanii cu număr par de atomi de carbon au un aranjament favorabil în fază solidă, alcătuind structuri bine organizate, a căror distrugere este posibilă doar cu o cantitate mai mare de energie. În mod analog, alcanii care conțin un număr impar de atomi de carbon au un aranjament mai puțin favorabil, având astfel o organizare mai slabă și deci energia necesară schimbării de fază va fi mai scăzută.[26]
Punctele de topire ale alcanilor ramificați pot fi ori mai mari, ori mai mici decât cele ale normal-alcanilor corespunzători, dar asta depinde strict de abilitatea alcanului respectiv de a se aranja structural în fază solidă. Această teorie este adevărată în particular pentru izoalcani, care au de obicei puncte de topire mai mari decât cele ale analogilor structurali liniari.
Conductibilitate și solubilitate
[modificare | modificare sursă]Geometrie moleculară
[modificare | modificare sursă]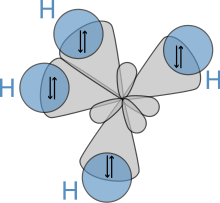
Structura moleculară a alcanilor afectează în mod direct proprietățile fizice și chimice ale acestora. În molecula alcanilor, atomul de carbon este mereu hibridizat sp3, ceea ce presupune faptul că electronii de valență ai carbonului se află în orbitali atomici echivalenți, derivați prin combinarea unui orbital 2s și a trei orbitali 2p. Acești orbitali, care sunt echivalenți din punct de vedere energetic, sunt aranjați spațiali în forma unui tetraedru, iar de aceea se spune că alcanii au formă tetraedrică. La alcanii cu catenă mai mare, molecula capătă o formă de zigzag din cauza acestei geometrii moleculare.[27]
În molecula unui alcan se regăsesc doar legături simple carbon-hidrogen și carbon-carbon. Primul tip de legătură rezultă prin întrepătrunderea orbitalilor hibrizi sp3 ai carbonului cu orbitalul 1s al hidrogenului, iar cel de-al doilea tip prin întrepătrunderea a doi orbitali hibrizi sp3 aparținând a doi atomi de carbon diferiți. Lungimile legăturilor sunt de 1,09 × 10−10 m pentru legăturile C–H și 1,54 × 10−10 m pentru legăturile C–C-C.

Aranjamentul spațial al legăturilor este similar cu cel al unui tetraedru, cu cei patru orbitali sp3 aranjați în vârfuri. Unghiurile dintre legăturile realizate cu atomii de hidrogen au valoarea cos−1(−13) ≈ 109.47°
Proprietăți chimice
[modificare | modificare sursă]Alcanii, după cum sugerează și numele de parafine (care înseamnă fără afinitate), sunt foarte puțin reactivi, iar reactivitatea acestora se rezumă la interacții chimice slabe doar cu compușii ionici și polari. Valorile constantelor de aciditate (pKa) pentru toți alcanii sunt mai mari de 60, din moment ce aceștia sunt practic inerți față de acizi sau baze). Un bun exemplu al lipsei de reactivitate a alcanilor este faptul că în petrol acești compuși au rămas nealterați timp de câteva milioane de ani.
Totuși, reacțiile de oxido-reducere ale alcanilor, în particular cele cu oxigen și halogeni, sunt realizabile, din moment ce atomii de carbon din catena hidrocarbonată sunt stare de oxidare mică (adică în formă redusă). În cazul metanului, atomul de carbon are cea mai mică stare de oxidare, cu valoarea −4.[28] Reacțiile de oxidare cu oxigen din aer pot conduce la formarea produșilor diverși, și variază în funcție de condițiile de reacție. Dacă avem o cantitate suficientă și stoechiometrică de oxigen, va avea loc o reacție simplă de combustie sau de ardere, obținându-se dioxid de carbon și apă. Reacții de halogenare radicalică au loc în prezența halogenilor, iar ca produși se obțin compuși halogenați sau halo(geno)alcani. Mai mult, s-a demonstrat că alcanii pot să interacționeze și să se lege cu anumiți complecși ai metalelor tranziționale în procesele de activare ale legăturilor C-H.
Speciile chimice care joacă un rol important în exemplificarea chimiei alcanilor sunt radicalii liberi și moleculele cu electroni nepereche, fiind implicate în reacțiile de cracare și de reformare catalitică de conversie, adică în transformarea alcanilor superiori în alcani inferiori și a alcanilor liniari în alcani ramificați.
Reacția de oxidare
[modificare | modificare sursă]Toți alcanii reacționează cu oxigenul, dând reacții de combustie sau de ardere, deși reacția este dificilă odată cu creșterea numărului de atomi de carbon din moleculă. Ecuația generală a unei reacții de ardere în cazul alcanilor este:
- CnH2n+2 + (32n + 12) O2 → (n + 1) H2O + n CO2
- sau CnH2n+2 + (3n + 12) O2 → (n + 1) H2O + n CO2
În absența unei cantități stoechiometrice de oxigen, are loc formarea de monoxid de carbon sau chiar de funingine (negru de fum):
Reacțiile pot fi exemplificate cel mai ușor pentru metan:[28]
- 2 CH4 + 3 O2 → 2 CO + 4 H2O
- CH4 + 32 O2 → CO + 2 H2O
Reacția de halogenare
[modificare | modificare sursă]
Alcanii reacționează cu halogenii într-o reacție de substituție denumită halogenare radicalică. Atomii de hidrogen legați de carbon sunt substituiți progresiv de atomi de halogen, iar intermediarii care participă la desfășurarea acestui proces sunt radicalii liberi. Datorită acestui fapt, în urma substituției radicalice se obțin amestecuri de compuși. Reacția este foarte exotermă, și poate duce la explozii dacă nu este controlată.
Aceste reacții au o mare importanță în industrie pentru obținerea unor derivați halogenați ai hidrocarburilor. Etapele care au loc sunt: inițierea, propagarea și terminarea.
Determinările experimentale au arătat faptul că toate reacțiile de halogenare au ca produși de reacție un amestec al tuturor izomerilor posibili, ceea ce indică faptul că toți atomii de hidrogen din molecula alcanilor sunt susceptibili substituției. Totuși, amestecul cu produșii de reacție nu este un amestec statistic: atomii de hidrogen secundari și terțiari favorizează substituția, datorită stabilității mărite a radicalilor secundari și terțiari formați.
Unul dintre cele mai bune exemple care ilustrează reacțiile de monohalogenare și polihalogenare ce au loc în cazul alcanilor este clorurarea fotochimică a metanului, în urma căreia se obține un amestec de derivați clorurați: monoclorometanul sau clorura de metil (CH3Cl), diclorometanul sau clorură de metilen (CH2Cl2), cloroformul, triclorometanul sau clorură de metin (CHCl3) și în final tetraclorura de carbon (CCl4). Formarea acestor produși de reacție depinde de raportul molar al reactanților:[29]
Reacția de cracare
[modificare | modificare sursă]Reacțiile de cracare au ca rezultat ruperea moleculelor în molecule mai mici, ceea ce se poate realiza prin metode termice sau prin metode catalitice.[30] Cracarea termică este un proces ce se desfășoară printr-un mecanism homolitic, cu ajutorul unor intermediari radicalici. Cracarea catalitică presupune prezența unor catalizatori acizi (de obicei în fază solidă, precum silica-alumina și zeoliții), ceea ce induc o rupere heterolitică (asimetrică) a legăturilor și are loc astfel formarea unor ioni cu sarcină opusă (un carbocation și un anion hidrură). Radicalii liberi ai carbonului și cationii sunt specii chimice instabile și vor suferi ușor procese de transpoziție ale catenei, de rupere ale legăturilor C-C în poziție beta și de transfer de hidrogen sau ion hidrură intra- și intermolecular. În ambele tipuri de procese, intermediarii corespunzători de reacție (radicalii și ionii) sunt regenerați permanent, inducând astfel un mecanism de autopropagare. Reacțiile se încheie adesea în urma combinării speciilor radicale sau ionice.
Reacția de izomerizare și de reformare
[modificare | modificare sursă]Reacțiile de izomerizare și de reformare sunt procese catalitice (realizate cu ajutorul unui catalizator de platină sau, la încălzire de până la 100 °C, în prezență de AlCl3), în urma cărora alcanii liniari sunt transformați în analogi structurali.
Prin reacția de izomerizare, alcanii se transformă în izomerii lor ramificați, adică în izoalcani. Cu alte cuvinte, prin acest proces nu au loc modificări ale masei moleculare, și deci nici pierderi de atomi de hidrogen sau de carbon.[31] Reacția de izomerizare se realizează cu catalizator de clorură de aluminiu și la încălzire, ceea ce ajută la ruperea și refacerea legăturilor carbon-carbon. Mai jos este exemplificată reacția de izomerizare a n-pentanului:

În procesele de reformare catalitică, alcanii sunt transformați în cicloalcani sau hidrocarburi aromatice, concomitent cu eliberarea de hidrogen ca produs secundar. Ambele procese descrise au avantajul de a transforma alcanii în produși cu cifră octanică superioară. De obicei, izomerizarea se aplică pe butan, obținându-se mulți alcani ramificați cu cifre octanice mari.[31]
Alte reacții
[modificare | modificare sursă]Alcanii suferă multe alte reacții de substituție, dar care merg mai greu și de obicei prin mecanism radicalic. Exemple sunt: nitrarea, sulfonarea și clorosulfonarea.
Nitrarea alcanilor se realizează cu acid azotic în fază gazoasă, la 400-450 °C, după mecanism radicalic. În urma nitrării, depinzând de alcanii folosiți, se obțin amestecuri de nitroderivați. De exemplu, prin nitrarea propanului rezultă 1-nitropropan, 2-nitropropan, nitroetan și nitrometan în procente diferite.
Răspândire naturală
[modificare | modificare sursă]În univers
[modificare | modificare sursă]

Alcanii alcătuiesc o mică parte din atmosfera planetelor exterioare gazoase Jupiter (0,1% metan, 2 ppm etan), Saturn (0,2% metan, 5 ppm etan), Uranus (1,99% metan, 2.5 ppm etan) și Neptun (1,5% metan, 1.5 ppm etan). Titan (1,6% metan), unul dintre sateliții planetei Saturn, a fost examinată de către sonda Huygens, iar în urma determinărilor s-a ajuns la concluzia că există o ploaie periodică de metan lichid pe suprafața satelitului.[32] De asemenea, pe Titan, misiunea Cassini a imortalizat lacuri de metan/etan sezoniere în apropierea regiunilor polare ale satelitului. Metanul și respectiv etanul au fost detectate în coada cometei Hyakutake. Analiza chimică a indicat faptul că acești compuși aveau o distribuție aproximativ egală, astfel se crede că partea înghețată a cometei s-a format în spațiul interstelar, departe de Soare, deoarece în caz contrat acești compuși s-ar fi evaporat cu ușurință.[33] Alcanii au fost detectați și în unii meteoriți.
Pe Pământ
[modificare | modificare sursă]Cantitatea foarte mică de metan gazos (aproximativ 0,0002% sau 1745 ppb[34]) din atmosfera terestră este în mare majoritate produsă de către microorganismele metanogene, prin procesul de metanogeneză. Un exemplu de astfel de organisme sunt speciile din domeniul Archaea (arhebacteriile).[35]
Cele mai importante surse comerciale de alcani sunt gazele naturale și petrolul.[9] Gazele naturale conțin în majoritate metan și etan, regăsindu-se și cantități mai reduse de propan și butan, iar petrolul este un amestec de alcani lichizi și alte hidrocarburi. Aceste hidrocarburi au fost obținute când speciile acvatice de animale și de plante (zooplancton și fitoplancton) au murit și s-au scufundat în partea inferioară a mărilor. Prin acoperirea acestora cu sedimente și din cauza mediului lipsit de oxigen, de-a lungul a milioane de ani și la o temperatură și o presiune ridicată, a avut loc compactarea acestora până în forma actuală. Gazele naturale au rezultat, printr-un astfel de proces chimic:
- C6H12O6 → 3 CH4 + 3 CO2
Metanul este de asemenea prezent biogaz, un amestec de gaze produs de către animale și de materia în curs de descompunere, iar acesta reprezintă o sursă posibilă de energie regenerabilă.
Alcanii au o solubilitate foarte mică în apă, așadar se poate considera că prezența acestora în oceane este neglijabilă. Totuși, la temperaturi și presiuni ridicate (precum este cazul fundului oceanic), metanul poate co-cristaliza împreună cu apa, formând un solid de tip clatrat (hidrat de metan).[36] Deși acest fenomen nu poate fi exploatat la nivel comercial cu tehnologia din prezent, cantitatea de energie ce poate fi eliberată din tot metanul clatrat existent ar fi mai mare decât cantitatea de energie care poate fi eliberată de către toate depozitele existente de gaze naturale și de petrol. Astfel, se poate spune că metanul clatrat ar putea fi în viitor o sursă viabilă de combustibil. Câteva metode de extracție au început să fie dezvoltate de curând.[37]
În organismele vii
[modificare | modificare sursă]- Bacterii și arhebacterii

Anumite tipuri de bacterii sunt captabile să metabolizeze alcanii: acestea preferă catenele cu număr par de atomi de carbon, fiind mai ușor de degradat decât cele cu număr impar de atomi de carbon.[38]
Pe de altă parte, anumite specii de arhebacterii, cele metanogene, produc cantități mari de metan ca urmare a metabolismului dioxidului de carbon sau a altor compuși organici în stare oxidată. Energia este eliberată prin oxidarea hidrogenului:
- CO2 + 4 H2 → CH4 + 2 H2O
- Fungi și plante
Alcanii joacă un rol, chiar dacă minor, și în biologia fungilor și a speciilor vegetale. Unele specii de drojdii, precum Candida tropicale, Pichia sp., Rhodotorula sp., pot utiliza alcanii ca și sursă de carbon sau de energie. Ciuperca Amorphotheca resinae preferă alcanii cu catenă lungă, ceea ce poate cauza probleme serioase, datorită degradării combustibilului folosit în aviație în zonele tropicale.[39]
- Animale
Unii alcani se regăsesc în produse de origine animală, deși în compoziția acestora se întâlnesc în general mai multe hidrocarburi nesaturate. Un exemplu este uleiul din ficat de rechin, care conține aproximativ 14% pristan (2,6,10,14-tetrametilpentadecan, C19H40). Alcanii sunt importanță ca feromoni, mesageri chimici de care depind insectele pentru comunicare. În unele specii, cum este cazul Xylotrechus colonus, pentacosanul (C25H52), 3-metilpentaicosanul (C26H54) și 9-metilpentaicosanul (C26H54) sunt transferate prin contact direct. La musca țețe, Glossina morsitans morsitans, feromonul conține patru alcani: 2-metilheptadecan (C18H38), 17,21-dimetilheptatriacontan (C39H80), 15,19-dimetilheptatriacontan (C39H80) și 15,19,23-trimetilheptatriacontan (C40H82).
Importanță ecologică
[modificare | modificare sursă]Aplicații
[modificare | modificare sursă]Butanul este folosit ca si combustibil
Impact biologic
[modificare | modificare sursă]Pericol
[modificare | modificare sursă]Metanul este un gaz inflamabil și exploziv. De asemenea, inhalarea sa este periculoasă. Deoarece este un gaz incolor și inodor, trebuie luate măsuri speciale de protecție.[40] Etanul este la rândul său extrem de inflamabil, periculos prin inhalare și exploziv.[41] Ambele gaze pot cauza sufocare.[40][41] În mod analog, și propanul este inflamabil și exploziv,[42] și poate induce somnolență sau poate cauza pierderea conștienței prin inhalare.[42] Butanul prezintă aceleași pericole ca și propanul.[43]
Referințe
[modificare | modificare sursă]- ^ „IUPAC Gold Book - alkanes”. IUPAC. . Accesat în .
- ^ a b „Alkanes - Chemistry LibreTexts”, Chemistry Libretexts, accesat în
- ^ Arora, A. (). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Limited. ISBN 9788183561426.
- ^ IUPAC, Commission on Nomenclature of Organic Chemistry (). „R-2.2.1: Hydrocarbons”. A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific. ISBN 0-632-03488-2. Accesat în .
- ^ Alkane Nomenclature Arhivat în , la Wayback Machine.
- ^ William Reusch. „Nomenclature – Alkanes”. Virtual Textbook of Organic Chemistry. Arhivat din original la . Accesat în .
- ^ „Some Simple Organic Compounds - Chemistry LibreTexts”, Chemistry Libretexts, accesat în
- ^ On-Line Encyclopedia of Integer Sequences Șirul A000602 la Enciclopedia electronică a șirurilor de numere întregi (OEIS)
- ^ a b c d e R. T. Morrison; R. N. Boyd (). Organic Chemistry (ed. 6th). New Jersey: Prentice Hall. ISBN 0-13-643669-2.
- ^ Takao Kaneko, Frank Derbyshire, Eiichiro Makino, David Gray, Masaaki Tamura and Kejian Li "Coal Liquefaction" in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, doi:10.1002/14356007.a07_197.pub2
- ^ Arno de Klerk (). „Fischer–Tropsch Process”. Kirk‐Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. doi:10.1002/0471238961.fiscdekl.a01.
- ^ „General Methods of Preparation of Alkanes”, Askiitians.com, accesat în
- ^ a b „Alkanes, General methods of preparation of alkanes”, Staff.um.edu.mt, arhivat din original la , accesat în
- ^ Stangeland, Kristian; Kalai Dori; Hailong Li; Zhixin Yu (mai 2017). „CO2 Methanation: The Effect of Catalysts and Reaction Conditions”. Energy Procedia. 105: 2022–2027. doi:10.1016/j.egypro.2017.03.577.
- ^ Posner, G. H. (). „Substitution Reactions using Organo Copper Reagents”. Organic Reactions. 22. p. 253. doi:10.1002/0471264180.or022.02.
- ^ Corey, Elias J.; Posner, Gary H. (). „Selective formation of carbon-carbon bonds between unlike groups using organocopper reagents”. Journal of the American Chemical Society. 89 (15): 3911–3912. doi:10.1021/ja00991a049.
- ^ House, Herbert O.; Respess, William L.; Whitesides, George M. (). „The Chemistry of Carbanions. XII. The Role of Copper in the Conjugate Addition of Organometallic Reagents”. The Journal of Organic Chemistry. 31 (10): 3128–3141. doi:10.1021/jo01348a012.
- ^ Clemmensen, E. (). „Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure”. Chemische Berichte. 46: 1837–1843. doi:10.1002/cber.19130460292.
- ^ Kishner, N (). „Wolff–Kishner reduction; Huang–Minlon modification”. J. Russ. Phys. Chem. Soc. 43: 582–595.
- ^ Wolff, L. (). „Chemischen Institut der Universität Jena: Methode zum Ersatz des Sauerstoffatoms der Ketone und Aldehyde durch Wasserstoff. [Erste Abhandlung.]”. Justus Liebig's Annalen der Chemie. 394: 86–108. doi:10.1002/jlac.19123940107.
- ^ Francis A. Carey; Richard J. Sundberg (). Advanced Organic Chemistry: Reactions and synthesis. Springer. pp. 452–454. ISBN 9780387683508.
- ^ Barton, D. H. R.; McCombie, S. W. (). „A new method for the deoxygenation of secondary alcohols”. J. Chem. Soc., Perkin Trans. 1 (16): 1574–1585. doi:10.1039/P19750001574.
- ^ Crich, David; Quintero, Leticia (). „Radical chemistry associated with the thiocarbonyl group”. Chem. Rev. 89 (7): 1413–1432. doi:10.1021/cr00097a001.
- ^ „Archived copy” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ „13. Hydrocarbons | Textbooks”. textbook.s-anand.net. Arhivat din original la . Accesat în .
- ^ Boese R, Weiss HC, Blaser D (). „The melting point alternation in the short-chain n-alkanes: Single-crystal X-ray analyses of propane at 30 K and of n-butane to n-nonane at 90 K”. Angew Chem Int Ed. 38: 988–992. doi:10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.3.CO;2-S.
- ^ „Branched-Chain Alkanes”, 2012books.lardbucket.org, accesat în
- ^ a b „How to Solve the Oxidation State of CH4”, Sciencing, accesat în
- ^ March, Jerry (). Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. pp. 533–534.
- ^ „Procesul de cracare”, Scribd, accesat în
- ^ a b Asinger, Friedrich (). Paraffins; Chemistry and Technology. Oxford: Pergamon Press.
- ^ Emily Lakdawalla. „Titan: Arizona in an Icebox?”. Arhivat din original la . Accesat în .
- ^ Mumma, M.J.; Disanti, M.A.; dello Russo, N.; Fomenkova, M.; Magee-Sauer, K.; Kaminski, C.D.; D.X., Xie (). „Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin”. Science. 272 (5266): 1310–4. Bibcode:1996Sci...272.1310M. doi:10.1126/science.272.5266.1310. PMID 8650540.
- ^ ppb = părți pe miliard
- ^ Janssen, P. H.; Kirs, M. (). „Structure of the Archaeal Community of the Rumen”. Appl Environ Microbiol. 74 (12): 3619–3625. doi:10.1128/AEM.02812-07. PMC 2446570
 . PMID 18424540.
. PMID 18424540.
- ^ „The Risky Business of Mining Methane Hydrate”, Howstuffworks, accesat în
- ^ Amit Arora; Swaranjit Singh; Chandrajit Balomajumder, „Techniques for Exploitation of Gas Hydrate (Clathrates) an Untapped Resource of Methane Gas”, Omics International, accesat în
- ^ „Metabolism of Alkanes and Fatty Acids — eQuilibrator 0.2 beta documentation”. equilibrator.weizmann.ac.il (în engleză). Accesat în .
- ^ Hendey, N. I. (). „Some observations on Cladosporium resinae as a fuel contaminant and its possible role in the corrosion of aluminium alloy fuel tanks”. Transactions of the British Mycological Society. 47 (7): 467–475. doi:10.1016/s0007-1536(64)80024-3.
- ^ a b „CDC - METHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov (în engleză). Accesat în .
- ^ a b „CDC - ETHANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov (în engleză). Accesat în .
- ^ a b „CDC - PROPANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov (în engleză). Accesat în .
- ^ „CDC - BUTANE - International Chemical Safety Cards - NIOSH”. www.cdc.gov (în engleză). Accesat în .
Bibliografie
[modificare | modificare sursă]- C.D. Nenițescu Chimie organică, București: Editura Didactică și Pedagogică
- Mircea Iovu, Chimie organică, ed. a 2-a, București: Editura Didactică și Pedagogică, 1982 pag. 64-75
Vezi și
[modificare | modificare sursă]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||









