Etan
| Etan | |
 Formula structurală | |
 | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 74-84-0 |
| ChEMBL | CHEMBL135626 |
| PubChem CID | 6324 |
| Informații generale | |
| Formulă chimică | C2H6 |
| Aspect | gaz incolor |
| Starea de agregare | gazoasă |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Etanul este un compus organic din categoria alcanilor, o hidrocarbură saturată aciclică, cu o catenă formată din doi atomi de carbon legați printr-o legătură simplă. Formula chimică este C2H6 iar formula de structură este CH3-CH3.
În condiții normale de temperatură și presiune, etanul este un compus gazos, incolor și inodor. Ca majoritatea hidrocarburilor, este obținut pe scară industrială din gaze naturale și ca produs secundar al rafinării petrolului.[2] Este unul dintre principalii compuși utilizați pentru obținerea etilenei. Restul organic corespunzător etanului este grupa etil.
Obținere
[modificare | modificare sursă]Etanul este obținut în mare parte în urma purificării gazelor naturale și ca produs secundar al rafinării petrolului.[2] O cale de sinteză în laborator este reacția de electroliză Kolbe, o metodă prin care o soluție apoasă de acetat este supusă electrolizei.[3] La anod, acetatul este oxidat la dioxid de carbon și radicali metil, iar aceștia, fiind extrem de reactivi, se leagă formând molecula de etan:
Proprietăți fizice
[modificare | modificare sursă]
Etanul este, în condiții standard, un gaz incolor și inodor. Are un punct de fierbere de -88,5 °C și un punct de topire de -182,8 °C. Etanul în fază solidă prezintă câteva modele structurale.[4] Prin răcire în condiții normale, etanul prezintă cristale cubice, plastice, în care atomii de hidrogen nu sunt ficși, iar molecula se poate roti în jurul axului principal. Prin răcirea sub −183,2 °C, cristalele devin monoclinice (grup spațial P 21/n).[5]
Proprietăți chimice
[modificare | modificare sursă]Conformație
[modificare | modificare sursă]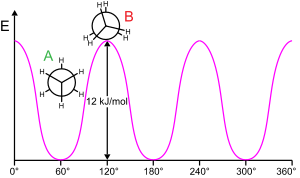
Etanul este cea mai simplă moleculă care prezintă izomerie conformațională.
Reacții de substituție radicalică
[modificare | modificare sursă]Etanul, în mod caracteristic alcanilor, dă unele reacții de substituție radicalică a atomilor de hidrogen. Reacțiile sunt cel mai adesea de halogenare (clorurare, bromurare) și decurg cu formarea unor amestecuri de halogeno-derivați (cloroetan, dicloroetan, etc.):
Reacția de dehidrogenare
[modificare | modificare sursă]Etanul suferă o reacție de dehidrogenare termică la etenă:
Pentru ca reacția să aibă loc, este necesară o temperatură foarte ridicată (> 700 °C).
Reacția de oxidare
[modificare | modificare sursă]- Combustia
Prin combustia completă a etanului se obțin 1559,7 kJ/mol sau 51,9 kJ/g în termeni de energie, dioxid de carbon și apă, conform ecuației reacției chimice:[7]
Pentru ca reacția să fie completă, sunt necesare condiții ideale de reacție (o cantitate suficientă de oxigen).
- Alte oxidări
Note
[modificare | modificare sursă]- ^ „Etan”, ETHANE (în engleză), PubChem, accesat în
- ^ a b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke (). Ullmann's Encyclopedia of Industrial Chemistry: Hydrocarbons. Wiley-VCH Verlag GmbH & Co.
- ^ Kolbe, Hermann (). „Untersuchungen über die Elektrolyse organischer Verbindungen” [Investigations of the electrolysis of organic compounds]. Annalen der Chemie und Pharmacie. 69 (3): 257–372. doi:10.1002/jlac.18490690302.
- ^ Van Nes, G.J.H.; Vos, A. (). „Single-crystal structures and electron density distributions of ethane, ethylene and acetylene. I. Single-crystal X-ray structure determinations of two modifications of ethane” (PDF). Acta Crystallographica Section B. 34 (6): 1947. doi:10.1107/S0567740878007037.
- ^ „Ethane as a solid”. Paarpraxis-rheinmain.de. Arhivat din original la . Accesat în .
- ^ J, McMurry (). Organic chemistry (ed. 8). Belmont, CA: Brooks. p. 95. ISBN 9780840054449.
- ^ Dr. Colin France. (2014). Products from Oil - The Combustion of Hydrocarbons Accesat pe 15 august 2019
Vezi și
[modificare | modificare sursă]Legături externe
[modificare | modificare sursă]
| ||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




