Amidă
Amidele sunt derivați funcționali ai acizilor carboxilici în care grupa -OH din carboxilul acidului este înlocuită de grupa amino (-NH2).[1] Toate amidele refac acidul carboxilic corespunzător prin reacții de hidroliză.
Formula generală a amidelor este:
Nomenclatură
[modificare | modificare sursă]Amidele se denumesc folosind cuvântul „amidă“, urmat de numele acidului organic din care provine sau radicalul acidului urmat de -amidă pe post de sufix.
Clasificare
[modificare | modificare sursă]După natura radicalului
[modificare | modificare sursă]Alifatici
[modificare | modificare sursă], amida acidului formic (formamidă);
, amida acidului acetic (acetamidă);
, amida acidului propionic (propionamidă).
Aromatici
[modificare | modificare sursă], amida acidului benzoic (benzamidă), unde acolada reprezintă un nucleu benzenic.
După numărul grupelor funcționale
[modificare | modificare sursă]Monoamide
[modificare | modificare sursă]Cele prezentate anterior sunt toate monoamide.
Poliamide
[modificare | modificare sursă], oxalamida;
, tereftalamida, unde acolada reprezintă un nucleu benzenic.
Metode de preparare
[modificare | modificare sursă]Reacția acizilor organici cu amoniac
[modificare | modificare sursă], cea de-a doua reacție având loc la căldură
Reacția clorurilor acide cu amoniac
[modificare | modificare sursă]
Reacția anhidridelor acide cu amoniac
[modificare | modificare sursă]
Reacția esterilor cu amoniac
[modificare | modificare sursă]
Hidroliza parțială a nitrililor
[modificare | modificare sursă]
Proprietăți fizice
[modificare | modificare sursă]Toate amidele sunt substanțe solide și cristalizate, excepție făcând doar formamida. Au puncte de topire ridicate. Amidele inferioare sunt solubile în H2O, cele superioare în solvenți organici.
Proprietăți chimice
[modificare | modificare sursă]Au un caracter slab acid, hidrogenul amidic poate fi substituit cu metale alcaline.
Reacția de hidroliză
[modificare | modificare sursă]Fiind derivați funcționali ai acizilor organici, cea mai importantă proprietate chimică este hidroliza.
Reacția de deshidratare
[modificare | modificare sursă]
Reacția de reducere (adiție de H2)
[modificare | modificare sursă]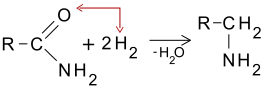
Reacția de oxidare degradativă
[modificare | modificare sursă]Această reacție are loc având hipobromit de sodiu ca un reactant.
Reprezentanți
[modificare | modificare sursă]Cea mai importantă amidă[judecată de valoare] este ureea (diamida acidului carbonic)[necesită citare].
Note
[modificare | modificare sursă]- ^ Costin D. Nenițescu (1974): Chimie Organică, vol. I, ediția a VII-a, Editura Didactică și Pedagogică, pag. 787















