Chimie
| Chimie |

|
| Ramuri ale chimiei |
| Chimie anorganică |
| Lege chimică |
| Legea lui Avogadro |
| Legea Boyle-Mariotte |
| Chimie organică |
| Istoria chimiei |
| Cronologia chimiei |
| Alchimie |
| Chimie modernă |
| Chimiști |
Chimia (denumirea provine din cuvântul egiptean kēme pronunțat [k'em], care înseamnă „pământ”[1]) reprezintă una dintre ramurile științelor naturale al cărei obiect de studiu îl constituie compoziția, structura, proprietățile și schimbarea materiei[2][3]; chimia mai este numită și „știința de mijloc” sau „știința centrală”, întrucât conține elemente combinate din cadrul celorlalte științe ale naturii precum astronomia, fizica, biologia și geologia.[4][5] Ca obiect de studiu, chimia a apărut acum câteva milenii în anumite părți ale lumii, mai exact în Orientul Mijlociu sub forma alchimiei[6][7][8], iar aceasta din urmă a permis elaborarea chimiei moderne ca urmare a revoluției chimice (1773).
Obiectivele acestui domeniu implică în special:
- studierea materiei la nivel atomic,
- proprietățile atomilor,
- modul de formare a legăturilor chimice,
- formarea compușilor chimici,
- modul în care anumite substanțe interacționează la nivel molecular și conferă materiei anumite proprietăți generale,
- precum și modul în care nivelul de interacțiune dintre aceste substanțe poate conduce la crearea altor substanțe prin intermediul unor reacții chimice[9].
În majoritatea studiilor chimiei energia și entropia sunt deosebit de importante.
Disciplinele cuprinse în chimie sunt grupate tradițional după tipul de materie studiată sau tipul de studiu. Acestea includ chimia anorganică (studiul materiei anorganice), chimia organică (studiul materiei organice), biochimia (studiul substanțelor găsite în organismele biologice, vii), chimie fizică (studiile legate de energie despre sistemele chimice la scară macromoleculară, moleculară și sub-moleculară), electrochimie, chimia analitică (analiza mostrelor de material pentru a dobândi o înțelegere a compoziției chimice și structurii acestuia) etc. Multe alte discipline specializate au apărut în anii recenți, de exemplu neurochimia - studiul chimic al sistemului nervos.
Etimologie[modificare | modificare sursă]
Conform Dicționarului Explicativ al Limbii Române, definiția chimiei este următoarea:
„Știință care studiază compoziția, structura și proprietățile substanțelor, transformărilor lor prin regruparea atomilor componenți, precum și combinațiile noi ale substanțelor rezultate în urma acestor transformări.”—Dicționarul Explicativ al Limbii Române[10]
Definiția generală a chimiei (cea acceptată în mod implicit de marele public) s-a schimbat de-a lungul timpului, pe măsură ce noi ramuri au fost incluse în studiul chimiei. Ca și componentă a istoriei științelor, etimologia termenului de "chimie" este considerată a fi una diversă, fără a se fi ajuns la un anumit consens. Prima menționare a termenului de chimie este atribuită lui Dioclețian în anul 296, în momentul când ordona incendierea cărților locuitorilor din Alexandria, privind modul prin care aurul și argintul pot fi replicate[11]; cu toate acestea, este posibil ca această menționare făcută de Dioclețian să fie o simplă legendă[11]
Se consideră că termenul provine din cuvântul arab al-kīmīā (الكيمياء), ce desemna acel set timpuriu de practici care îngloba elementele chimiei, metalurgiei, astrologiei, astronomiei, misticismului și medicinei; obiectul principal al alchimiei era considerat a fi transfigurarea materialelor în aur[12]. Alternativ, al-kīmīā poate deriva din χημεία, insemnand "faurit impreuna"[13]. Termenul arabic este derivat din elenul χημία sau χημεία,[14][15] (chemia), care desemna arta făuririi aurului și argintului[16]. Totodată, termenul poate fi considerat ca provenind de la cuvântul "chumeia", care desemna arta extragerii sucurilor sau infuziilor din plante, precum și prepararea medicamentelor și tincturilor din plante[17].
În limba greacă, termenul este întâlnit în cartea unui scriitor grec, Suidas, din secolul al XI-lea[18]. La origine, termenul grecesc a fost stabilit datorită influențelor Egiptului Antic[14], unde termenul keme însemna "nisipul aluvial al Nilului"[19], "pământ negru"[20]. Limba persană a influențat de asemenea originea termenului, datorită termenului de "kimiya", care însemna "artă, truc"[21]
În anul 330, Zosimos din Panopolis denumea alchimia ca fiind studiul compoziției apelor, mișcărilor, creșterii, încorporării, respingerii, desenului sufletului din trupuri și al împreunării sufletelor cu trupurile.[22][17]
În anul 1661, Robert Boyle elaborează modelul chimiei prin intermediul principiilor sale mereologice, care încorporau filozofia corpusculariană[23]. Principiul generic, acela că chimia este bazată pe considerentul că materia este alcătuită din componente minuscule, apare la începutul lucrării "Chimistul sceptic".[24][23].
Glaser susținea în 1663 despre chimie că este o artă științifică prin care cineva învață cum să dizolve corpuri, cum să reprezinte diversele substanțe din compoziția lor, cum să împreuneze din nou substanțele între ele și cum să le aducă la un grad de perfecțiune mai mare.[25][26]
Stahl definea chimia în 1730 ca fiind arta împărțirii corpurilor mixte, compuse și agregate[27] în elementele principale ale lor[28]
În 1837, Jean Baptiste Dumas definea chimia ca fiind știința care se ocupă cu legile și efectele forțelor moleculare. ()[29] Totodată, este cel care contribuie la dezvoltarea teoriilor chimiei organice, afirmând că între cele 2 ramuri ale chimiei, principiile sunt aceleași.[30]
În anul 1947, chimia este denumită de către Linus Pauling ca fiind știința substanțelor: a structurii, proprietăților și reacțiilor care le schimbă în alte substanțe.[31]
Raymond Chang oferă o definire mai largă a termenului, menționând chimia în 1998 ca fiind studiul materiei și a schimbărilor prin care trece.[32][33]
Istoric[modificare | modificare sursă]
Deși considerată "știință modernă" de aproape 2 secole, chimia a fost prezentă în viața oamenilor ca și aplicabilitate încă din perioada preistorică. Cele mai timpurii utilizări ale chimiei au fost remarcate în cazul picturilor rupestre, care datau de prin perioada 25.000 î.Hr[34].
În China Antică, cunoștințele din domeniul chimiei ar fi fost prezente încă din perioada 9000-7000 î.Hr, demonstrându-se prezența acidului tartaric și anumiți alcani în interiorul unor urne, componente de asemenea prezente în vinul realizat din struguri sau orez[35].
Vechii egipteni au pionierat arta chimiei sintetice acum aproape 4000 de ani.[36] Pe la sfârșitul celui de-al doilea mileniu î.Hr., populațiile antice dețineau deja mijloacele necesare care urmau să formeze bazele mai multor ramuri ale chimiei cum ar fi: extragerea metalelor din minereuri, obținerea vaselor de lut, fermentarea berii și a vinului[34], crearea de pigmenți pentru cosmetice și picturi[34], extragerea substanțelor din plante în scopul utilizării lor ca medicament sau ca parfum, obținerea brânzei, obținerea sticlei și obținerea de aliaje precum bronzul[37].
Nașterea chimiei poate fi atribuită foarte comunului fenomen al arderii, care a dus la apariția metalurgiei[37] - arta și știința care se ocupă cu procesarea minereurilor de fier pentru obținerea metalelor. Goana după aur a dus la descoperirea procesului purificării lui, chiar dacă principiile care stăteau la baza ei nu erau prea bine înțelese - se credea că este o transformare, nu o purificare. Mulți savanți din acea vreme considerau că transformarea metalelor de bază în aur este posibilă, lucru care a dus la formarea alchimiei și căutarea pietrei filozofale, despre care se credea că va aduce astfel de transformări la o singură atingere.[38]
Începând cu anul 600 î.Hr, filozofii greci au conceput noțiuni menite să determine natura materiei[39]. Anaximandru din Milet (610-545 î.Hr) considera că aerul este principalul constituent al materiei[39]; Heraclit din Efes (544-484 î.Hr) considera focul ca și constituent, privind lucrurile din perspectiva unei schimbări continue[39]. Școala eleată, reprezentată de Parmenidae (515-450 î.Hr) considera lumea ca fiind o unitate și schimbarea era privită drept o iluzie[39]. Urmându-l pe Parmenidae, eleatul Empedocle din Agrigentum (495-435 î.Hr) se va opune ideii de definire a aerului ca substanță primordială, propunând existența a patru elemente primare: foc, apă, aer și pământ[39].
Școala atomistă, reprezentată de Leucip și Democrit vor determina faptul că lumea fizică este bazată pe observațiile fizice, ajungând la concluzia că materia poate fi redusă până la unitatea sa constituentă, care este eternă și nu mai poate fi divizată (atomul)[40]. Această idee va fi adoptată ulterior de Epicur (341-270 î.Hr)[40] și de poetul roman Lucretius (95-55 i.Hr), care redactase lucrarea De Rerum Natura (Natura Lucrurilor), în anul 50 î.Hr.[41][42]
Unii îi consideră pe arabi și perși ca fiind cei mai vechi chimiști, cei care au introdus observarea precisă și experimentarea controlată, descoperind astfel multe substanțe chimice. Cei mai influenți chimiști musulmani erau Geber, al-Kindi, al-Razi și al-Bruni[43]. La finalul secolului al VIII-lea d.Hr, alchimistul arab Geber sau Abu Musa Jabir Ibn Hayyan, folosește termenul de Al-kimya în unul din tratatele sale reprezentative[44]. Lucrările lui Geber au ajuns în Europa în secolul al XIV-lea, în Spania prin traducerile unui pseudo-Geber, care și-a semnat cărțile cu numele de „Geber”. Contribuția alchimiștilor și a metalurgiștilor indieni a fost de asemenea remarcată.
Apariția chimiei în Europa a avut loc datorită epidemiilor frecvente de ciumă și molime (cum ar fi moartea neagră) din Evul Mediu Timpuriu, care a dus la o creștere a nevoii de medicamente. Se credea că există un medicament universal numit elixirul vieții care poate vindeca toate bolile, dar care, precum piatra filozofală, nu a fost niciodată găsit.
Deoarece pentru unii practicanți, alchimia era o ocupație intelectuală, în timp, au excelat în acest domeniu. Paracelsus, spre exemplu, respingea teoria celor patru elemente și cu o înțelegere destul de vagă a substanțelor chimice și medicamentelor, a format o formă hibridă de alchimie și știință, numită și chemiatrie sau iatrochimie.[45]
Răspândirea chimiei ca știință a fost influențată de asemenea de apariția tipografiei în 1454, prin aportul lui Johannes Gutenberg. Diverse cărți cu subiecte precum mineralogia, minereuri și prepararea de substanțe au fost adevărate stimulente pentru avansarea acestui domeniu datorită caracterului practic și disponibilității materialelor de studiu[46].
De asemenea, influențe ale filozofilor cum ar fi Sir Francis Bacon sau René Descartes, care voiau o anumită rigoare în matematică și cereau eliminarea dogmelor și subiectivismului din observațiile științifice, au dus la revoluția științifică[47]. În chimie, ea a început cu Robert Boyle (1627-1691), care formulat ecuații precum Legea lui Boyle, cu privire la proprietățile stării gazoase. Mai târziu au urmat legea conservării masei substanțelor în 1783 și dezvoltarea teoriei atomice a lui John Dalton în jurul anului 1800. Legea Conservării Masei a dus la reformularea chimiei bazată pe această lege, dar și teoria combustiei oxigenului, care a fost mult bazată pe cercetările lui Lavoiser. Acestea și alte astfel de schimbări înțelese de mase au fost denumite generic revoluția chimică. Contribuțiile lui Lavoisier au dus la ceea ce acum se numește chimie modernă - chimia studiată în instituțiile de învățământ din toată lumea.
Chimia ca știință[modificare | modificare sursă]
Influențați de noile metode empirice, adoptate de către Sir Francis Bacon și alți chimiști. Un grup de chimiști de la Oxford, Robert Boyle, Robert Hooke și John Mayow au început remodelarea tradițiilor vechi, de ordin alchimic, într-o disciplină științifică. În mod special, Boyle este considerat a fi părintele chimiei datorită celei mai importante lucrări ale sale, Chimistul sceptic, unde diferențierea este făcută între cunoașterea alchimiei și descoperirile științifice ale noii chimii.[48] Acesta a formulat legea lui Boyle, a respins teoria clasică a celor "4 elemente" și a propus o alternativă mecanistă a atomilor și reacțiilor chimice al căror studiu s-ar fi putut face prin experimente riguroase.[49]

Teoria flogistonului (substanța aflată la baza tuturor reacțiilor de combustie) a fost propus de către germanul Georg Ernst Stahl la începutul secolului al XVIII-lea și a fost accentuată de către chimistul francez Antoine Lavoisier, analogul chimic al fizicianului Newton, care a reușit mai mult decât oricine să făurească o nouă știință bazată pe filon teoretic, prin elucidarea principiului conservării masei și dezvoltării unui sistem nou de nomenclatură chimică utilizat până în zilele noastre.[51]
Cu toate acestea, înainte de eforturile lui Lavoisier, numeroase descoperiri importante au fost făcute, în special privind natura aerului, care s-a demonstrat a fi compus din numeroase gaze. Chimistul scoțian Joseph Black (primul chimist experimental) și olandezul J. B. van Helmont descoperiseră dioxidul de carbon, sau ceea ce Black numise 'aer inert' în 1754; Henry Cavendish descoperise hidrogenul și elucidase proprietățile sale, iar Joseph Priestley și, independent, Carl Wilhelm Scheele izolaseră oxigenul pur.

Chimistul englez John Dalton a propus teoria moderna a atomilor, aceea că toate substanțele sunt compuse din 'atomi' indivizibili ai materiei și că fiecare atom are o masă atomică variabilă.
Dezvoltarea în teoria electrochimică a combinațiilor chimice apare la începutul secolului al XIX-lea, ca rezultat al muncii a 2 oameni de știință în particular, J. J. Berzelius și Humphry Davy; aceasta a putut fi descoperită datorită invenției pilei voltaice, de către Alessandro Volta. Davy descoperise 9 elemente chimice noi, incluzând metalele alcaline prin extragerea acestora utilizând curentul electric aplicat pe minereurile acestora.[54]
Britanicul William Prout a propus pentru prima oară ordonarea tuturor elementelor chimice folosind masa lor atomică, datorită faptului că toți atomii aveau același multiplu al masei atomice de hidrogen. J. A. R. Newlands începuse o variantă timpurie a tabelului periodic, care a fost ulterior dezvoltat în tabelul periodic modern[55] în anii 1860 de către Dmitri Mendeleev și independent de alți oameni de știință, precum Julius Lothar Meyer.[56][57] Gazele inerte, ulterior numite "gaze nobile", au fost descoperite de către William Ramsay în colaborare cu Lord Rayleigh la finalul secolului, completând astfel structura de bază a tabelului.
Chimia organică a fost dezvoltată de către Justus von Liebig și alții, ca urmare a sintezei ureei de către Friedrich Wöhler, care dovedise că organismele vii erau reduse, în teorie, în chimie.[58] Alte avansări cruciale ale secolului XIX-lea erau înțelegerea legăturilor valente (Edward Frankland în 1852) și aplicarea termodinamicii în chimie (J. W. Gibbs și Svante Arrhenius în anii 1870).
Principiile chimiei moderne[modificare | modificare sursă]
Structura obiectelor pe care le folosim de zi cu zi și proprietățile materiei cu care interacționăm sunt consecințe ale proprietăților substanțelor chimice și ale interacțiunilor lor. Spre exemplu, oțelul este mai dur decât fierul pentru că atomii din el sunt mai strâns legați, formând o structură cristalină mai rigidă. Lemnul arde sau este supus oxidării rapide pentru că poate reacționa în mod spontan cu oxigenul în cadrul unei reacții chimice deasupra unei anumite temperaturi. Zahărul și sarea se dizolvă în apă deoarece proprietățile lor moleculare/ionice permit dizolvarea în condiții ambientale.

Jos: Rezultatele observate: puține particule au fost reflectate, indicând o încărcătură mică, concentrată.
La începutul secolului al XX-lea, teoriile de bază ale chimiei au fost înțelese datorită unor serii de descoperi privind probarea și dezvăluirea naturii interne ale atomilor. În 1897, J. J. Thomson din Cambridge University descoperise electronul și imediat după aceea, omul de știință Becquerel, precum și cuplul Pierre și Marie Curie investigau fenomenul radioactivității. Într-o serie de experimente, Ernest Rutherford din cadrul Universității din Manchester descoperise structura internă a atomului și existența protonului, a clasificat și explicat tipurile de radioactivitate și a reușit să transmute hidrogenul prin bombardarea azotului cu particule alfa.
Activitatea sa privind structura atomică a fost îmbunătățită de către studenții săi, fizicianul danez Niels Bohr și Henry Moseley. Teoria legăturii chimice și al orbitalilor moleculari a fost dezvoltată de către savanții americani Linus Pauling și Gilbert N. Lewis.
Anul 2011 a fost declarat de către Națiunile Unite ca fiind Anul Internațional al Chimiei.[59] IUPAC, precum și UNESCO, alături de societăți chimice, academii și instituții la nivel global au organizat activități locale și regionale.
Modelul actual al structurii atomice este reprezentat de modelul mecanicii cuantice.[60]Chimia este studiată, la început, la nivel de particule elementare, atomi, molecule,[61] substanțe chimice, metale, cristale și alte stări de agregare ale materiei. Această materie poate fi întâlnită sub formă solidă, lichidă sau gazoasă, în izolare sau în combinații. Interacțiunile chimice, reacțiile și transformările care sunt studiate în chimie sunt de obicei rezultatul interacțiunilor atomice, conducând la rearanjarea legăturilor chimice ce susțin atomii, iar aceste comportamente sunt studiate într-un laborator de chimie.
Laboratorul de chimie folosește, de regulă, diverse obiecte de laborator, fabricate din sticlă. Cu toate acestea, nu toate ustensilele sunt centrate pe sticlă ca și material, iar o mare parte din chimia experimentală (precum și cea aplicată sau industrială) este realizată fără ea.
O reacție chimică este transformarea unor substanțe în una sau mai multe substanțe.[62] La baza unei asemenea transformări chimice se află rearanjarea electronilor în cadrul legăturilor atomice, iar aceasta poate fi evidențiată simbolic prin ecuațiile chimice, care au ca subiect atomii. Numărul atomilor din partea stângă și partea dreaptă a ecuației este egal într-o transformare chimică; în moment când numărul acestora este inegal, transformarea este numită reacție nucleară sau dezintegrare radioactivă. Tipul de reacții chimice suferite de o substanță pot conduce la schimbări energetice, care pot fi limitate de niște reguli denumite legi chimice.
Energia și entropia sunt concepte de natură invariabilă, care sunt importante în aproape toate studiile chimice. Substanțele sunt clasificare în funcție de structură, stare de agregare, precum și după compoziția chimică. Acestea pot fi analizate prin diverse mijloace de analiză chimică (de exemplu, spectroscopia și cromatografia). Oamenii de știință care sunt preocupați de cercetările în domeniul chimiei sunt numiți "chimiști".[63] Majoritatea chimiștilor se specializează în una sau mai multe sub-discipline. Câteva concepte esențiale pentru studiul chimiei sunt prezentate mai jos:[64]
Materie[modificare | modificare sursă]
În chimie, materia (din latinescul materia, însemnând lemn sau orice alt material[65]) este definită ca fiind orice este alcătuit dintr-o masă de repaus și volum (ocupă spațiu), fiind alcătuită din particule aflate constant în mișcare[66]; acestea au masă de repaus de asemenea - cu toate că nu toate particulele îndeplinesc această condiție, precum fotonii. Mișcarea particulelor, precum și puterea de atracție între aceste particule determină starea de agregare a materiei respective[66].
Materia poate fi constituită dintr-o substanță chimică pură sau un amestec de substanțe.[67] Aceasta este definită de materialul conținut, indiferent că este omogen sau neomogen. Un material neomogen reprezintă unitatea structurală care conține componente cu proprietăți diferite, în timp ce materialul omogen conține componente cu proprietăți asemănătoare[68].
Până în secolul prezent, se credea că materia nu putea fi creată sau distrusă, ci doar transformată dintr-o stare în alta. Cu toate acestea, s-a descoperit că materia poate fi transformată în energie radiantă, precum și acțiunea reversă (din energie în materie)[69]. Oamenii de știință utilizau legea conservării materiei și legea conservării energiei în mod independent, însă ulterior cele 2 au fuzionat, conducând la legea conservării masei, constituită concomitent din masa materiei din sistem, precum și masa energiei radiante din sistem[70].
Atomul[modificare | modificare sursă]

Începând cu Democrit, filozofii greci au contribuit la dezvoltarea unei teorii filozofice care încerca prezentarea concepției lor despre natura Universului, alcătuită din particule foarte mici, indivizibile[71]. În acest fel, conceptul de atom este creat (greacă atomos, indivizibil)[72].
Atomul este cea mai mică particulă dintr-o substanță care prin procedee chimice obișnuite nu poate fi divizată în alte particule mai simple, fiind unitatea structurală a chimiei[73]. Este o grupare a materiei care constă într-un miez dens numit nucleu atomic, înconjurat de un spațiu numit nor electronic. Nucleul este alcătuit din particule încărcate pozitiv numite protoni și neutroni (împreună sunt numiți nucleoni), în jurul căruia orbitează particulele încărcate negativ din norul electronic (electronii)[73]. Într-un atom neutru, electronii încărcați negativ echilibrează numărul încărcăturii pozitive ale protonilor. Nucleul este dens, masa acestuia fiind de 1836 de ori mai mare decât a electronului, cu toate că raza atomului este de 10.000 de ori mai mare decât a nucleului său.[74][75]
Atomul este de asemenea cea mai mică entitate care poate fi închipuită, care are proprietatea de a reține proprietățile chimice ale elementului[73], precum electronegativitatea, potențialul de ionizare, stările de oxidare, numărul de coordonare și tipul de legături (metalice, ionice, covalente).
Element chimic[modificare | modificare sursă]
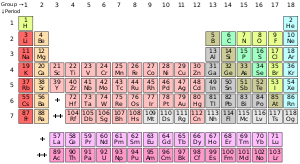
Un element chimic reprezintă substanța pură care este constituită dintr-un singur tip de atom, caracterizat de un anumit număr de protoni din interiorul nucleului atomic (cunoscut ca și număr atomic, notat cu simbolul Z). Masa atomică este indicată drept sumă a numărului de protoni și neutroni din interiorul nucleului. Cu toate că toți nucleii unui atom aparțin aceluiași element ar avea același număr atomic, masa lor atomică nu trebuie să fie neapărat egală; atomii care prezintă diverse mase atomice sunt cunoscuți drept izotopi. De exemplu, toți atomii cu 6 protoni în nucleu sunt atomi ai elementului chimic carbon, dar atomii de carbon pot avea mase atomice 12 și 13.[75]
Modelul standard de prezentare al elementelor chimice este tabelul periodic al elementelor, care ordonează aceste elemente în funcție de numărul lor atomic. Tabelul este constituit din grupe (coloane) și perioade (șiruri). Acest mod de reprezentare tabelară este utilă în stabilirea tendințelor periodice.[76]
Ioni și săruri[modificare | modificare sursă]

Un ion este un tip de un atom sau moleculă care a cedat sau acceptat unul sau mai mulți electroni. Cationii încărcați pozitiv (de exemplu, cationul de sodiu Na+) și anionii încărcați negativi (de exemplu, clorură Cl-) pot forma o structură cristalină de sare neutră (de exemplu, clorură de sodiu NaCl). Exemple de ioni poliatomici care nu se despart în timpul reacțiilor sunt hidroxizii (OH-), fosfații (PO43-) și alții.
Ionii în stare gazoasă sunt adesea cunoscuți sub numele de plasmă.
Compus[modificare | modificare sursă]

Un compus reprezintă substanța chimică pură, formată din mai mult de 1 element. Proprietățile compusului sunt determinate de ușoare similitudini cu cele ale elementului său constituent.[77]
Nomenclatura standard pentru compuși este determinată de către Uniunea Internațională de Chimie Pură și Aplicată (IUPAC). Compușii organici sunt numiți conform sistemului de nomenclatură organică.[78], în timp ce compușii anorganici sunt numiți conform sistemului nomenclaturii anorganice.[79] De asemenea, Chemical Abstracts Service stabilise o metodă de indexare a substanțelor chimice, unde fiecare substanță este identificată folosindu-se un număr numit număr de registru CAS.
Moleculă[modificare | modificare sursă]

O moleculă reprezintă cea mai mică unitate indivizibilă a unei substanțe chimice pure, care posedă un set unic de proprietăți chimice, reprezentând potențialul de a suferi un anumit set de reacții chimice cu alte substanțe. De regulă, moleculele sunt reprezentate de atomii legați prin legături covalente, structura lor fiind neutră din punct de vedere electric, iar toate valențele electronilor sunt aranjate cu alți electroni fie în diverse legături, fie singulari.
Spre deosebire de ioni, moleculele există ca unități neutre din punct de vedere electric. Când această condiție este încălcată, încărcătura electronică a moleculei determină un ion molecular sau ion poliatomic. Cu toate acestea, natura discretă și separată a conceptului molecular presupune de obicei ca ionii moleculari să fie prezenți doar în forme determinate, precum un fascicul direcționat în vid într-un spectrometru de masă. Colecțiile poliatomice încărcate care sunt prezente în solide (de exemplu, ionii sulfat sau azotat) nu sunt considerate drept molecule în chimie.

Gazele inerte sau nobile (heliu, neon, argon, krypton, xenon și radon) sunt compuse din atomi singulari ca unitate de bază, însă celelalte elemente chimice izolate constă fie în molecule, fie rețele de atomi legați oarecum. Moleculele identificabile alcătuiesc substanțe cunoscute, precum apa, aerul, precum și unele substanțe organice precum alcoolul, zahărul, benzina și diverse produse farmaceutice.
Cu toate acestea, nu toate substanțele sau compușii chimici sunt alcătuiți din molecule discrete și, într-adevăr, majoritatea solidelor care compus crusta, mantaua și nucleul Pământului sunt elemente chimice fără grupare moleculară. Aceste tipuri de substanțe, precum compușii ionici și solide în rețea, sunt organizate în așa manieră încât nu este necesară existența unor molecule identificabile. În schimb, aceste substanțe sunt discutate în termeni de unitate celulară ca și cea mai mică structură repetitivă din interiorul substanței. Exemple de asemenea substanțe sunt sărurile minerale (precum sarea de masă), solidele precum carbonul și diamantul, metalele, siliciul și minerale silicate, precum cuarțul și granitul.
Una din principalele caracteristici ale moleculei este geometria sa, numită structură moleculară. În timp ce structura moleculară diatomică, triatomică sau tetraatomică poate fi trivială (lineară, piramidal angulară, etc), structura moleculelor poliatomice, constituite din mai mult de 6 atomi poate fi crucială pentru natura sa chimică.
Substanțe și amestecuri[modificare | modificare sursă]
  | |
  | |
  | |
| Exemple de substante chimice pure. De la stanga la dreaptea: elementele staniu (Sn) si sulf (S), diamant (forma alotropa a carbonului), sucroză (zahăr pur) și clorură de sodiu (sare) și bicarbonat de sodiu (praf de copt), care sunt ambii compuși ionici. |
O substanță chimică reprezintă compoziția materiei care este definită și posedă anumite proprietăți fizico-chimice.[80]
În momentul când mai multe substanțe sunt prezente, rezultatul este numit amestec. Exemple de amestecuri sunt aerul și aliajele.[81]
Proprietăți fizice[modificare | modificare sursă]
Proprietățile fizice ale unei substanțe reprezintă acele calități caracteristice și definitorii ale acesteia;[82] de exemplu, clorura de sodiu este întâlnită sub diverse forme - granulară, sub forma sării de bucătărie sau sub forma cristalizată (între 2-3 mm, până la 5 cm în diametru). Indiferent de forma în care ar fi întâlnită, prezintă aceleași proprietăți caracteristice (aranjarea cristalină, gust etc.)[82]. Totodată, sunt considerate a fi proprietăți fizice acele caracteristici care nu implică schimbarea substanței la nivel chimic[83].
- Clivaj - Clivajul reprezintă tendința întâlnită la minerale sau cristale de a se sparge sau despica, în paralel cu rețeaua structurii lor cristaline. Suprafața clivajului este netedă, în general cu o reflectare bună a razelor luminoase.
- Solubilitate
Solubilitatea indică gradul în care o substanță pură se poate dizolva într-un dizolvant, alcătuind o soluție omogenă unde repartizarea atomilor, moleculelor și ionilor este uniformă. Pentru lichide parțial miscibile reciproc, care formează o soluție eterogenă cu cel puțin 2 faze lichide (lichid multifazic) solubilitatea se denumește miscibilitate. Dizolvantul în modul cel mai frecvent este un lichid, dar sunt și unele excepții când unii dizolvanți sunt:
- solide ca în cazul aliajelor, sticlei, ceramicii, semiconductoare sau
- gaze ce dizolvă solide sau lichide, de obicei la temperaturi și presiuni înalte ca de exemplu silicea în vapori de apă în anumite procese geochimice.
În funcție de cantitatea de substanță dizolvată, soluțiile se clasifică în:
- soluții saturate: care conțin cantitatea maximă de substanță dizolvată la o anumită temperatură.
- soluții nesaturate: în care se mai poate dizolva o cantitate de dizolvat până la saturație.
- Gust
- Densitate
Densitatea (sau mai exact densitatea de masă, numită și masă specifică) este o mărime fizică folosită pentru descrierea materialelor și definită ca masa unității de volum. Astfel, densitatea unui corp este egală cu raportul dintre masa și volumul său. Unitatea de măsură în Sistemul Internațional pentru densitate este kilogramul pe metru cub(kg/m³); alte unități folosite sunt gramul pe centimetru cub (g/cm³), kilogramul pe litru (kg/L) etc. Densitatea se notează de obicei cu litera grecească (ro) sau cu inițiala cuvântului, litera d.
- Conductivitate termică - Conductivitatea termică este mărimea fizică prin care se caracterizează capacitatea unui material de a transmite căldura (prin conducție termică) atunci când este supus unei diferențe de temperatură.
- Conductivitate electrică - Conductivitatea electrică (numită și conductibilitatea electrică specifică) este mărimea fizică prin care se caracterizează capacitatea unui material de a permite transportul sarcinilor electrice atunci când este plasat într-un câmp electric.
- Maleabilitate - Capacitatea unui material de a se deforma sub un efort de compresiune; acest lucru este adesea caracterizat prin capacitatea materialului de a forma o foaie subțire prin ciocănire sau laminare.
- Ductilitate - În știința materialelor, ductilitatea este capacitatea unui material solid de a se deforma sub un efort de tracțiune; acest lucru este adesea caracterizat prin capacitatea materialului de a fi întins într-un fir.
- Duritate - Duritatea este rezistența la penetrare opusă de un corp solid unei acțiuni mecanice penetrante exterioare. Această rezistență se poate manifesta față de acțiuni de șlefuire, zgâriere, tocire prin utilizare repetată. La uneltele ascuțite, este rezistența la tocire a muchiilor tăietoare. În cadrul geologiei, duritatea mineralelor se măsoară după o scară de duritate de la 1 la 10, numită „Scala lui Mohs”.
- Stare de agregare

Proprietăților chimice specifice care permit distingerea diverselor clasificări chimice sunt însoțite și de stări de agregare. În cea mai mare parte, clasificările chimice sunt independente de aceste clasificări de stare; cu toate acestea, unele stări de agregare ale materiei sunt incompatibile cu anumite proprietăți chimice.
O stare de agregare reprezintă un set de stări ale unui sistem fizic macroscopic care au o compoziție chimică și proprietăți fizice relativ uniforme (precum temperatura, structura cristalină, presiunea, etc.).
Proprietățile fizice, cum ar fi densitatea și indicele de refracție, tind să se încadreze în valorile caracteristice ale stării de agregare. Starea materiei este definită de starea de tranziție, care are loc când energia introdusă sau preluată dintr-un sistem este refolosită în reorganizarea structuri sistemului, în loc de a schimba condițiile de stare.
Uneori distincția între faze poate fi continuă în loc de a avea o graniță discretă, în acest caz, chestiunea se consideră a fi într-o situație super critică. Când cele trei stări se îndeplinesc, pe baza condițiilor, este cunoscut ca un triplu punct și deoarece acest lucru este invariant, este un mod convenabil de a defini un set de condiții.
Cel mai cunoscute exemple de stări de agregare sunt solid, lichid și gazos. Multe substanțe prezintă mai multe faze solide. De exemplu, există trei faze solide ale fierului (alfa, gama, și delta), care variază în funcție de temperatură și presiune. O diferență principală printre fazele solide este structura de cristal, sau aranjament, a atomilor. Mai puțin cunoscute sunt stările de agregare precum plasma, condensările Bose-Einstein și condensările fermionice și fazele paramagnetice și feromagnetice ale materialelor magnetice.
Proprietăți chimice[modificare | modificare sursă]
Proprietățile chimice ale unei substanțe reprezintă acele caracteristici specifice participării în reacțiile chimice.[84]
Molul și unitatea de substanță[modificare | modificare sursă]
Molul reprezintă unitatea de măsură care determină cantitatea de substanță (numită cantitate chimică). Molul este definit ca și numărul de atomi determinat în exact 0.012 kilograme (sau 12 grame) de carbon-12, unde atomii de carbon-12 sunt liberi, în repaus.[85] Numărul de particule per mol este cunoscut ca și constanta lui Avogadro, fiind determinată în mod empiric la valoarea aproximativă de 6.022×1023 mol−1.[86] Concentrația molară este cantitatea de substanță per volum a unei soluții și este raportata în moldm−3.[87]
Legătură chimică[modificare | modificare sursă]

În funcție de modul în care atomii își formează configurația completă a ultimului strat, interacțiunile dintre ei (legăturile chimice) sunt diferite. Legăturile chimice cunoscute astăzi se clasifică astfel[88]:
- Legături intramoleculare, care se stabilesc între atomii componenți ai unei combinații chimice. În cadrul acestor tipuri de legături sunt incluse:
- Legătura ionică
- Legătura covalentă
- Legătura coordinativă
- Legătura metalică
- Legături intermoleculare, care se stabilesc între molecule deja formate. Dintre acestea, cele mai importante sunt:
- Legătura de hidrogen
- Legătura van der Waals
Conceptul de legătură chimică se referă la modul în care atomii se unesc pentru a forma molecule, fiind starea de echilibru între particulele încărcate pozitiv din nucleu și particulele negative care oscilează printre acestea[89]. Fiind mai mult decât niște simple stări de atracție și respingere, energiile și modul de distribuire caracterizează disponibilitatea unui electron de a se uni cu un alt atom.

Legăturile chimice pot fi covalente, ionice, de hidrogen sau de forță Van der Waals. Fiecare legătură are un anumit potențial atribuit, care creează interacțiunea chimică ce unește atomii în molecule sau cristale. În cazul multor compuși, teoria legăturii valente, modelul Perechilor de Electroni din Stratul de Valență (în engleză Valence Shell Electron Pair Repulsion model - VSEPR) și conceptul de număr de oxidare sunt folosite pentru explicarea structurii și compoziției moleculare.
Legătura ionică este formată atunci când un metal cedează unul sau mai mulți electroni, devenind un cation încărcat pozitiv, iar electronii sunt captați de către un nemetal, devenind un anion încărcat negativ. Cei doi ioni opuși se atrag, iar legătura ionică este forța electrostatică de atracție. De exemplu, sodiul (Na), un metal, cedează un electron pentru a deveni un cation de Na+, în timp ce clorul (Cl), nemetal, primește acest electron pentru a deveni Cl−. Ionii sunt uniți datorită atracției electrostatice, iar compusul clorură de sodiu (sarea de bucătărie) este formată.
Într-o legătură covalentă, unul sau mai mulți electroni de valență sunt împărțiți de 2 atomi: rezultatul atomic care este încărcat negativ este denumit moleculă. Atomii vor împărți electronii de valență în așa manieră încât configurația unui gaz nobil va fi formată pentru fiecare atom. Atomii care tind să se combine în această manieră (având nevoie de 8 electroni în stratul de valență) urmează regula octetului. Cu toate acestea, unele elemente precum hidrogenul sau litiul au nevoie doar de 2 electroni pentru a atinge configurația stabilă; aceste elemente urmează regula duetului, iar în această manieră vor avea configurația electronică a heliului, care are 2 electroni în stratul exterior.
În mod similar, teoriile fizicii clasice pot fi utilizate pentru a preconiza anumite structuri ionice. În cazul compușilor complecși, teoria legăturii de valență este mai puțin aplicată, fiind utilizate alternative precum teoria orbitalilor moleculari.
Reacție chimică[modificare | modificare sursă]
Atunci când o substanță chimică este transformată ca și rezultat al interacțiunii sale cu o altă substanță, se produce fenomenul numit "reacție chimică". O reacție chimică reprezintă conceptul de reacționare al unei substanțe în contact cu altă substanță, fie sub forma unui amestec sau a unei soluții, expunerea la o anumită formă de energie sau ambele. Transformările care sunt studiate în cadrul chimiei implică studiile interacțiunilor dintre substanțe într-un laborator specializat folosind diverse vase de laborator.[90]

Reacțiile chimice pot conduce la formarea sau disocierea moleculară, adică rearanjarea atomică sau dezintegrarea moleculelor în scopul formării a două sau mai multe molecule mici. Reacțiile redox, disocierea, neutralizarea acid-bază și rearanjarea moleculară sunt unele dintre cele mai comune reacții chimice.
O reacție chimică este transformarea unor substanțe în una sau mai multe alte substanțe. Aceasta poate fi ilustrată în mod simbolic printr-o ecuație chimice. În timp ce într-o reacție chimică non-nucleară numărul și tipul atomilor de pe ambele părți ale ecuației este egal, într-o reacție nucleară această condiție se aplică doar particulelor nucleare (protoni și neutroni).[91] Natura reacțiilor chimice pe care o substanță le poate suferi și descărcările de energie ce pot surveni sunt definite prin anumite legi de bază, numite și legi chimice.
Secvențele care pot fi urmate în momentul reorganizării legăturilor chimice sunt denumite mecanisme de reacție, fiecare având o viteză de reacție diferită. Astfel, în cursul unei reacții se pot avea în vedere mulți intermediari de reacție cu stabilitate variabilă. Sunt propuse mecanisme de reacție pentru a explica cinetica și amestecul relativ de produse al unei reacții. Mulți fizicieni chimiști sunt specializați în explorarea și propunerea mecanismelor diferitelor reacții chimice. Mai multe reguli empirice, cum ar fi regulile Woodward-Hoffmann, sunt adesea utile atunci când se propune un mecanism pentru o reacție chimică.
Conform IUPAC, o reacție chimică este „un proces care are ca rezultat interconversia unor specii chimice.”[92] În consecință, o reacție chimică poate fi o reacție elementară sau o reacție în trepte. Se face o atenționare suplimentară, în sensul că această definiție include cazurile în care interconversia conformerilor este observabilă experimental. Astfel de reacții chimice detectabile implică, în mod normal, seturi de entități moleculare, așa cum indică această definiție, dar este adesea convenabil din punct de vedere conceptual să se utilizeze termenul și pentru schimbările care implică entități moleculare individuale (adică „evenimente chimice microscopice”).
Energie[modificare | modificare sursă]
Energia este considerată a fi un atribut al unei substanțe rezultat din structura atomică, moleculară sau din structura unui agregat. Din moment ce o reacție chimică este urmată de un schimb în cadrul uneia dintre structuri, este în mod invariabil însoțită de un nivel scăzut (reacție exotermă) sau ridicat de energie (reacție endotermă) al acestora. O parte din această energie este transferată între mediu și reactanți sub forma căldurii sau luminii; în acest caz, unii produși de reacție pot avea mai multă sau mai puțină energie decât reactanții.
O reacție este considerată a fi exergonică dacă stadiul ei final este mai scăzut din punct de vedere energetic decât cea inițială; în cazul reacției endergonice, se aplică reversul. O reacție este considerată a fi exotermică dacă se eliberează căldură în mediul înconjurător, iar reacția endotermică este cea care absoarbe căldura din mediu.
Reacțiile chimice sunt condiționate în mod invariabil de energia de activare; viteza de reacție la o anumită temperatură T este corelată cu energia de activare E, conform factorului lui Boltzmann - probabilitatea ca o moleculă să aibă o energie mai mare sau egală cu E la o anumită temperatură T. Dependența exponențială a vitezei de reacție pe bază termică este numită ecuația Arrhenius.
Energia de activare necesară unei reacții chimice poate fi întâlnită sub forma căldurii, luminii, forței de natură electrică sau forță mecanică sub forma ultrasunetelor.[93]
Conceptul înrudit de energie liberă, care încorporează considerații entropice, este un instrument fezabil în prezicerea unei reacții și determinarea unei stări de echilibru al unei reacții chimice în chimia termodinamicii. O reacție este fezabilă doar dacă schimbul total al energiei libere Gibbs este negativ, ; dacă este egal cu zero, reacția chimică atunci se află în stare de echilibru.
Există anumite stări de energie pentru electroni, atomi și molecule, însă acestea sunt limitate; acestea sunt determinate de reguli ale mecanicii cuantice, care necesită cuantificarea energiei unui sistem. Atomii/moleculele aflate într-un stadiu energetic mai înalt sunt considerați a fi excitați. Atomii/moleculele unei substanțe, aflați în stare excitată, sunt mulți mai reactivi.
Starea de agregare a unei substanțe este în mod invariabil determinată de energia ei și energia prezentă în mediu. Când forțele intermoleculare sunt atât de puternice încât energia din mediu nu poate să depășească acele forțe, o substanță poate fi întâlnită într-o stare de agregare mult mai stabilă, precum cea de lichid sau solid (exemplul apei, lichid la temperatura camerei datorită moleculelor stabilizate prin legături de hidrogen.[94] Acidul sulfhidric este un gaz la temperatura camerei și condiții standard de presiune, datorită moleculelor stabilizate prin interacțiuni mult mai slabe, de tip dipol-dipol.
Transferul de energie de la o substanță chimică la alta depinde de cantitatea de energie cuantă emisă de aceasta. Totuși, energia termică este de regulă transferată mai ușor deoarece fononii responsabili pentru energia vibrațională și rotațională au un nivel energetic mai mic decât fotonii implicați în transferul electronic. Deoarece nivelurile energetice ale fononilor sunt mult mai apropiate decât cele ale fotonilor, căldura este transmisă mai ușor între substanțe, comparativ cu lumina sau alte forme de energie electronică. De exemplu, radiația electromagnetică din spectrul ultravioletelor nu este transmisă la fel de eficient precum energia termică sau electrică.
Existența unor niveluri energetice caracteristice pentru diferite substanțe chimice este folositoare în scopul identificării lor prin analiza liniilor spectrale. Diverse tipuri de spectre sunt utilizate în cadrul spectroscopiei chimice, ex. infraroșu, microunde, NMR, ESR, etc. Spectroscopia este de asemenea folosită pentru identificarea compoziției - precum stelele și galaxiile îndepărtate - prin analiza spectrului de radiație.

Termenul de energie chimică este de asemenea utilizat pentru a indica potențialul unei substanțe chimice de a suferi anumite transformări printr-o reacție chimică sau de a transforma alte substanțe chimice.
Redox[modificare | modificare sursă]
Oxido-reducerea (sau redox) este o reacție ce are loc cu transfer de electroni între speciile atomice.[95] Substanțele ce prezintă proprietatea de a oxida alte substanțe se numesc agenți oxidanți sau simplu, oxidanți. Acestea îndepărtează electroni din alte substanțe. În mod similar, substanțele ce prezintă proprietatea de a reduce alte substanțe se numesc agenți reducători, sau simplu, reducători. Aceștia transferă electroni unei alte specii chimice. Oxidarea reprezintă cedare de electroni, iar reducerea decurge cu acceptare de electroni.[96] Reacțiile redox au loc cu schimbarea numărului de oxidare a speciilor chimice implicate. Astfel, oxidarea decurge cu creșterea acestuia, iar reducerea are loc cu scăderea lui.[97]
Aciditate si bazicitate[modificare | modificare sursă]
O substanță poate fi deseori clasificată ca un acid sau o bază. Acest lucru este făcut de multe ori pe baza unui anumit tip de reacție, și anume la schimbul de protoni dintre compuși chimici. Conform teoriei protolitice a lui Brönstead și Lowri, acizii sunt specii chimice care cedează protoni, iar bazele sunt specii chimice care acceptă protoni. Cu toate acestea, o extensie a acestui mod de clasificare a fost făcută de chimistul american, Gilbert Newton Lewis; în acest mod de clasificare reacțiile nu sunt limitate la cele care au loc într-o soluție apoasă, astfel, nu mai este limitată la soluții în apă. În conformitate cu conceptul lui Lewis, de o importanță crucială sunt schimburile de electroni.

O a treia teorie comună este legea acid-bază a lui Lewis, bazată pe formarea legăturilor chimice noi. Această teorie explică faptul că un acid este o substanță capabilă să accepte o pereche de electroni, în timp ce o bază este o substanță care poate ceda o pereche de electroni, în scopul formării unei noi legături chimice. Conform acestei teorii, elemente cruciale ale acestor schimburi este sarcina electrică.[98][este de încredere?] Există câteva moduri prin care o substanță poate fi clasificată ca un acid sau o bază, fapt evidențiat prin istoricul acestor concepte.[99]
Tăria acizilor este măsurată, de regulă, prin 2 metode. Una din ele, bazată pe scala de definire a acidității lui Arrhenius, este pH-ul, care este unitatea de măsură a concentrației ionului de hidroniu într-o soluție, fiind exprimată pe o scală logaritmică negativă. Astfel, soluțiile care au un pH scăzut au o concentrație mare de ion de hidroniu, fiind considerate a fi mult mai acide. Cealaltă măsurătoare, bazată pe definirea lui Brønsted–Lowry, este constanta disocierii acide (Ka), care măsoară abilitatea relativă a unei substanțe de a acționa ca un acid; substanțele cu constanta de aciditate mai mare sunt mult mai predispuse să cedeze ioni de hidrogen în cadrul reacțiilor chimice decât cele cu valori scăzute ale constantei.
Echilibru chimic[modificare | modificare sursă]
Cu toate că termenul de echilibru este folosit în cadrul științelor, în contextul chimic, echilibrul apare atunci când un număr diferit de stări de agregare ale compoziției chimice sunt posibile (de exemplu, într-un amestec de compuși chimici ce pot reacționa unii cu alții sau atunci când o substanță poate fi prezentă în mai mult de o stare de agregare).
Un sistem de substanțe chimice aflate la echilibru, cu toate că prezintă o compoziție neschimbătoare, nu este static; moleculele substanțelor continuă să reacționeze unele cu celelalte, dând naștere astfel unui echilibru dinamic. Prin aceasta, conceptul descrie starea în care parametrii precum compoziția chimică rămâne neschimbată în decursul timpului.
Legi fundamentale ale chimiei[modificare | modificare sursă]
Reacțiile chimice sunt determinate de anumite legi, care au devenit concepte fundamentale în chimie. Unele dintre aceste legi sunt:
- Legea lui Avogadro - volume egale ale gazelor, la aceeași temperatură și presiune, conțin același număr de particule (sau molecule).
- Legea Beer-Lambert
- Legea Boyle-Mariotte (1662, făcând o legătură între presiune și volum)
- Legea lui Charles (1787, făcând o legătură între volum și temperatură)
- Legile lui Fick
- Legea lui Gay-Lussac (1809, făcând o legătură între presiune și temperatură)
- Principiul lui Le Chatelier
- Legea lui Henry
- Legea lui Hess
- Legea conservării energiei conduce spre concepte importante ale echilibrului chimic, termodinamicii și chimiei cinetice.
- Legea conservării masei substanțelor, potrivit fizicii moderne este de fapt energia care se conservă, iar acea energie și masa sunt corelate; un concept care devine foarte important în chimia nucleară.
- Legea proporțiilor definite, care ne arată că toate moleculele unui compus sunt identice și toți atomi unei specii chimice au aceeași masă.
- Legea proporțiilor multiple potrivit căreia o cantitate dintr-un element se combină cu o cantitate diferită dintr-un al doilea element spre a rezulta diferite combinații, între cantitățile în grame există un raport de numere întregi și mic
- Legea lui Raoult
- Legea proporțiilor echivalente - masele elementelor care se combină sau se substituie sunt proporționale cu echivalenții lor chimici.
- Legea acțiunii maselor - pentru o reacție de echilibru, raportul dintre produsul concentrațiilor produșilor de reacție și produsul concentrațiilor reactanților este o constantă
- Legea volumelor constante - la presiune constantă, între volumele gazelor care reacționează și volumele gazelor care rezultă există un raport de numere întregi și mici.
Sistemul Internațional de Unități[modificare | modificare sursă]
Sistemul Internațional de Unități (pe scurt Sistemul Internațional) este un sistem de unități de măsură și este forma modernă a sistemului metric (MKS). Abrevierea în toate limbile este SI (potrivit prescurtării franceze: Système international d'unités), indiferent de cum se numește sistemul într-o anumită limbă.
Sistemul internațional conține șapte unități fundamentale: metrul, kilogramul, secunda, amperul, kelvinul, molul și candela. Aceste unități sunt neredundante din punct de vedere al domeniilor mărimilor fizice măsurate. Din cele șapte unități de măsură fundamentale se pot deriva un număr nelimitat de unități derivate, care pot acoperi tot domeniul fenomenelor fizice cunoscute. Unitățile SI derivate sunt coerente, adică la derivarea lor nu trebuie folosit niciun factor de scară. Unitățile SI pot fi folosite și împreună cu unități ale altor sisteme, însă se pierde principalul avantaj, coerența.
Sistemul International de Unități reprezintă o convenție aplicată exclusiv în toate laboratoarele de chimie din lume[100].
Aplicații practice[modificare | modificare sursă]
Subdiscipline[modificare | modificare sursă]
Ca orice alt obiect de studiu major, chimia este împărțită în câteva subdiscipline:[101]
- Chimie organică este ramura chimiei care se ocupă cu studiul structurii, proprietăților, reacțiilor de sinteză sau de descompunere a compușilor organici. Compușii organici sunt substanțe alcătuite în principal din carbon și hidrogen, dar pot conține și oxigen, azot, sulf, fosfor sau bor, precum și restul elementelor, dar în cantități mult mai mici.
- Chimie anorganică este o ramură a chimiei, ce studiază proprietățile elementelor chimice și compușii formați de acestea. Interpretarea compușilor anorganici se face cel mai bine prin modele calitative ale mecanicii cuantice. Nu există o distincție clară între disciplina organică și anorganică, fiind întrepătrunse în cadrul chimiei organometalice.
- Chimie analitică reprezintă disciplina științifică ce dezvoltă și aplică metode, instrumente și strategii în scopul obținerii de informații cu privire la compoziția și natura elementelor.
- Chimie fizică este ramură a chimiei care se ocupă cu studierea fenomenelor macroscopice, atomice, subatomice și particulare în sistemele chimice, în ceea ce privește legile fizice. Chimia fizică adesea folosește concepte din fizică precum mișcarea, energie, forță, timp, termodinamică, chimie cuantică, mecanică statistică, și dinamică.[102]
- Electrochimie reprezintă un domeniu de interferență dintre chimie și studiul electricității, care studiază reacțiile electrochimice și aplicațiile acestora: electroliza, coroziunea, acumulatorii electrici, bateriile, procedeele electrochimice de acoperire metalică. Cel mai important procedeu care este studiat de electrochimie este electroliza, ce reprezintă o reacție chimică ce are loc la trecerea curentului electric.
- Biochimie este știința care studiază chimia vieții. Considerată multă vreme o ramură interdisciplinară aflată la granița între chimie și biologie, biochimia s-a dezvoltat în special în ultimele decenii ca o disciplină de sine stătătoare, abordând subiecte ca structura chimică a substanțelor din care sunt formate organismele, interacțiunile între aceste substanțe și transformările metabolice pe care acestea le suferă in vivo. În mare, se poate considera că biochimia are două ramuri: biochimia metabolismelor și biochimia structurală.
- Chimie teoretică este o ramură a chimiei ce se folosește de legile fizicii pentru a explica și prezice proprietățile diferitelor substanțe.
- Chimia materialelor este reprezentată de prepararea, caracterizarea și înțelegerea substanțelor folositoare. Principalele obiecte de studiu sunt chimia stărilor de agregare (solide, lichide, polimeri) și procesele ce au loc între stări de agregare diferite.
- Neurochimie o ramură a neurologiei, ce se ocupă cu studierea naturii și funcțiilor neurotransmițătorilor și cu efectul pe care substanțele chimice îl au asupra celulelor nervoase.
- Chimie nucleară este o ramură a chimiei care studiază radioactivitatea, procesele nucleare și proprietățile nucleare ale compușilor. Altfel spus, este studiul chimiei elementelor radioactive, cum sunt actinidele radiu și radon, împreună cu studiul implicării chimiei în echipamentul necesar realizării proceselor nucleare.
Alte discipline din cadrul chimiei sunt grupate în funcție de tipul materiei studiat sau de tipul studiului. Chimia anorganică studiază materia anorganică, chimia organică studiază materia organică bazată pe carbon, biochimia studiază substanțele chimice prezente în organismele biologice, chimia fizică studiază procesele chimice prin intermediul conceptelor precum termodinamica și mecanica cuantică, iar chimia analitică utilizează analiza mostrelor pentru înțelegerea compoziției și structurii chimice.
Alte domenii includ agrochimie, astrochimie (and cosmochimie), chimia atmosferică, inginerie chimică, Biologie chimică, Chemo-informatica, electrochimie, chimia mediului, Femtochimia, Chimia aromelor, Chimia fluxului, geochimie, Chimia ecologică, Histochimia, Istoria chimiei, chimia hidrogenării, Imunochimia, Chimia marină, Știința materialelor, Chimie matematică, Mecanochimia, Chimie medicinală, Biologie moleculară, Mecanica moleculară, Nanotehnologie, Chimia produselor naturale, Oenologie, Chimie organometalică, petrochimie, farmacologie, fotochimie, Chimie organică fizică, Fitochimie, Chimia polimerilor, radiochimie, Chimia solidelor, sonochimie, Chimie supramoleculară, termochimie, și multe altele.
Industria chimică[modificare | modificare sursă]
Industria chimică a început să se dezvolte în perioada postbelică, datorită numeroaselor inovații care apăruseră între 1935-1955, fiind în concordanță cu creșterea cererilor mondiale în diverse sectoare chimice[103]. Industria chimică este caracterizată de importanța sa aplicată, fiind întâlnită în cadrul organizării și managementului unei companii, economiei tehnice, inginerie chimică și controlul mediului[104]. Scopul industriei chimice este de a prelucra materii prime precum sărurile, petrolul și calcarul spre transformarea lor într-o gamă largă de produse care au ca scop îmbunătățirea vieții și stilului de viață[105].
Prima jumătate a sec.XIX-lea[modificare | modificare sursă]
Descoperiri științifice între 1850-1914[modificare | modificare sursă]
Perioada interbelică (1914-1945)[modificare | modificare sursă]
Consecințe[modificare | modificare sursă]
1973[modificare | modificare sursă]
Anii 90[modificare | modificare sursă]
Industria mileniului III[modificare | modificare sursă]
Societăți profesionale[modificare | modificare sursă]
- American Chemical Society
- American Society for Neurochemistry
- Chemical Institute of Canada
- Chemical Society of Peru
- Uniunea Internațională de Chimie Pură și Aplicată
- Royal Australian Chemical Institute
- Royal Netherlands Chemical Society
- Royal Society of Chemistry
- Society of Chemical Industry
- World Association of Theoretical and Computational Chemists
- List of chemistry societies
Note[modificare | modificare sursă]
- ^ The Esoteric Codex: Hermeticism I, de Mark Rogers, pagina 39
- ^ „What is Chemistry?”. Chemweb.ucc.ie. Arhivat din original la . Accesat în .
- ^ Chemistry. (n.d.). Merriam-Webster's Medical Dictionary. Retrieved 19 august 2007.
- ^ Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. Chemistry: The Central Science. Prentice Hall; 8 edition (1999). ISBN 0-13-010310-1. Pages 3-4.
- ^ Wiley-VCH, 2001. ISBN 3-527-30271-9. Paginile 1-2.
- ^ „Dictionary of the History of Ideas: Alchemy”. Arhivat din original la . Accesat în .
- ^ Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. Chemistry: The Central Science. Prentice Hall; 8 edition (1999). ISBN 0-13-010310-1. Pages 3–4.
- ^ Chemistry occupyies an intermediate position in a hierarchy of the sciences by reductive level between physics and biology. Carsten Reinhardt. Chemical Sciences in the 20th Century: Bridging Boundaries. Wiley-VCH, 2001. ISBN 3-527-30271-9. Pages 1–2.
- ^ en Merriam-Webster's Medical Dictionary. „"Chimie" în dicționar”. Accesat în .
- ^ Definiția în DEX a cuvântului chimie
- ^ a b A Philatelic Ramble Through Chemistry, de Edgar Heilbronner,Foil A. Miller, pagina 12
- ^ „History of Alchemy”. Alchemy Lab. Accesat în .
- ^ Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. ISBN 0-486-21873-2
- ^ a b "alchemy", entry in The Oxford English Dictionary, J. A. Simpson and E. S. C. Weiner, vol. 1, 2nd ed., 1989, ISBN 0-19-861213-3.
- ^ p. 854, "Arabic alchemy", Georges C. Anawati, pp. 853–885 in Encyclopedia of the history of Arabic science, eds. Roshdi Rashed and Régis Morelon, London: Routledge, 1996, vol. 3, ISBN 0-415-12412-3.
- ^ A Manual of Chemistry: Containing a Condensed View of the Present State of ..., de Lewis Caleb Beck, pagina 13
- ^ a b The Elixir of Immortality: A Modern-Day Alchemist’s Discovery of the ..., de Robert E. Cox, pagina 21
- ^ Popular Treatise on Chemistry. 1. Chemistry of Nature, pagina 18
- ^ Negoiu, Dumitru - Tratat de chimie anorganica vol. I | Robin Cruise Jr. - Academia.edu
- ^ Egyptian Magic: The Quest for Thoth's Book of Secrets, de Maarten J. Raven, pagina 175
- ^ The Gulistan: Or Rose Garden, De Saʻdī,James Ross,Ralph Waldo Emerson, pagina 74
- ^ Strathern, P. (2000). Mendeleyev’s Dream – the Quest for the Elements. New York: Berkley Books.
- ^ a b Philosophy of Chemistry: Growth of a New Discipline, editat de Eric Scerri,Lee McIntyre, pagina 108
- ^ Boyle, Robert (). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 0486428257.
- ^ Glaser, Christopher (). Traite de la chymie. Paris. as found in: Kim, Mi Gyung (). Affinity, That Elusive Dream - A Genealogy of the Chemical Revolution. The MIT Press. ISBN 0-262-11273-6.
- ^ Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution, De Bruce T. MORAN,Bruce T Moran, pagina 118
- ^ Chemistry and Medical Debate: Van Helmont to Boerhaave, de Allen G. Debus, pagina 217
- ^ Stahl, George, E. (). Philosophical Principles of Universal Chemistry. London.
- ^ Dumas, J. B. (1837). 'Affinite' (lecture notes), vii, pg 4. “Statique chimique”, Paris: Academie des Sciences
- ^ A Short History of Chemistry, de James Riddick Partington, pagina 234
- ^ Pauling, Linus (). General Chemistry. Dover Publications, Inc. ISBN 0486656225.
- ^ Chang, Raymond (). Chemistry, 6th Ed. New York: McGraw Hill. ISBN 0-07-115221-0.
- ^ The Future of Post-Human Chemistry: A Preface to a New Theory of Substances ..., de Peter Baofu, pagina 5
- ^ a b c The Basics of Chemistry, de Richard Myers, pagina 7
- ^ Chemistry: Notable Research and Discoveries, de Kyle Kirkland, pagina 183
- ^ http://www.newscientist.com/article/mg16121734.300-first-chemists.html First chemists], 13 februarie 1999, New Scientist
- ^ a b The Basics of Chemistry, de Richard Myers, pagina 8
- ^ Alchemy Timeline Arhivat în , la Wayback Machine. - Chemical Heritage Society
- ^ a b c d e The Basics of Chemistry, de Richard Myers, pagina 9
- ^ a b The Basics of Chemistry, de Richard Myers, pagina 10
- ^ Lucretius (50 BCE). „de Rerum Natura (On the Nature of Things)”. The Internet Classics Archive. Massachusetts Institute of Technology. Arhivat din original la 2011-06-29. Accesat în 2007-01-09. Verificați datele pentru:
|date=(ajutor) - ^ Simpson, David (29 June 2005). „Lucretius (c. 99 - c. 55 BCE)”. The Internet History of Philosophy. Accesat în 2007-01-09. Verificați datele pentru:
|date=(ajutor) - ^ Chemistry De Joan Solomon, pagina 15
- ^ The Story of Chemistry De N.C. Datta, pagina 23
- ^ Definiția cuvântului iatrochimie în DEX
- ^ A Philatelic Ramble Through Chemistry, de Edgar Heilbronner,Foil A. Miller, pagina 19
- ^ Francis Bacon and the Transformation of Early-Modern Philosophy, de Stephen Gaukroge, pagina 167
- ^ "Robert Boyle, Founder of Modern Chemistry" Harry Sootin (2011)
- ^ „History - Robert Boyle (1627–1691)”. BBC. Accesat în .
- ^ Eagle, Cassandra T.; Jennifer Sloan (). „Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry”. The Chemical Educator. 3 (5): 1–18. doi:10.1007/s00897980249a.
- ^ Mi Gyung Kim (). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. p. 440. ISBN 0-262-11273-6.
- ^ Chemistry 412 course notes. „A Brief History of the Development of Periodic Table”. Western Oregon University. Accesat în .
- ^ Note: "...it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table" and „Dmitri Mendeleev”. Royal Society of Chemistry. Accesat în .
- ^ Davy, Humphry (). „On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases”. Philosophical Transactions of the Royal Society. Royal Society of London. 98 (0): 1–45. doi:10.1098/rstl.1808.0001.
- ^ Winter, Mark. „WebElements: the periodic table on the web”. The University of Sheffield. Arhivat din originalul de la . Accesat în .
- ^ „Julius Lothar Meyer and Dmitri Ivanovich Mendeleev”. Chemical Heritage Foundation. Accesat în .
- ^ "What makes these family likenesses among the elements? In the 1860s everyone was scratching their heads about that, and several scientists moved towards rather similar answers. The man who solved the problem most triumphantly was a young Russian called Dmitri Ivanovich Mendeleev, who visited the salt mine at Wieliczka in 1859." Bronowski, Jacob (). The Ascent of Man. Little, Brown and Company. p. 322. ISBN 0-316-10930-4.
- ^ Ihde, Aaron John (). The Development of Modern Chemistry. Courier Dover Publications. p. 164. ISBN 0-486-64235-6.
- ^ „Chemistry”. Chemistry2011.org. Arhivat din original la . Accesat în .
- ^ „chemical bonding”. Britannica. Encyclopædia Britannica. Accesat în .
- ^ Matter: Atoms from Democritus to Dalton by Anthony Carpi, Ph.D.
- ^ IUPAC Gold Book Definition
- ^ „California Occupational Guide Number 22: Chemists”. Calmis.ca.gov. . Arhivat din original la . Accesat în .
- ^ „General Chemistry Online - Companion Notes: Matter”. Antoine.frostburg.edu. Accesat în .
- ^ General Chemistry, de Linus Pauling, pagina 1
- ^ a b Chemistry, Grades 6 - 12: Physical and Chemical Changes in Matter, de Barbara R. Sandall, Ed.D., pagina 21
- ^ Armstrong, James (). General, Organic, and Biochemistry: An Applied Approach. Brooks/Cole. p. 48. ISBN 978-0-534-49349-3.
- ^ General Chemistry, de Linus Pauling, pagina 7
- ^ General Chemistry, de Linus Pauling, pagina 2
- ^ General Chemistry, de Linus Pauling, pagina 3
- ^ General Chemistry, de Linus Pauling, pagina 18
- ^ Curs de chimie generală, Anca Mihaly Cozmuta, Leonard Mihaly Cozmuta, pagina 8
- ^ a b c Essentials of Inorganic Chemistry: For Students of Pharmacy, Pharmaceutical ..., de Katja A. Strohfeldt, pagina 3
- ^ Burrows et al. 2008, p. 13.
- ^ a b Housecroft & Sharpe 2008, p. 2.
- ^ Burrows et al. 2009, p. 110.
- ^ Burrows et al. 2008, p. 12.
- ^ „IUPAC Nomenclature of Organic Chemistry”. Acdlabs.com. Accesat în .
- ^ IUPAC Provisional Recommendations for the Nomenclature of Inorganic Chemistry (2004) [1][nefuncțională]
- ^ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (). General Chemistry (ed. 4th). Upper Saddle River, New Jersey: Pearson Prentice Hall. p. 37.
- ^ M. M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
- ^ a b General Chemistry, de Linus Pauling, pagina 11
- ^ Chemistry: An Industry-Based Introduction with CD-ROM, de John Kenkel,Paul B. Kelter,David S. Hage, pagina 4
- ^ General Chemistry, De Linus Pauling, pagina 12
- ^ „Official SI Unit definitions”. Bipm.org. Accesat în .
- ^ Burrows et al. 2008, p. 16.
- ^ Atkins & de Paula 2009, p. 9.
- ^ Curs de chimie generala, Anca Mihaly Cozmuta, Leonard Mihaly Cozmuta, pagina 25
- ^ Visionlearning. „Chemical Bonding by Anthony Carpi, Ph”. visionlearning. Accesat în .
- ^ IUPAC Gold Book Definition Arhivat în , la Wayback Machine.
- ^ Chemical Reaction Equation- IUPAC Goldbook
- ^ Gold Book Chemical Reaction IUPAC Goldbook
- ^ Reilly, Michael. (2007). Mechanical force induces chemical reaction, NewScientist.com news service, Reilly
- ^ Changing States of Matter - Chemforkids.com
- ^ en Redox Reactions. shodor.org. Accesat la data de 30 ianuarie 2009.
- ^ en DEFINITIONS OF OXIDATION AND REDUCTION (REDOX). chemguide.co.uk. Accesat la data de 30 ianuarie 2009.
- ^ en Redox reaction and Equations Arhivat în , la Wayback Machine.. chemistry.co.nz. Accesat la data de 30 ianuarie 2009.
- ^ „The Lewis Acid-Base Concept”. Apsidium. . Arhivat din originalul de la . Accesat în .
- ^ „History of Acidity”. Bbc.co.uk. . Accesat în .
- ^ Chemistry: An Industry-Based Introduction with CD-ROM, De John Kenkel,Paul B. Kelter,David S. Hage, pagina 174
- ^ W.G. Laidlaw; D.E. Ryan And Gary Horlick; H.C. Clark, Josef Takats, And Martin Cowie; R.U. Lemieux (). „Chemistry Subdisciplines”. The Canadian Encyclopedia. Arhivat din original la . Accesat în .
- ^ Herbst, Eric (). „Chemistry of Star-Forming Regions”. Journal of Physical Chemistry A. 109 (18): 4017–4029. doi:10.1021/jp050461c. PMID 16833724.
- ^ Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology, editat de James A. Kent, pagina 1
- ^ An Introduction to Industrial Chemistry, De C.A. Heaton, pagina 1
- ^ An Introduction to Industrial Chemistry, De C.A. Heaton, pagina 7
Bibliografie[modificare | modificare sursă]
- Atkins, P.W. Galileo's Finger (Oxford University Press) ISBN 0-19-860941-8
- Atkins, P.W. Atkins' Molecules (Cambridge University Press) ISBN 0-521-82397-8
- Stwertka, A. A Guide to the Elements (Oxford University Press) ISBN 0-19-515027-9
- Roșu (2008). Curs de Chimie generală, Universitatea din București.
- Negoiu, Dumitru. Tratat de chimie anorganică. Vol. 1: Chimie generală. 1972, Ed. Didactică și Pedagogică
Vezi și[modificare | modificare sursă]
- Glosar de chimie
- Științe naturale
- Tabelul periodic al elementelor
- Cronologia chimiei
- Istoria descoperirii elementelor chimice
Legături externe[modificare | modificare sursă]
| |||||



