Oxid de cupru (II)
| Oxid de cupru (II) | |
 | |
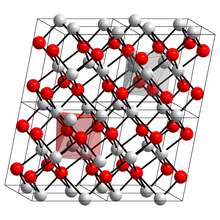 __ Cu2+ __ O2- Structura cristalină a oxidului de cupru (II) | |
| Nume IUPAC | Oxid de cupru (II) |
|---|---|
| Alte denumiri | Oxid cupric |
| Identificare | |
| Număr CAS | 1317-38-0 |
| PubChem CID | 164827 |
| Informații generale | |
| Formulă chimică | CuO |
| Aspect | pudră neagră |
| Masă molară | 79,545 g/mol |
| Proprietăți | |
| Densitate | 6,315 g/cm3 |
| Starea de agregare | solidă |
| Punct de topire | 1 326 °C |
| Punct de fierbere | 2 000 °C |
| Presiune de vapori | 0 millimetre of mercury[1] |
| Pericol | |
| Fraze R | R22, R50/53 |
| Fraze S | S22, S61 |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Oxidul de cupru (II) [2] este unul dintre oxizii cuprului. Este un compus anorganic cu formula chimică CuO, constituit dintr-un atom de cupru cu stare de oxidare maximă și unul de oxigen.
Properietăți chimice[modificare | modificare sursă]
Este un solid negru cu structură ionică ce se topește la temperaturi mai mari de 1200 °C cu pierdere de oxigen. Se poate obține prin sinteză, prin încălzirea cuprului în aer:
- 2 Cu + O2 → 2 CuO
deși în acest caz se formează și oxid de cupru (I). Oxidul de cupru (II) de puritate ridicată se poate obține prin încălzirea azotatului de cupru, hidroxidului de cupru sau carbonatului de cupru:
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- Cu(OH)2 (s) → CuO (s) + H2O (l)
- CuCO3 → CuO + CO2
Oxidul de cupru (II) este un oxid amfoter, și se dizolvă în acizi minerali, printre care se numără acidul clorhidric, acidul sulfuric sau acidul azotic pentru a forma sărurile de cupru (II) respective:
- CuO + 2 HNO3 → Cu(NO3)2 + H2O
- CuO + 2 HCl → CuCl2 + H2O
- CuO + H2SO4 → CuSO4 + H2O
Cu bazele alcaline concentrate, oxidul de cupru (II) reacționează și formează combinații complexe specifice:
- 2 (Metal)OH + CuO + H2O → X2[Cu(OH)4]
Poate fi redus la cupru metalic folosind hidrogen sau monoxid de carbon:
- CuO + H2 → Cu + H2O
- CuO + CO → Cu + CO2
Referințe[modificare | modificare sursă]
- ^ http://www.cdc.gov/niosh/npg/npgd0151.html Lipsește sau este vid:
|title=(ajutor) - ^ Despre oxidul de cupru (II) Accesat pe 27 mai 2014



