Monoxid de azot
| Monoxid de azot | |
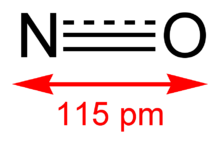 Formula structurală | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 10102-43-9 |
| ChEMBL | CHEMBL1200689 |
| PubChem CID | 145068 |
| Informații generale | |
| Formulă chimică | NO |
| Aspect | gaz incolor |
| Masă molară | 30,01 g/mol |
| Proprietăți | |
| Densitate | 1,25 kg/m3 |
| Starea de agregare | gazoasă |
| Punct de topire | −164 °C |
| Punct de fierbere | −152 °C |
| Solubilitate | în apă (60 mg/l) |
| Presiune de vapori | 34,2 de atmosferă fizicăi[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Monoxidul de azot este un gaz incolor cu formula chimică NO.
În aer, fiind un radical liber instabil, monoxidul de azot se transformă în dioxid de azot (NO2, o noxă). Folosirea masivă în ultimul secol și ceva a motoarelor cu ardere internă, alături de arderea de combustibili fosili pentru generarea de electricitate, crește contribuția antropică (48 milioane de tone anual) la concentrația atmosferică totală a monoxidului de azot la aproximativ 5% din total.[3].
Natural, monoxidul de azot este produs prin acțiunea bacteriană în sol (responsabilă de emisia atmosferică a 990 milioane de tone anual) și datorită descărcărilor electrice în atmosferă (fulgere).
Concentrația atmosferică a monoxidului de azot este rezultatul unui echilibru dinamic datorat unor serii de reacții în care este implicat oxigenul molecular (O2) și ozonul (O3, din straturile inferioare ale atmosferei) prin care mono- și di-oxidul de azot se transformă reciproc unul în celălalt.
Activitatea chimică a moleculei de monoxid de azot este și mai evidentă decât în aer în soluțiile apoase, timpul de înjumătățire al acestei molecule fiind în sânge (un exemplu de soluție apoasă, unde molecula de monoxid îndeplinește importante funcții fiziologice) de doar câteva secunde.
Proprietăți[modificare | modificare sursă]
Monoxid de azot este mai puțin solubil în apă; în contact cu oxigenul se transformă prin oxidare în bioxid de azot NO2 gaz de culoare brună,care dizolvat în apă dă naștere acidului azotic HNO3. Gazul reacționează cu halogenii, iar în contact cu dioxidul de sulf SO2 va fi redus formându-se protoxidul de azot N2O. Gazul are o acțiune iritantă asupra mucoasei respiratorii, fiind cancerigen, iar toxicitatea gazului se manifestă prin formare methemoglobinei care este incapabilă de a mai realiza schimbul de gaze la nivel pulmonar.
Note[modificare | modificare sursă]
- ^ „Monoxid de azot”, nitric oxide (în engleză), PubChem, accesat în
- ^ http://www.cdc.gov/niosh/npg/npgd0448.html Lipsește sau este vid:
|title=(ajutor) - ^ P. Urone în Air Pollution, editat de A. C. Stern, 1976
Legături externe[modificare | modificare sursă]
- International Chemical Safety Card 1311
- „Nitric oxide and its role in health and diabetes”.
- Microscale Gas Chemistry: Experiments with Nitrogen Oxides
- Your Brain Boots Up Like a Computer – new insights about the biological role of nitric oxide.
- Assessing The Potential of Nitric Oxide in the Diabetic Foot
- New Discoveries About Nitric Oxide Can Provide Drugs For Schizophrenia
- Nitric Oxide at the Chemical Database
- „Immediately Dangerous to Life or Health Concentrations (IDLH): Nitric oxide”. National Institute for Occupational Safety and Health.
| |||||
