Difluorură de oxigen
| Diflorură de oxigen | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | anhidrida hipofluoroasă |
| Identificare | |
| Număr CAS | 7783-41-7 |
| PubChem CID | 24547 |
| Informații generale | |
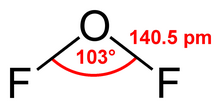
| Formulă chimică | OF2 |
| Aspect | gaz incolor, lichid galben când este condensat |
| Masă molară | 53,9962 g/mol |
| Proprietăți | |
| Densitate | 1,9 g/cm3 (ca lichid, la -145 °C) |
| Punct de topire | −223,8 °C |
| Punct de fierbere | −144,8 °C |
| Solubilitate | 8 mL gazos la 1 L de apă(0 °C) |
| Presiune de vapori | 1 atm[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Difluorura de oxigen este un compus binar al fluorului cu oxigenul cu formula chimică OF2. Datorită electronegativității fluorului din diflorura de oxigen, formula chimică a compusului este OF2 și nu F2O, cum ar trebui să fie (oxid de fluor).
Proprietăți
[modificare | modificare sursă]Fizice
[modificare | modificare sursă]Difluorura de oxigen este un gaz incolor cu miros caracteristic ce atacă căile respiratorii. Este mai grea decât aerul și are caracter oxidant.
Chimice
[modificare | modificare sursă]Reacția cu apa este următoarea:
- 2F2 + 2H2O = 4HF + O2
Obținere
[modificare | modificare sursă]Difluorura de oxigen se obține prin trecerea rapidă a unui curent de fluor (1 l/s) printr-o soluție apoasă de hidroxid de sodiu de concentrație 2% (ce stă într-un vas spălător), după reacția:
- 2F2 + 2NaOH = 2NaF + F2O + H2O
În cultură
[modificare | modificare sursă]În romanul științifico-fantastic al lui Robert L. Forward Camelot 30K, difluorura de oxigen era folosită ca solvent biochimic de către ființele ce locuiau în Centura Kuiper din Sistemul Solar.
Bibliografie
[modificare | modificare sursă]- Manual de lucrări practice de chimie anorganică- Monoxidul de fluor, de Raluca Ripan și I. Ceteanu, 1961, pag. 65
- ^ „Difluorură de oxigen”, Oxygen difluoride (în engleză), PubChem, accesat în
- ^ http://www.cdc.gov/niosh/npg/npgd0475.html Lipsește sau este vid:
|title=(ajutor)
