Metanol
| Metanol | |
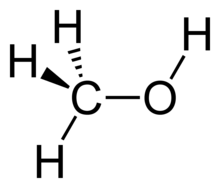 Formula structurală | |
 Modelul tridimensional al moleculei de metanol | |
| Denumiri | |
|---|---|
| Alte denumiri | alcool metilic, carbinol, MeOH |
| Identificare | |
| Număr CAS | 67-56-1 |
| ChEMBL | CHEMBL14688 |
| PubChem CID | 887 |
| Informații generale | |
| Formulă chimică | CH3OH |
| Aspect | lichid incolor |
| Masă molară | 32,04 g/mol |
| Proprietăți | |
| Densitate | 0,79 g/cm3 |
| Starea de agregare | lichidă |
| Punct de topire | −98 °C |
| Punct de fierbere | 65 °C |
| Solubilitate | solubil în apă și solvenți polari |
| Presiune de vapori | 129 hPa (20 °C) |
| Viscozitate | dinamică 0 poiseuille |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Metanolul este un alcool care se sintetizează prin substituirea în molecula de metan a unui atom de hidrogen cu o grupare - OH (hidroxilică). În natură metanolul poate fi întâlnit în plante ca: bumbacul, brânca-ursului, ierburi sau semințe care conțin uleiuri eterice. Metanolul mai poate fi obținut prin fermentarea siropului produs din sfecla de zahăr. În procesele de fermentare a fructelor se poate forma metanol prin descompunerea pectinelor. Consumul de metanol poate produce intoxicații grave, acesta poate lua naștere prin distilarea fracționată în mod particular a alcoolului.
Istoric
[modificare | modificare sursă]În procesul de îmbălsămare, egiptenii din Antichitate utilizau un amestec de substanțe, printre care și metanolul, care era obținut prin piroliza lemnului. Însă metanolul pur a fost pentru prima dată izolat în 1661 de către Robert Boyle care l-a obținut prin distilarea boxusului. Substanța a devenit ulterior cunoscută sub denumirea de „spirt pirozilic”.[2] În 1834 chimiștii francezi Jean-Baptiste Dumas și Eugene Peligot i-au determinat compoziția elementală. Acești oameni de știință au fost cei care au introdus cuvântul „metil” în chimia organică, termen format cu ajutorul etinoamelor grecești „methy” (însemnând „vin”) și „hȳlē” (însemnând „lemn”). Prin această alăturare se dorea ca să se denumească compusul ca „alcool extras din lemn”, însă formularea conține erori, fiind greșită utilizarea cuvântului „methy” pentru traducerea lui „bois” din franceză. Astfel, termenul „metil” a fost întrebuințat pentru a denumi alcoolul metilic, care a fost prescurtat la „metanol” în 1892 de către IUPAC. Sufixul „-ic” a fost folosit din acel moment pentru a denumi substanțele organice ce conțin carbon.[3][4]
În 1923 chimiștii germani Alwin Mittasch și Mathias Pier, ce erau angajati ai BASF, au pus bazele unei tehnologii care transforma gazul de sinteză (un amestec între monoxid de carbon, dioxid de carbon și hidrogen) în metanol. Invenția a fost patentată la 12 ianuarie 1926. Acest proces era realizat în prezența unor catalizatori de oxid de magneziu sau de crom și era realizat în condiții de presiune cuprinsă între 50 și 220 atm și o temperatură mai mare de 450 °C..[5] În 1924 erau procesate peste trei milioane de tone de lemn, din care se obținea o cantitate de aproximativ 30 000 de tone de metanol la nivel mondial, procesul având o eficacitate de aproape 70 %.[6] A. Mittasch și C. Schneider au sintetizat metanol în 1913, însă tehnica utilizată de aceștia nu a avut un impact comercial. După Primul război mondial, echipa de la BASF s-a axat în special pe dezvoltarea cu succes a unui proces de obținere a acestui alcool, după ce M. Pier s-a alăturat companiei. El a produs metanol în februarie 1923 cu o bună selectivitate la o presiune de 1 000 de bari utilizând cromatul de zinc pe post de catalizator.[6]
În anii 1940 s-a pus bazele procesului de obținere a metanolului la presiune joasă de către ICI, prima exploatare realizându-se la Billingham în 1966.[6] Compusul a fost utilizat pe post de combustibil pentru mașini în timpul crizei de petrol din anii 1970 datorită costurilor scăzute, producției ridicate și a efectului mai puțin poluant. Până la mijlocul anilor 1990, peste 20 000 de „vehicule cu combustibil flexibil” ce foloseau fie metanol fie benzină pe post de carburant existau în Statele Unite. În Europa, cantități mici de metanol erau amestecate cu benzină , fapt realizat între anii 1980 până la mijlocul anilor 1990. Producătorii au încetat fabricarea acestor vehicule la sfârșitul anilor 1990, axându-se pe cele ce funcționează cu etanol. În timp ce programul bazat pe motoare cu metanol a reprezentat un succes tehnologic, ridicarea prețului acestui compus a scăzut interesul pentru combustibilul cu metanol.[6].[7]
În anul 2006, astronomii de la observatorul Jodrell Bank au descoperit un nor de metanol ce are o întindere mare și este aflat la o distanță de 300 de miliarde de mile depărtare de Pământ.[8]
Obținere
[modificare | modificare sursă]Metanolul este un produs de bază al chimiei organice și o cantitate semnificativă de alcool este produsă la o scară largă. În 2008, consumul global de metanol a fost de 45 milioane de tone, iar până în 2012 este de așteptat să se ajungă la o capacitate de producție apropiată de 85 milioane de tone.[9] China este în prezent cel mai mare producător și consumator de metanol. Este de așteptat ca producția chineză în următorii câțiva ani să depășească 60 milioane de tone. În timp ce în prezent metanolul este cel mai utilizat în sectorul chimic, folosirea sa în cel al combustibililor înregistrează creșteri importante. În 2008, în China au fost consumate aproximativ trei milioane de tone de metanol ca un amestec de combustibil. Problemele ce implică extinderea pe scară largă și folosirea în proporții mai mari de metanol în combustibil determină dezvoltarea și a altor componente care sunt compatibile cu acesta.[10]
Distilarea lemnului
[modificare | modificare sursă]Distilarea lemnului (carbonizarea) se realizează industrial în cuptoare închise, la o valoare a temperaturii de 500 °C, procentele de substanțe rezultate din lemnele uscate fiind: 15% gaze, 25% apă, 2% metanol, 6% acid acetic, 18% gudroane, 34% mangal, aceste valori variind în funcție de esența lemnului folosit și de modul cum a fost realizată distilarea. Gazele și vaporii rezultați sunt trecuți într-o instalație de condensare, de unde gazele necondensabile sunt separate. Cele au o putere calorifică de 2000-3000 kcal/m3 și pot fi întrebuințate pentru încălzire a retortelor, a cazanelor cu abur, etc. Condensatul este format din acid pirolignos și gudroane de lemn. Acidul pirolignos este un amestec de 8-10% acid acetic și omologi, 3% fracție alcoolică, 7% gudroane solubile și 80% apă.
Îndepărtarea gudroanelor solubile de condensat se face prin distilare; acestea rămân ca reziduu pe vasele de distilare. Vaporii de acid pirolignos sunt trecuți în vase ce conțin lapte de var, unde acidul acetic este reținut sub formă de acetat de calciu, iar restul produselor volatile (fracția alcoolică) se trece mai departe în coloanele de fracționare pentru separarea componentelor. Fracția alcoolică are aproximativ următoarea compoziție: 65-70% metanol, 10-15% acetonă, 10-15% acetat de metil, 1-3% acetaldehidă, 0,5-1% alcool alilic. Fracțiile de la începutul distilării celei alcoolice cum și cele de la sfârșit sunt amestecate și comercializate sub denumirea de „spirt denaturat”.[11][12]
Obținerea din gazul de sinteză
[modificare | modificare sursă]
Materia primă — amestecul format dintr-o parte de monoxid de carbon și două părți de hidrogen (gazul de sinteză) — este trecută sub presiunea de 200–300 atm și o temperatură de 300-400 °C, peste catalizatori (oxid de zinc și oxid de crom). Condițiile de reacție trebuie respectate deoarece materia primă, la alte valori ale parametrilor, se transformă în benzine sintetice (procedeul Fischer-Tropsch). De asemenea, la presiuni și temperaturi mai ridicate, alături de metanol se mai obțin alcooli superiori, îndeosebi alcool izobutilic. Sinteza metanolul este descrisă de reacția:
Obținerea gazului de sinteză prin conversia metanului se poate realiza catalitic în prezența oxigenului, a vaporilor de apă și dioxid de carbon. Aburul favorizează trecerea oxidului de carbon în bioxid de carbon, iar în exces de acest compus, echilibrul se deplasează spre formare de CO2, o reacție puternic endotermă:
Gazul de sinteză obținut, după ce sunt îndepărtate urmele de CO2, apă și CH4 netransformat, este comprimat la presiunea necesară și trimis la reactorul de sinteză a metanolului. Metanolul brut obținut trebuie eliberat de impurități (gaze dizolvate, eter metilic, alcooli superiori, urme de acizi, etc.).[13][14]
Proprietăți
[modificare | modificare sursă]Structură
[modificare | modificare sursă]
Molecula de metanol este alcătuită dintr-un atom de carbon, unul de oxigen si patru de hidrogen. Ca unități structurale, are o grupare metil ce prezintă o simterie trigonală și una hidroxil. Aceasta este constituită dintr-un atom de hidrogen și unul de oxigen hibridizat sp3 ce are două perechi de electroni liberi. Unghiul dintre carbon, oxigen și atomul de hidrogen este de 108.9 °, valoare apropiată de cea existentă într-un tetraedru (109.47 °), iar cel al grupării metil este de 109 °. Lungimea legăturii dintre carbon și oxigen este de 1,43 Å, cea dintre carbon si hidrogen este de 1,10 Å, iar cea dintre oxigen și hidrogen are o valoare mai mică (0,96 Å), fapt datorat electronegativității ridicate a oxigenului.[15]
Diferența de electronegativitate între carbon și oxigen și între hidrogen și oxigen determină

existența unui deficit de densitate electronică în jurul grupării metil și în jurul atomilor de hidrogen și un surplus asociat perechilor de electroni liberi ai oxigenului. Rezultă astfel un moment de dipol molecular ce are valoarea de 5,67 x 10−30 cm (1,7 Debye).
În stare lichidă, metanolul se prezintă sub forma unor asociații moleculare legate între ele prin intermediul legăturilor de hidrogen, lucru indicat de valori mai mari ale punctelor de fierbe, de topire și a forțelor de dispersie London decât a altor substanțe cu același număr de electroni și cu o structură similară.[16] Rotația în jurul legăturii carbon-oxigen este restricționată. Totuși, rezistența la rotație a acesteia reprezintă doar o treime din cea a două grupări de metil (cum ar fi în etan), având valoarea de 4,48 kJ / mol.[17]
Proprietăți termochimice
[modificare | modificare sursă]La temperatura camerei, metanolul este un lichid cu miros pătrunzător, eterat și este toxic.[13] Punctul de fierbere este de 65 °C, iar cel de solidificare este de -97 °C, formând cristale incolore. Densitatea în stare lichidă este de 791 kg/m3, iar căldura de vaporizare este de 35278 kJ/kmol.[18] La 25 °C, presiune de vapori are valoarea de 126 mmHg, căldura de ardere de 19,930 MJ/kg și coeficientul de difuzie a lichidului de 1,65×10−9 m2/sec.[19] La 30 °C, căldura latentă este de 1155 kJ/kg, conductivitatea termică de 0,203 W/m °C, viscozitatea lichidului de 0,521 cP, iar cea a vaporilor de 0,98×102 cP. Capacitatea termică masică a vaporilor este de 1,47 kJ/kg °C, iar tensiunea de suprafață a lichidului de 2,18×102 N/m.[20] Se amestecă cu apa în orice proporții.[13]
În stare lichidă metanolul este format din asociații moleculare de forma (CH3-OH)x legate între ele prin legături de hidrogen, fapt datorat polarității grupei hidroxil. În timp ce punctul de topire este aproape egal cu cel de clorurii de metilen, punctul de fierbere este relativ ridicat în comparație cu această halogenură. energia de disociere a legăturilor de hidrogen este de 20 kJ/mol. Metanolul cristalizează în sistemul de cristal ortorombic cu parametrii {{{1}}}, {{{1}}} și {{{1}}}. Structura sa poate fi descrisă și ca un polimer legat prin punți de hidrogen. La o răcire semnificativă are loc o pliere a lanțului de polimer într-un sistem de cristal monoclinic. Este solubil în apă (0,789) și în alți compuși organici, cum ar fi acetonitril, benzen, cloroform, ciclopentan, metacrilat de metil și tetrahidrofuran.[21][22][23]
Polaritatea grupării hidroxil determină amestecarea cu apa în orice proporții, fapt reflectat prin solubilitatea clorurii de calciu și a sulfatului de cupru în metanol. Alcoolul este de asemenea, solubil în eter dietilic, în hidrocarburi și mulți alți solvenți organici. Se amestecă ușor în grăsimi vegetale și uleiuri.
Reactivitate chimică
[modificare | modificare sursă]pKa-ul metanolului are o valoare de 16. În reacție cu acizi puternici, cum ar fi acidul sulfuric, el se poate protona. Bazele puternice deprotonează molecula de alcool.[24]

Metanolul arde cu flacără albăstruie folosind dioxid de carbon și apă. Poate fi oxidat cu bicromat de potasiu acid, dicromat de sodiu acid sau cu permanganat de potasiu pentru a forma formaldehidă. Dacă agentul de oxidare este în exces, atunci formaldehida se va oxida mai departe la acid formic și mai apoi la dioxid de carbon și apă. O altă modalitate de a obține formaldehida este de a trece vaporii de alcool peste cupru înroșit adus la 300 °C. Doi atomi de hidrogen sunt eliminați din fiecare moleculă, obținându-se și hidrogen gazos, realizându-se astfel dehidrogenarea metanoulului. Alcoolul nu poate da reacții de dehidratare. În schimb, în reacție cu acidul sulfuric se formează dimetil sulfat. Formează cu acizii organici esteri, iar cu sodiu eliberează hidrogen. Reacțiile de substituție se pot realiza cu pentaclorura de fosfor sau cu acidul clorhidric.[25]
Răspândire în natură
[modificare | modificare sursă]Metanolul este întalnit in fructe, unde este produs de către metilestaraza prin atacul pectinei metoxilate,[26] existând in concentrații diferite în funcție de fruct.
Aplicații practice
[modificare | modificare sursă]În industria chimică, metanolul servește ca materie primă sau ca furnizor de energie. Recuperarea sa necesită utilizarea unor compuși de o puritate înaltă. Alcoolul poate fi folosit pe post de combustibil, fiind posibilă adăugarea sa la carburanții convenționali sau utilizarea de metanol pur, fără sulf. Este un furnizor de hidrogen pentru pilele de combustie.
Materie primă
[modificare | modificare sursă]Din metanol prin oxidare cu oxigen pe un catalizator de argint sau prin procesul Formox (oxidare cu oxid de fier / molibden / pe catalizator de oxid de vanadiu), la 400 °C, se obține formaldehidă:
În 2003, în SUA și Canada, s-au obținut cinci milioane de tone de formaldehidă în valoare de 1,5 miliarde de dolari americani, devenind a cincea importantă producție în Statele Unite. Substanța este folosită pentru fabricarea de uree, fenol și melamină. Aproximativ 50% din totalul de formaldehidă este consumat la fabricarea produselor din lemn. În 2005, China a fost cel mai mare producător mondial, având o capacitate de 11 milioane de tone.
În 1970, compania Monsanto pune bazele unei linii tehnologice de producere a acidului acetic utilizând pe post de catalizator cis−[Rh(CO)2I2]− și acid iodhidric. Procesul este eficient și la presiuni mici, decurgând aproape fără obținere de produși secundari.
Rolul acidului iodhidric este de a forma iodura de metil, specie ce urmează a reacționa cu complexul de rodiu. În ciclul catalitic, are loc o adiție oxidativă a [Rh(CO)2I2]− la iodura de metil, urmată de coordinarea și introducerea monoxidului de carbon în moleculă, formându-se un complex acil. Apoi se elimină acidul iodhidric prin reducerea complexului. Iodura de acil este ulterior hidrolizată, obținându-se acidul acetic.[27] Prin modificarea condițiilor de reacție se poate obține anhidrida acetică pe aceeași linie de producție.
Pentru a se obține metacrilatul de metil, monomer pentru polimerul polimetacrilat de metil se poate porni fie de la 2-metil propan, fie de la terț-butanol. Aceste substanțe sunt oxidate la metacroleină și apoi la acid metacrilic care este ulterior esterificat cu metanol.[28]
Metanolul poate fi dehidrogenat folosind catalizatori de cupru-dopat pentru a forma formiat de metil.
Prin esterificare se pot obține un număr mare de produse derivate. Clormetanul este unul dintre cei mai importanți, fiind obținut la o scară mailargă datorită costurilor mai mici de producție ale acidului clorhidric. Esterii metilici ai acizilor grași pot fi produși prin procesul de transesterificare convențională. Prin oxidare în două etape ale p-xilenului se formează un terftalat de dimetil. Prin reacția metanoululi cu amoniac utilizând pe post de catalizator un amestec de silicat de aluminiu și amine de metil se realizează un intermediar cu aplicații pentru vopsele, medicamente și pesticide. Reația alcoolului pe zeoliți de tipul ZSM-5 în metanol ce conduce la olefine gestionează procesul de producție a unor compuși chimici cu catenă mică cum ar fi etenă, propenă sau butenă.
Prin varierea condițiilor de reacție, selectivitatea obținerii produselor aromatice poate fi schimbată.
Vezi și
[modificare | modificare sursă]- Pilă de combustie cu alimentare directă cu metanol
- Pilă de combustie cu alimentare indirectă cu metanol
Note
[modificare | modificare sursă]- ^ „Metanol”, methanol (în engleză), PubChem, accesat în
- ^ A. Gossauer: Struktur und Reaktivitat der Biomolekule. Verlag Wiley-VCH, p. 176
- ^ S. Lee: Methanol synthesis technology. Verlag CRC Press, p. 2
- ^ J. R. Couper, O. T. Beasley,W. R. Penney: The chemical process industries infrastructure: function and economics. Verlag Marcel Dekker Inc., p. 199
- ^ „1902 - 1924 - BASF - The Chemical Company - Corporate Website”. www.basf.com. Arhivat din original la . Accesat în .
- ^ a b c d en [1] Arhivat în , la Wayback Machine..
- ^ „Methanol als Energieträger” (PDF). juwel.fz-juelich.de. Accesat în .[nefuncțională]
- ^ Astronomers find alcohol cloud spanning 288 billion miles
- ^ „2008 World Methanol Analysis” (PDF). www.cmaiglobal.com. Accesat în .[nefuncțională]
- ^ „The 5% solution” (PDF). www.methanol.org. Accesat în .[nefuncțională]
- ^ Beral, p. 280
- ^ en Chapter 12 - Recovery of by-products from hardwood carbonization
- ^ a b c Beral, p.282
- ^ Beral, p. 281
- ^ „Alkohole” (PDF). www.uni-tuebingen.de. Accesat în .
- ^ en Methanol
- ^ E. V. Ivash, D. M. Dennison, Journal of Chemical Physics 1953, 21, p. 1804.
- ^ en Methanol - Properties.
- ^ en A Summary of Physical and Chemical Properties of Methanol, Gasoline (BTEX), and Benzene Arhivat în , la Wayback Machine.
- ^ en Methanol - Thermophysical Properties.
- ^ L. Pauling: Die Natur der chemischen Bindung, Verlag Chemie, Weinheim, 3. Auflage, 1973, p. 443.
- ^ K. J. Tauer and W. N. Lipscomb: On the crystal structures, residual entropy and dielectric anomaly of methanol, In: Acta Crystallographica 1952, 5, p. 606–612, doi:10.1107/S0365110X52001696.
- ^ Beral, p.274
- ^ S. Hauptmann: Reaktion und Mechanismus in der Organischen Chemie. Verlag Teubner, p. 61
- ^ en Properties of Methanol.
- ^ http://www.akademos.asm.md/files/Academos%204%202008%2027%20IMPORTAN%C5%A2A%20STUDIILOR%20UVOLOGICE%20%C3%8EN%20OMOLOGAREA%20SOIURILOR%20DE%20VI%C5%A2%C4%82%20DE%20VIE.pdf
- ^ The Organometallic HyperTextBook: The Monsanto Acetic Acid Process
- ^ William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441. Article Online Posting Date: 15 iunie 2000
Bibliografie
[modificare | modificare sursă]- Edith Beral, Mihai Zapan, Chimie organică, Editura Tehnică, București, 1973
| ||||||||||||||||||||







