Boala virală Ebola
| Boala virală Ebola | |
 Fotografie din 1976 ce prezintă două asistente stând în fața lui Mayinga N., o persoană cu boala virală Ebola care a murit câteva zile mai târziu din cauza unei hemoragii interne severe. | |
| Specialitate | boli infecțioase |
|---|---|
| Simptome | greață vomă cefalee diaree febră erupție dispnee dureri articulare[*] conjunctivită hemoragie Epistaxis internal bleeding[*] mialgie durere abdominală otrăvire[*] |
| Cauze | Ebolavirus virusul Ebola[*][1] |
| Metodă de diagnostic | examinare clinică[*] Hemogramă ELISA viral culture[*] reacție de polimerizare în lanț microscop electronic Imunofluorescență |
| Clasificare și resurse externe | |
| ICD-9 | 065.8 |
| ICD-10 | A98.4 |
| ICD-11 | |
| DiseasesDB | 18043 |
| MedlinePlus | 001339 |
| eMedicine | med/626 |
| MeSH ID | D019142 |
| Modifică date / text | |

Focare în 1976
Focare în 1977- 2012
Focare în 2014
Boala virală Ebola sau febra hemoragică Ebola este o boală infecțioasă virală severă, adesea fatală, provocată de virusul Ebola (Ebolavirus), care se manifestă prin hemoragii severe la oameni, primate și antilopele duiker, cu focare epidemice în Africa Centrală și Africa de Vest și cu o rată de letalitate la om de până la 90% (cea mai mare mortalitate la o boală infecțioasă, cu excepția rabiei). Se presupune că liliecii frugivori din familia Pteropodidae sunt gazdele naturale ale virusului Ebola. Infecția se peoduce la oameni după un contact strâns cu sângele, secrețiile, organele sau fluidele biologice ale animalelor infectate: cimpanzei, gorile, lilieci frugivori, antilope de pădure duiker și porci spinoși și prin transmitere interumană, ca urmare a contactului direct (piele lezată sau mucoase) cu sângele, organele, secrețiile sau lichidele biologice (urina, saliva etc.) ale persoanelor infectate sau prin contact indirect prin intermediul mediilor contaminate cu aceste lichide. Ritualurile funerare în care rudele și prietenii celor decedați se află în contact direct cu corpul decedatului pot juca, de asemenea, un rol în transmiterea virusului. Sperma poate continua transmiterea virusului până la șapte săptămâni după însănătoșirea clinică.[2][3]
Virusul Ebola a fost identificat pentru prima dată în 1976, în două focare simultane: în Nzara (Sudan) și Yambuku (Republica Democrată Congo). Yambuku este situat în apropiere de râul Ebola, de unde vine numele bolii.[2]
Perioada de incubație este în medie de 8 zile, cu extreme de 2-21 de zile. Debutul bolii este brusc, cu febră înaltă, frison, cefalee, mialgii, anorexie, asociată cu erupții cutanate (exantem). În următoarele 2-3 zile se adaugă greață, vome, diaree, faringită și fenomene hemoragice: hematemeză, melenă, echimoze și peteșii. Sunt afectate funcțiile renale și hepatice. Apar și tulburări nervoase, prostrație, anxietate, confuzie, pierderi de memorie, instabilitate. Moartea poate surveni la 6-9 zile de la debut, prin șoc hipovolemic și hemoragii extinse generalizate.[4][5] Rata de letalitate este estimată a fi între 50-90%, cu mici diferențe în funcție de speciile de virus Ebola.[6]
În epidemia de febră hemoragică Ebola din Africa din 2014, până la data de 1 februarie 2015 s-au înregistrat 22.495 cazuri de îmbolnăviri, din care 8.981 au fost decese.[7]
Pe 30 septembrie 2014 a fost diagnosticat primul caz de infectare cu virusul Ebola în Statele Unite, pacientul fiind spitalizat în Texas. Bolnavul era un bărbat, care a călătorit în Liberia.[8] Fără intervenții suplimentare sau modificări ale comportamentului comunităților băștinașe, Center for Disease Control and Prevention - USA estimează că până la 20 ianuarie 2015, va exista un total de aproximativ 550.000 de cazuri de febră hemoragică Ebola în Liberia și Sierra Leone sau 1,4 milioane de cazuri dacă se fac corecții pentru subraportarea cazurilor.[9][10]
Rehidratarea suportivă pe cale orală sau intravenoasă și tratamentul simptomatic specific cresc ratele de supraviețuire. Nu există încă nici un tratament specific disponibil împotriva febrei hemoragice Ebola. Cu toate acestea, o serie de tratamente potențiale, inclusiv produse din sânge (seroterapia cu IgG anti-EBOV), terapii imunitare (ZMapp, Zmab) și tratamente medicamentoasă (oligonucleotide morfolino-fosforodiamidate, ARN interferenți mici, analogi nucleotidici/nucleozidici etc.) sunt în curs de evaluare. Până în prezent, nu există încă un vaccin omologat disponibil, dar se evaluează în prezent inocuitatea a două vaccinuri potențiale (ChAd3-ZEBOV și rVSV-ZEBOV) la om.[2]
Istoric[modificare | modificare sursă]

Virusul Ebola a fost identificat pentru prima dată în 1976, în două epidemii concomitente, una în Zair (Republica Democrată Congo), cauzată de specia Zair a virusului Ebola, și alta în Sudan, cauzată de specia Sudan. Epidemia din Sudan a atins în principal orașele Nzara și Maridi, în apropiere de granița cu Republica Democrată Congo, și a provocat 284 de cazuri de îmbolnăviri cu o rată a mortalității de 53%.[11] Epicentrul epidemiei din Zair (Republica Democrată Congo) a fost situat în orașul Yambuku, situat în apropiere de râul Ebola, care a dat numele noului virus. Această epidemie, cu un grad de mortalitate mai mare decât cea din Sudan, a provocat decesul a 284 de persoane dintr-un total de 318 de bolnavi identificați. Rata de mortalitate de 89%, asociată cu specia Zair, denotă o patogenicitate mai mare față de cea a speciei Sudan.[12]
După un caz izolat survenit în 1977 în satul Tandala din Zair, o nouă epidemie cu specia Sudan a fost localizată în orașul Nzara, în 1979, cu 34 de cazuri de îmbolnăviri și 22 decese.[13][14]
După o perioadă silențioasă de cincisprezece ani, în care nu a fost notificat niciun caz, virusul Ebola a reapărut aproape simultan în trei țări. Mai întâi în iunie 1994, când un etolog elvețian s-a contaminat făcând o autopsie unui cimpanzeu infectat, găsit mort în pădurea Taï din Coasta de Fildeș. Determinarea genomică a virusului la pacient și la animal a permis identificarea unei noi specii de virus, specia pădurii Taï (specia Coastei de Fildeș). Acest pacient este singurul caz cunoscut de infecție cu specia pădurii Taï.[15]
O mare epidemie cu specia Zair s-a propagat în orașul Kikwit și regiunea înconjurătoare în 1995, din sud-vestul Republicii Democratice Congo. Această epidemie, care a provocat decesul a 256 de oameni dintr-un total de 315 de bolnavi (mortalitate 81%), a afectat în principal personalul spitalicesc (transmisie nozocomială).[16]
Alte trei epidemii cu specia Zair au afectat în mod succesiv nord-estul Gabonului , între 1994 și 1997. Cea din 1994 a avut loc într-o tabără de mineri din minele de aur din Mekouka,[17] a doua în 1996 în satul Mayibout, în care cele mai multe victime au fost copiii care au transportat și tăiat un cimpanzeu găsit mort,[17] iar a treia între 1996 și 1997, un pic mai la sud, în regiunea Booué.[17] Această ultimă epidemie, care a provocat 60 de cazuri de îmbolnăviri cu 45 de decese, a produs un focar secundar cu 15 cazuri de îmbolnăviri, din care 11 decese în capitala Libreville, și un caz în Africa de Sud, la o asistentă contaminată de un pacient gabonez provenit din Libreville.[18]
Perioada 2000-2008 a fost marcată de epidemii care au avut loc în mai multe țări din Africa Centrală. Mai întâi, cinci epidemii cu specia Zair au afectat regiunea de frontieră dintre nord-estul Gabonului și nord-vestul Republicii Congo. Prima, responsabilă de 143 de cazuri de îmbolnăviri, din care 128 decese, s-a extins din Gabon la Republica Congo, de-a lungul drumului care leagă Mekambo și Mbomo. Această epidemie a fost de fapt subdivizată în mai multe lanțuri epidemice independente, fiecare având originea în surse de diferite animale, care erau cadavrele infectate de gorile, cimpanzei și antilope.[19]
Apoi, Republica Congo a fost atinsă de trei ori de epidemia cu specia Zair între 2003 și 2005: regiunea Mbomo și Kelle la începutul anului 2003 (143 de îmbolnăviri din care 128 de decese),[20] din nou regiunea Mbomo la sfârșitul anului 2003 (35 de cazuri de îmbolnăviri, din care 29 de decese),[21] apoi Etoumbi (11 cazuri de îmbolnăviri, cu 9 decese).
Simultan, specia Sudan a fost responsabilă de două epidemii, una mai mare în Uganda, în 2000, când au fost înregistrate 425 de cazuri de îmbolnăviri, din care 173 mortale,[22] și o alta înregistrată în Yambio din Sudan în 2004, aproape de Nzara, cu 17 cazuri de îmbolnăviri din care 7 decese.[23]
În anul 2007, o nouă specie de virus Ebola, specia Bundibugyo, a fost identificată și caracterizată în Uganda în timpul unei epidemii care a cauzat moartea a 30 de persoane din 116 cazuri de îmbolnăviri, cu o rată de mortalitate de 26%.[24]
Cea mai mare epidemie de febră hemoragică Ebola determinată de virusul Zair (tulpina Makon [25]), care este în curs de desfășurare, a izbucnit la începutul lunii februarie 2014 în Guineea și nordul Liberiei și s-a extins în Sierra Leone și Nigeria, fiind înregistrate 22495 cazuri de îmbolnăviri până la 1 februarie 2015, din care 8981 decese.[7]
Pe lângă aceste patru specii care circulă în Africa și care, la diferite nivele, sunt toate patogene pentru om, o altă specie de virus Ebola, specia Reston, nepatogenă pentru oameni, a fost identificată în 1989 la maimuțele macac (Macaca fascicularis) provenite din Filipine. Aceste maimuțe au dezvoltat o boală mortală de tip hemoragic în timpul aflării lor în carantină într-un laborator din orașul Reston (Virginia, Statele Unite ale Americii).[26][27] Același virus a fost găsit în 1996 și la alte maimuțe macac bolnave în laboratoarele situate în Austin (Texas, Statele Unite ale Americii), Siena (Italia) și Filipine.[28] Cu toate că niciun caz clinic la om nu a fost înregistrat, mai mulți îngrijitori de animale au dezvoltat anticorpi IgG specifici pentru specia Reston. Specia Reston a fost din nou identificată în 2009 în Filipine în timpul unei epidemii de sindrom respirator care a afectat porcii domestici din mai multe ferme.[29][30]
Cronologia epidemiei de febră hemoragică Ebola[modificare | modificare sursă]
| Anul | Țara | Specia de virus Ebola | Numărul raportat de cazuri umane | Numărul raportat de decese în rândul cazurilor | Mortalitate (%) | Observații |
|---|---|---|---|---|---|---|
| 1976 | Zair (Republica Democrată Congo) | Ebolavirusul Zair | 318 | 280 | 88% | Epidemie în Yambuku și zona înconjurătoare. Boala a fost răspândită prin contact personal apropiat și prin utilizarea de ace și seringi contaminate în spitale sau clinici. Acestă epidemie a fost primul caz a febrei hemoragice Ebola.[12] |
| 1976 | Sudan (Sudanul de Sud) | Ebolavirusul Sudan | 284 | 151 | 53% | Epidemie în Nzara, Maridi și zona înconjurătoare. Boala a fost răspândită în principal prin contact personal apropiat în spitale. Majoritatea personalului medical a fost infectat.[11] |
| 1976 | Marea Britanie | Ebolavirusul Sudan | 1 | 0 | 0 | Infecție de laborator prin înțepătură accidentală cu un ac contaminat.[31] |
| 1977 | Zair | Ebolavirusul Zair | 1 | 1 | 100% | Confirmare retrospectivă a unui caz în satul Tandala.[13] |
| 1979 | Sudan (Sudanul de Sud) | Ebolavirusul Sudan | 34 | 22 | 65% | Focar în Nzara, Maridi. A fost un focar recurent în același loc ca și în 1976 a epidemiei din Sudan.[14] |
| 1989 | SUA | Ebolavirusul Reston | 0 | 0 | 0 | Virusul Ebola Reston a fost identificat la maimuțele importate din Filipine și au fost luate măsuri de carantină a lor în Virginia și Pennsylvania.[32] |
| 1990 | SUA | Ebolavirusul Reston | 4 (asimptomatic) | 0 | 0 | Virusul Ebola Reston a fost identificat din nou la maimuțele importate din Filipine și au fost luate măsuri de carantină în Virginia și Texas. La 4 oameni au apărut anticorpi, dar ei nu s-au îmbolnăvit.[33] |
| 1989-1990 | Filipine | Ebolavirusul Reston | 3 (asimptomatic) | 0 | 0 | Mortalitate ridicată în rândul macacilor cynomolgus în unitățile de export a primatelor pentru SUA.[26] La 3 muncitori din aceste unități au apărut anticorpi, dar ei nu s-au îmbolnăvit.[27] |
| 1992 | Italia | Ebolavirusul Reston | 0 | 0 | 0 | Virusul Ebola Reston a fost identificat în Sienna la maimuțele importate din aceleași unități de export din Filipine, care au fost implicate în episoadele din Statele Unite și a fost instituită carantina . Oamenii nu s-au infectat.[34] |
| 1994 | Gabon | Ebolavirusul Zair | 52 | 31 | 60% | Focar în Mékouka și alte locuri de extracție de aur aflate în mijlocul pădurilor tropicale. Inițial a fost considerată că este febra galbenă; dar în 1995 a fost identificată ca fiind febra hemoragică Ebola.[17] |
| 1994 | Coasta de Fildeș | Ebolavirusul pădurii Taï | 1 | 0 | 0 | Un om de știință s-a îmbolnăvit după efectuarea autopsiei unui cimpanzeu sălbatic în pădurea Taï. Pacientul a fost tratat în Elveția.[15] |
| 1995 | Republica Democratică Congo (fostul Zair) | Ebolavirusul Zair | 315 | 250 | 81% | Epidemie în Kikwit și zona înconjurătoare. Sursa a fost un pacient care a lucrat în pădurea învecinată orașului. Epidemia s-a răspândit în familii și spitale.[16] |
| 1996 (ianuarie-aprilie) | Gabon | Ebolavirusul Zair | 37 | 21 | 57% | Focar în zona Mayibout. Un cimpanzeu găsit mort în pădure a fost mâncat de oameni care vânau animale. 19 persoane care au fost implicate în măcelăritul animalului s-au îmbolnăvit; alte cazuri au avut loc la membrii familiilor.[17] |
| 1996-1997 (iulie-ianuarie) | Gabon | Ebolavirusul Zair | 60 | 45 | 74% | Focar în zona Booué, pacienții au fost transportați în Libreville. Primului caz a fost un vânător care a trăit într-o tabără de pădure. Boala s-a răspândit prin contactul apropiat cu persoanele infectate. Un cimpanzeu mort a fost găsit în pădure și a fost stabilit că era infectat.[17] |
| 1996 | Africa de Sud | Ebolavirusul Zair | 2 | 1 | 50% | Un profesionist medical a călătorit din Gabon în Johannesburg, Africa de Sud, după ce a tratat pacienți infectați cu virusul Ebola și, astfel, a fost expus la virus. El a fost internat într-un spital, iar o asistenta medicală care a avut grijă de el s-a infectat și a murit.[18] |
| 1996 | SUA | Ebolavirusul Reston | 0 | 0 | 0 | Virusul Ebola Reston a fost introdus într-o unitate de carantină din Texas de maimuțele importate din Filipine. Nu au fost identificate infecții umane.[28] |
| 1996 | Filipine | Ebolavirusul Reston | 0 | 0 | 0 | Virusul Ebola Reston a fost identificat într-o unitate de export a maimuțelor în Filipine. Nu au fost identificate infecții umane.[35] |
| 1996 | Rusia | Ebolavirusul Zair | 1 | 1 | 100% | Contaminare de laborator [36] |
| 2000-2001 | Uganda | Ebolavirusul Sudan | 425 | 224 | 53% | O epidemie a avut loc în districtele Gulu, Masindi și Mbarara din Uganda. Cele mai importante trei riscuri asociate cu transmiterea infecției cu virusul Ebola au fost participarea la ritualurile funerare a pacienților decedați atinși de febra hemoragică Ebola, contactul cu familiile infectate și furnizarea de asistență medicală a pacienților infectați cu virusul Ebola fără utilizarea metodelor adecvate de protecție individuală.[22] |
| Octombrie 2001-Martie 2002 | Gabon | Ebolavirusul Zair | 65 | 53 | 82% | Un focar la frontiera dintre Gabon și Republica Congo.[19] |
| Octombrie 2001-Martie 2002 | Republica Congo | Ebolavirusul Zair | 57 | 43 | 75% | Focar la frontiera dintre Gabon și Republica Congo. Aceasta a fost prima dată când febra hemoragică Ebola a fost raportată în Republica Congo.[19] |
| Decembrie 2002-Aprilie 2003 | Republica Congo | Ebolavirusul Zair | 143 | 128 | 89% | Epidemia în districtele Mbomo și Kéllé din departamentul Cuvette Ouest.[20] |
| Noiembrie-Decembrie 2003 | Republica Congo | Ebolavirusul Zair | 35 | 29 | 83% | Focar în satele Mbomo și Mbandza situate în districtul Mbomo, din departamentul Cuvette Ouest.[21] |
| 2004 | Sudan (Sudanul de Sud) | Ebolavirusul Sudan | 17 | 7 | 41% | Focar în districtul Yambio din sudul Sudanului. Acest focar a fost concomitent cu o epidemie de rujeolă în aceeași zonă și mai multe cazuri suspecte de febra hemoragică Ebola au fost ulterior reclasificate ca cazuri de rujeolă.[23] |
| 2004 | Rusia | Ebolavirusul Zair | 1 | 1 | 100% | Contaminare de laborator.[37] |
| 2007 | Republica Democrată Congo | Ebolavirusul Zair | 264 | 187 | 71% | Epidemia în provincia Kasaï-Occidental. Epidemia a fost declarată după 20 noiembrie. Ultimul caz confirmat a fost pe 4 octombrie și ultimul deces pe 10 octombrie.[38][39] |
| Decembrie 2007 - Ianuarie 2008 | Uganda | Ebolavirusul Bundibugyo | 149 | 37 | 25% | Epidemia în districtul Bundibugyo din vestul Ugandei. Prima apariție raportată a unei specii noi, Bundibugyo.[24] |
| Noiembrie 2008 | Filipine | Ebolavirusul Reston | 6 (asimptomatic) | 0 | 0 | Prima apariție cunoscută a virusului Ebola Reston la porci. Tulpina era foarte asemănătoare cu tulpinile anterioare. Șase muncitori de la ferma de porci și de la abator au dezvoltat anticorpi, dar nu s-au îmbolnăvit.[29][30] |
| Decembrie 2008-Februarie 2009 | Republica Democrată Congo | Ebolavirusul Zair | 32 | 15 | 47% | Focar în zonele de sănătate Mweka și Luebo din provincia Kasai-Occidental .[40] |
| Mai 2011 | Uganda | Ebolavirusul Sudan | 1 | 1 | 100% | Ministerul Ugandez al Sănătății a informat publicul că un pacient cu suspiciune de febră hemoragică Ebola a decedat pe 6 mai 2011, în districtul Luwero, Uganda.[41] |
| Iunie-Octombrie 2012 | Uganda | Ebolavirusul Sudan | 11 | 4 | 36.4% | Un focar în districtul Kibaale din Uganda.[42] |
| Iunie-Noiembrie 2012 | Republica Democrată Congo | Ebolavirusul Bundibugyo | 36 | 13 | 36.1% | Focar în provincia Orientale, Republica Democrată Congo. Focarul din Republica Democrată Congo nu a avut nici o legătură epidemiologică cu focarul de Ebola din 2012 din districtul Kibaale din Uganda.[42] |
| Noiembrie 2012-Ianuarie 2013 | Uganda | Ebolavirusul Sudan | 6 | 3 | 50% | Focar în districtul Luwero.[42] |
| Martie 2014-Prezent (Epidemia de Ebola din Africa de Vest, 2014-2015) |
Guinea, Liberia, Sierra Leone, Nigeria, Mali, Senegal, SUA, Spania, Marea Britanie | Tulpina Makona a ebolavirusului Zair (EBOV/Mak) | 22495 (1 febr. 2015) | 8981 (1 febr. 2015) | 40% | O epidemie în curs de desfășurare a izbucnit în Guineea și nordul Liberiei, și s-a extins în Sierra Leone și Nigeria. Numărul de pacienți este în continuă evaluare ca urmare a anchetei în curs.[7][25][43] |
| Iulie 2014 - Octombrie 2014 | Republica Democrată Congo | Ebolavirusul Zair | 66 | 49 | 74% | O epidemie circumscrisă de Ebola, fără legătură cu cea din Africa de Vest, a izbucnit în august 2014 în Districtul Boende, o regiune izolată a provinciei Equateur din Republica Democrată Congo. Această epidemie a debutat pe 26 iulie 2014, când o femeie s-a îmbolnăvit la câteva zile după ce a tranșat o maimuță găsită moartă în pădure. Datorită măsurilor de protecție puse în aplicare de către autoritățile de sănătate congoleze - izolarea pacienților, protecția personalului medical, sensibilizarea populației pentru a evita orice contact corporal - epidemia a fost stăvilită. Această epidemie a fost provocată de o tulpină locală a ebolavirusului Zair, diferită de cea care bântuie în vestul continentului african.[44][45][46][47] |
Epidemia de Ebola din Africa de Vest, 2014-2015[modificare | modificare sursă]
Epidemia actuală de Ebola din Africa de Vest (primele cazuri au fost notificate în martie 2014) este cea mai importantă și cea mai complexă de la descoperirea virusului în 1976. Ea a cauzat mai multe cazuri de îmbolnăviri și decese decât toate epidemiile precedente însumate. Această epidemie s-a extins de la o țară la alta, izbucnind inițial în Guineea, apoi răspândindu-se în Sierra Leone și Liberia (traversând frontierele terestre), Nigeria (printr-o persoană care călătorea cu avionul) și Senegal (prin intermediul unui călător sosit pe uscat). Țările cele mai afectate (Guineea, Sierra Leone și Liberia) au sisteme de sănătate foarte fragile, nu dispun de resurse umane și infrastructuri și au ieșit cu greu din lungile perioade de conflicte și instabilitate. La 8 august 2014, directorul general al OMS a declarat că această epidemie constituie o urgență de sănătate publică de interes internațional.[2] OMS a anunțat încheierea epidemiei de Ebola în Liberia pe 9 mai 2015. OMS a declarat oficial că epidemia de Ebola în Sierra Leone s-a încheiat pe 7 noiembrie 2015 și că țara va mai fi monitorizată 90 de zile. În Sierra Leone s-au înregistrat circa 14000 de cazuri de Ebola, aproape jumătate din cazurile din Africa occidentală și au decedat 3955 de persoane.[48]
Un focar separat de Ebola, fără legătură cu cel din Africa de Vest, a izbucnit în august 2014 în Districtul Boende, o regiune izolată a provinciei Equateur din Republica Democrată Congo.[2]
| Data | Cazuri | Decese | Guineea (Cazuri / Decese) |
Liberia (Cazuri / Decese) |
Sierra Leone (Cazuri / Decese) |
Mali (Cazuri / Decese) |
Nigeria (Cazuri / Decese) |
Senegal (Cazuri / Decese) |
SUA (Cazuri / Decese) |
Spania (Cazuri / Decese) |
Marea Britanie (Cazuri / Decese) |
Italia (Cazuri / Decese) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 27 martie 2016[49] | 28 646 | 11 323 | 3 811 / 2 543 | 10 675 / 4 809 | 14 124 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 13 martie 2016[50] | 28 639 | 11 316 | 3 804 / 2 536 | 10 675 / 4 809 | 14 124 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 28 februarie 2016[51] | 28 639 | 11 316 | 3 804 / 2 536 | 10 675 / 4 809 | 14 124 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 14 februarie 2016[52] | 28 639 | 11 316 | 3 804 / 2 536 | 10 675 / 4 809 | 14 124 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 31 ianuarie 2016[53] | 28 639 | 11 316 | 3 804 / 2 536 | 10 675 / 4 809 | 14 124 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 17 ianuarie 2016[54] | 28 638 | 11 316 | 3 804 / 2 536 | 10 675 / 4 809 | 14 123 / 3 956 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 3 ianuarie 2016[55] | 28 637 | 11 315 | 3 804 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 27 dec. 2015[56] | 28 637 | 11 315 | 3 804 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 20 dec. 2015[57] | 28 637 | 11 315 | 3 804 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 13 dec. 2015[58] | 28 640 | 11 315 | 3 807 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 6 dec. 2015[59] | 28 637 | 11 315 | 3 804 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 29 noiembr. 2015[60] | 28 637 | 11 315 | 3 804 / 2 536 | 10 675 / 4 809 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 22 noiembr. 2015[61] | 28 637 | 11 314 | 3 804 / 2 536 | 10 675 / 4 808 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 15 noiembr. 2015[62] | 28 634 | 11 314 | 3 804 / 2 536 | 10 672 / 4 808 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 8 noiembr. 2015[63] | 28 635 | 11 314 | 3 805 / 2 536 | 10 672 / 4 808 | 14 122 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 1 noiembr. 2015[64] | 28 607 | 11 314 | 3 810 / 2 536 | 10 672 / 4 808 | 14 089 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 25 octombr. 2015[65] | 28 575 | 11 313 | 3 806 / 2 535 | 10 672 / 4 808 | 14 061 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 18 octombr. 2015[66] | 28 512 | 11 313 | 3 803 / 2 535 | 10 672 / 4 808 | 14 001 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 11 octombr. 2015[67] | 28 490 | 11 312 | 3 800 / 2 534 | 10 672 / 4 808 | 13 982 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 4 octombr. 2015[68] | 28 457 | 11 312 | 3 804 / 2 534 | 10 672 / 4 808 | 13 945 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 27 sept. 2015[69] | 28 424 | 11 311 | 3 805 / 2 533 | 10 672 / 4 808 | 13 911 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 20 sept. 2015[70] | 28 331 | 11 310 | 3 800 / 2 532 | 10 672 / 4 808 | 13 823 / 3 955 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 13 sept. 2015[71] | 28 256 | 11 306 | 3 792 / 2 530 | 10 672 / 4 808 | 13 756 / 3 953 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 6 sept. 2015[72] | 28 183 | 11 306 | 3 792 / 2 530 | 10 672 / 4 808 | 13 683 / 3 953 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 30 august 2015[73] | 28 109 | 11 305 | 3 792 / 2 529 | 10 672 / 4 808 | 13 609 / 3 953 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 23 august 2015[74] | 28 041 | 11 302 | 3 792 / 2 527 | 10 672 / 4 808 | 13 541 / 3 952 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 16 august 2015[75] | 27 988 | 11 299 | 3 786 / 2 524 | 10 672 / 4 808 | 13 494 / 3 952 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 9 august 2015[76] | 27 965 | 11 298 | 3 787 / 2 524 | 10 672 / 4 808 | 13 470 / 3 951 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 2 august 2015[77] | 27 898 | 11 296 | 3 784 / 2 522 | 10 672 / 4 808 | 13 406 / 3 951 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 26 iulie 2015[78] | 27 784 | 11 294 | 3 786 / 2 520 | 10 672 / 4 808 | 13 290 / 3 951 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 19 iulie 2015[79] | 27 741 | 11 284 | 3 783 / 2 512 | 10 672 / 4 808 | 13 250 / 3 949 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 12 iulie 2015[80] | 27 678 | 11 276 | 3 760 / 2 506 | 10 673 / 4 808 | 13 209 / 3 947 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 5 iulie 2015[81] | 27 609 | 11 261 | 3 748 / 2 499 | 10 670 / 4 807 | 13 155 / 3 940 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 28 iunie 2015[82] | 27 550 | 11 235 | 3 729 / 2 482 | 10 666 / 4 806 | 13 119 / 3 932 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 21 iunie 2015[83] | 27 479 | 11 222 | 3 718 / 2 473 | 10 666 / 4 806 | 13 059 / 3 928 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 14 iunie 2015[84] | 27 341 | 11 184 | 3 674 / 2 444 | 10 666 / 4 806 | 12 965 / 3 919 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 7 iunie 2015[85] | 27 273 | 11 173 | 3 670 / 2 437 | 10 666 / 4 806 | 12 901 / 3 915 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 31 mai 2015[86] | 27 181 | 11 162 | 3 652 / 2 429 | 10 666 / 4 806 | 12 827 / 3 912 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 24 mai 2015[87] | 27 049 | 11 149 | 3 641 / 2 420 | 10 666 / 4 806 | 12 706 / 3 908 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 17 mai 2015[88] | 26 969 | 11 135 | 3 635 / 2 407 | 10 666 / 4 806 | 12 632 / 3 907 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | 1 / 0 |
| 10 mai 2015[89] | 26 759 | 11 080 | 3 597 / 2 392 | 10 604 / 4 769 | 12 523 / 3 904 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 3 mai 2015[90] | 26 628 | 11 020 | 3 589 / 2 386 | 10 564 / 4 716 | 12 440 / 3 903 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 26 aprilie 2015[91] | 26 312 | 10 899 | 3 584 / 2 377 | 10 322 / 4 608 | 12 371 / 3 899 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 19 aprilie 2015[92] | 26 079 | 10 823 | 3 565 / 2 358 | 10 212 / 4 573 | 12 267 / 3 877 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 12 aprilie 2015[93] | 25 826 | 10 704 | 3 548 / 2 346 | 10 042 / 4 486 | 12 201 / 3 857 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 5 aprilie 2015[94] | 25 550 | 10 587 | 3 515 / 2 333 | 9 862 / 4 408 | 12 138 / 3 831 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 29 martie 2015[95] | 25 213 | 10 460 | 3 492 / 2 314 | 9 712 / 4 332 | 11 974 / 3 799 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 22 martie 2015[96] | 24 907 | 10 326 | 3 429 / 2 263 | 9 602 / 4 301 | 11 841 / 3 747 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 15 martie 2015[97] | 24 701 | 10 194 | 3 389 / 2 224 | 9 526 / 4 264 | 11 751 / 3 691 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 8 martie 2015[98] | 24 282 | 9 976 | 3 285 / 2 170 | 9 343 / 4 162 | 11 619 / 3 629 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 1 martie 2015[99] | 23 969 | 9 807 | 3 219 / 2 129 | 9 249 / 4 117 | 11 466 / 3 546 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 22 februarie 2015[100] | 23 729 | 9 604 | 3 155 / 2 091 | 9 238 / 4 037 | 11 301 / 3 461 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 15 februarie 2015[101] | 23 253 | 9 380 | 3 108 / 2 057 | 9 007 / 3 900 | 11 103 / 3 408 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 8 februarie 2015[102] | 22 894 | 9 177 | 3 044 / 1 995 | 8 881 / 3 826 | 10 934 / 3 341 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 1 februarie 2015[7] | 22 495 | 8 981 | 2 975 / 1 944 | 8 745 / 3 746 | 10 740 / 3 276 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 25 ianuarie 2015[103] | 22 092 | 8 810 | 2 917 / 1 910 | 8 622 / 3 686 | 10 518 / 3 199 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 18 ianuarie 2015[104] | 21 724 | 8 641 | 2 871 / 1 876 | 8 478 / 3 605 | 10 340 / 3 145 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 11 ianuarie 2015[105] | 21 296 | 8 429 | 2 806 / 1 814 | 8 331 / 3 538 | 10 124 / 3 062 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 4 ianuarie 2015[106] | 20 747 | 8 235 | 2 775 / 1 781 | 8 157 / 3 496 | 9 780 / 2 943 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 28 dec. 2014[107] | 20 206 | 7 905 | 2 707 / 1 708 | 8 018 / 3 423 | 9 446 / 2 758 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | 1 / 0 | - |
| 21 dec. 2014[108] | 19 497 | 7 588 | 2 597 / 1 607 | 7 862 / 3 384 | 9 004 / 2 582 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 14 dec. 2014[109] | 18 603 | 6 915 | 2 416 / 1 525 | 7 797 / 3 290 | 8 356 / 2 085 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 7 dec. 2014[110] | 17 942 | 6 388 | 2 292 / 1 428 | 7 719 / 3 177 | 7 897 / 1 768 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 30 noiembr. 2014[111] | 17 145 | 6 070 | 2 164 / 1 327 | 7 635 / 3 145 | 7 312 / 1 583 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 23 noiembr. 2014[112] | 15 935 | 5 689 | 2 134 / 1 260 | 7 168 / 3 016 | 6 599 / 1 398 | 8 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 18 noiembr. 2014[113] | 15 351 | 5 459 | 2 047 / 1 214 | 7 082 / 2 963 | 6 190 / 1 267 | 6 / 6 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 16 noiembr. 2014[114] | 15 145 | 5 420 | 1 971 / 1 192 | 7 069 / 2 964 | 6 073 / 1 250 | 6 / 5 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 11 noiembr. 2014[44] | 14 413 | 5 177 | 1 919 / 1 166 | 6 878 / 2 812 | 5 586 / 1 187 | 4 / 3 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 9 noiembr. 2014[115] | 14 098 | 5 160 | 1 878 / 1 142 | 6 822 / 2 836 | 5 368 / 1 169 | 4 / 4 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 4 noiembr. 2014[116] | 13 268 | 4 960 | 1 760 / 1 054 | 6 619 / 2 766 | 4 862 / 1 130 | 1 / 1 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 2 noiembr. 2014[117] | 13 042 | 4 818 | 1 731 / 1 041 | 6 525 / 2 697 | 4 759 / 1 070 | 1 / 1 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 29 octombr. 2014[118] | 13 567 | 4 951 | 1 667 / 1 018 | 6 535 / 2 413 | 5 338 / 1 510 | 1 / 1 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 27 octombr. 2014[119] | 13 703 | 4 922 | 1 906 / 997 | 6 535 / 2 413 | 5 235 / 1 500 | 1 / 1 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 24 octombr. 2014[120] | 10 141 | 4 922 | 1 553 / 926 | 4 665 / 2 705 | 3 896 / 1 281 | 1 / 1 | 20 / 8 | 1 / 0 | 4 / 1 | 1 / 0 | - | - |
| 19 octombr. 2014[121] | 9 936 | 4 877 | 1 540 / 904 | 4 665 / 2 705 | 3 706 / 1 259 | - | 20 / 8 | 1 / 0 | 3 / 1 | 1 / 0 | - | - |
| 14 octombr. 2014[122] | 9 216 | 4 555 | 1 519 / 862 | 4 262 / 2 484 | 3 410 / 1 200 | - | 20 / 8 | 1 / 0 | 3 / 1 | 1 / 0 | - | - |
| 12 octombr. 2014[123] | 8 997 | 4 493 | 1 472 / 843 | 4 249 / 2 458 | 3 252 / 1 183 | - | 20 / 8 | 1 / 0 | 2 / 1 | 1 / 0 | - | - |
| 8 octombr. 2014[124] | 8 399 | 4 033 | 1 350 / 778 | 4 076 / 2 316 | 2 950 / 930 | - | 20 / 8 | 1 / 0 | 1 / 1 | 1 / 0 | - | - |
| 5 octombr. 2014[125] | 8 033 | 3 879 | 1 298 / 768 | 3 924 / 2 210 | 2 789 / 879 | - | 20 / 8 | 1 / 0 | 1 / 0 | - | - | - |
| 1 octombr. 2014[126] | 7 492 | 3 439 | 1 199 / 739 | 3 834 / 2 069 | 2 437 / 623 | - | 20 / 8 | 1 / 0 | 1 / 0 | - | - | - |
| 28 sept. 2014[127] | 7 178 | 3 338 | 1 157 / 710 | 3 696 / 1 998 | 2 304 / 622 | - | 20 / 8 | 1 / 0 | 1 / 0 | - | - | - |
| 23 sept. 2014[128] | 6 574 | 3 091 | 1 074 / 648 | 3 458 / 1 830 | 2 021 / 605 | - | 20 / 8 | 1 / 0 | - | - | - | - |
| 20 sept. 2014[129] | 5 843 | 2 803 | 1 008 / 632 | 3 022 / 1 578 | 1 813 / 593 | - | 20 / 8 | 1 / 0 | - | - | - | - |
| 14 sept. 2014[130] | 5 335 | 2 622 | 942 / 601 | 2 701 / 1 459 | 1 673 / 562 | - | 21 / 8 | 1 / 0 | - | - | - | - |
| 13 sept. 2014[131] | 4 985 | 2 461 | 936 / 595 | 2 407 / 1 296 | 1 620 / 562 | - | 21 / 8 | 1 / 0 | - | - | - | - |
| 10 sept. 2014[132] | 4 806 | 2 408 | 899 / 568 | 2 407 / 1 296 | 1 478 / 536 | - | 21 / 8 | 1 / 0 | - | - | - | - |
| 6 sept. 2014 | 4 293 | 2 296 | 862 / 555 | 2 046 / 1 224 | 1 361 / 509 | - | 21 / 8 | 1 / 0 | - | - | - | - |
| 5 sept. 2014 | 3 967 | 2 105 | 812 / 517 | 1 871 / 1 089 | 1 261 / 491 | - | 22 / 8 | 1 / 0 | - | - | - | - |
| 31 august 2014 | 3 707 | 1 848 | 771 / 494 | 1 698 / 871 | 1 216 / 476 | - | 21 / 7 | 1 / 0 | - | - | - | - |
| 26 august 2014 | 3 069 | 1 552 | 648 / 430 | 1 378 / 694 | 1 026 / 422 | - | 17 / 6 | 1 / 0 | - | - | - | - |
| 20 august 2014 | 2 615 | 1 427 | 607 / 406 | 1 082 / 624 | 910 / 392 | - | 16 / 5 | - | - | - | - | - |
| 18 august 2014 | 2 473 | 1 350 | 579 / 396 | 972 / 576 | 907 / 374 | - | 15 / 4 | - | - | - | - | - |
| 16 august 2014 | 2 240 | 1 229 | 543 / 394 | 834 / 466 | 848 / 365 | - | 15 / 4 | - | - | - | - | - |
| 13 august 2014 | 2 127 | 1 145 | 519 / 380 | 786 / 413 | 810 / 348 | - | 12 / 4 | - | - | - | - | - |
| 11 august 2014 | 1 975 | 1 069 | 510 / 377 | 670 / 355 | 783 / 334 | - | 12 / 3 | - | - | - | - | - |
| 9 august 2014 | 1 848 | 1 013 | 506 / 373 | 599 / 323 | 730 / 315 | - | 13 / 2 | - | - | - | - | - |
| 6 august 2014 | 1 779 | 961 | 495 / 367 | 554 / 294 | 717 / 298 | - | 13 / 2 | - | - | - | - | - |
| 4 august 2014 | 1 711 | 932 | 495 / 363 | 516 / 282 | 691 / 286 | - | 9 / 1 | - | - | - | - | - |
| 1 august 2014 | 1 603 | 887 | 485 / 358 | 468 / 255 | 656 / 273 | - | 4 / 1 | - | - | - | - | - |
| 30 iulie 2014 | 1 440 | 826 | 472 / 346 | 391 / 227 | 574 / 252 | - | 3 / 1 | - | - | - | - | - |
| 27 iulie 2014 | 1 323 | 729 | 460 / 339 | 329 / 156 | 533 / 233 | - | 1 / 1 | - | - | - | - | - |
| 23 iulie 2014 | 1 201 | 672 | 427 / 319 | 249 / 129 | 525 / 224 | - | - | - | - | - | - | - |
| 17 iulie 2014 | 1 048 | 632 | 410 / 310 | 196 / 116 | 442 / 206 | - | - | - | - | - | - | - |
| 12 iulie 2014 | 964 | 603 | 406 / 304 | 172 / 105 | 386 / 194 | - | - | - | - | - | - | - |
| 2 iulie 2014 | 759 | 467 | 413 / 303 | 107 / 65 | 239 / 99 | - | - | - | - | - | - | - |
| 24 iunie 2014 | 599 | 362 | 390 / 270 | 51 / 34 | 158 / 58 | - | - | - | - | - | - | - |
| 17 iunie 2014 | 528 | 337 | 398 / 264 | 33 / 24 | 97 / 49 | - | - | - | - | - | - | - |
| 10 iunie 2014 | 474 | 252 | 372 / 236 | 13 / 9 | 89 / 7 | - | - | - | - | - | - | - |
| 5 iunie 2014 | 438 | 231 | 344 / 215 | 13 / 9 | 81 / 7 | - | - | - | - | - | - | - |
| 2 iunie 2014 | 354 | 208 | 291 / 193 | 13 / 9 | 50 / 6 | - | - | - | - | - | - | - |
| 27 mai 2014 | 309 | 200 | 281 / 186 | 12 / 9 | 16 / 5 | - | - | - | - | - | - | - |
| 23 mai 2014 | 270 | 183 | 258 / 174 | 12 / 9 | - | - | - | - | - | - | - | - |
| 14 mai 2014 | 245 | 166 | 233 / 157 | 12 / 9 | - | - | - | - | - | - | - | - |
| 5 mai 2014 | 243 | 164 | 231 / 155 | 12 / 9 | - | - | - | - | - | - | - | - |
| 30 aprilie 2014 | 233 | 155 | 221 / 146 | 12 / 9 | - | - | - | - | - | - | - | - |
| 23 aprilie 2014 | 220 | 145 | 208 / 136 | 12 / 9 | - | - | - | - | - | - | - | - |
| 21 aprilie 2014 | 215 | 138 | 203 / 129 | 12 / 9 | - | - | - | - | - | - | - | - |
| 17 aprilie 2014 | 209 | 131 | 197 / 122 | 12 / 9 | - | - | - | - | - | - | - | - |
| 10 aprilie 2014 | 169 | 110 | 157 / 101 | 12 / 9 | - | - | - | - | - | - | - | - |
| 7 aprilie 2014 | 163 | 102 | 151 / 95 | 12 / 7 | - | - | - | - | - | - | - | - |
| 2 aprilie 2014 | 135 | 88 | 127 / 83 | 8 / 5 | - | - | - | - | - | - | - | - |
| 1 aprilie 2014 | 130 | 82 | 122 / 80 | 8 / 2 | - | - | - | - | - | - | - | - |
| 31 martie 2014 | 114 | 70 | 112 / 70 | 2 / 0 | - | - | - | - | - | - | - | - |
| 27 martie 2014 | 103 | 66 | 103 / 66 | - | - | - | - | - | - | - | - | - |
| 26 martie 2014 | 86 | 60 | 86 / 60 | - | - | - | - | - | - | - | - | - |
| 25 martie 2014 | 86 | 59 | 86 / 59 | - | - | - | - | - | - | - | - | - |
| 23 martie 2014 | 49 | 29 | 49 / 29 | - | - | - | - | - | - | - | - | - |
Etiologie - Virusurile Ebola[modificare | modificare sursă]
Taxonomie[modificare | modificare sursă]

Virusurile Ebola se numără astăzi printre cei mai virulenți agenții patogeni pentru specia umană.
Genurile Ebolavirus și Virusul Marburg sunt incluse în familia filoviride - din latină filum = fir, filament - denumită astfel datorită aspectului filamentos al acestor virusuri la microscopul electronic.[133][134] Asemănările structurii genomului și mecanismele comparabile ale expresiei genetice sugerează că filovirusurile au o origine evoluționistă comună cu familiile Paramyxoviridae (care include virusul rujeolei și virusul urlian) și Rhabdoviridae (care include virusul rabiei). Aceste trei familii au fost grupate în ordinul Mononegavirales, un grup de virusuri care posedă un genom cu ARN monocatenar, linear, nesegmentat și de polaritate negativă (= de sens negativ) [135][136][137][138]
Genul ebolavirus este subdivizat în cinci specii diferite, din care patru circulă în mod specific în Africa subsahariană, în timp ce ebolavirusul Reston circulă în Filipine și China.[139][140]
- Ebolavirusul Bundibugyo (BDBV, BEBOV)
- Ebolavirusul Zair, denumit în prezent virusul Ebola (EBOV, ZEBOV)
- Ebolavirusul Reston (RESTV, REBOV)
- Ebolavirusul Sudan (SUDV, SEBOV)
- Ebolavirusul pădurii Taï (TAFV) sau Ebolavirusul Coastei de Fildeș (CIEBOV)
Genomul acestor cinci specii de ebolavirusuri diferă genetic cu 32-41% la nivel de nucleotide. Spre deosebire de ebolavirusurile Reston și pădurii Taï, ebolavirusurile Bundibugyo, Zaire și Sudan sunt asociate cu focare importante de febră hemoragică Ebola în Africa. Specia Ebolavirusul Reston, găsită în Filipine și Republica Populară Chineză, poate infecta oameni, dar nu au fost semnalate până acum cazuri de boală sau deces cauzate de acest virus.[4][141][142]
Morfologie[modificare | modificare sursă]

Virionii virusurilor Ebola și Marburg la microscopia electronică au o formă unică în lumea virusurilor, cea a unui filament. Cu toate acestea, numeroase configurații, cum ar fi forme în "6", forme circulare, forme în "U" sau în "ac de păr" și forme ramificate sunt frecvent observate atât în culturile de linii celulare, cât și în secțiunile histologice ale organelor infectate. Virusul Marburg are adesea o formă circulară, în timp ce virusul Ebola are mai frecvent o formă de filament lung în formă de "U" sau "6". Virusurile Ebola și Marburg au aproximativ 80 nm (nanometri) în diametru și o lungime variind de la 600 nm până la 1000-1500 nm. Deși virusul Ebola este foarte pleomorf, adesea fiind întâlnite structuri cu lungimi diferite, cu anse, ramificații și alte neregularități, există dovezi că particulele infecțioase sunt reprezentate în principal de formele simple, lineare, cu lungime de aproximativ 1 μm. Virionii au o densitate de 1,14 g/ml în gradient de densitate de tartrat de K și o greutate moleculară de 3,6 x 108.[143][144][145] [146]
Examenul la microscopul electronic arată că virionii au la exterior un înveliș lipidic extern, provenit din membrana celulei gazdă infectată, pe care se află niște proeminențe numite peplomere (spiculi), de aspect globular cu diametrul de 7 nm, dispuse la intervale de 10 nm, care sunt în totalitate formate din proteine glicozilate - glicoproteine (GP), regrupate în macromolecule trimerice responsabile de aspectul granulat vizibil la microscopia electronică. În interior este situată nucleocapsida (ribonucleocapsida sau ribonucleoparticula, RNP) de simetrie helicoidală, cu diametrul de 40-50 nm și pasul helixului de 5 nm, având în interior un spațiu axial, vizualizat ca o zonă clară de 20 nm.[4][147][148]
Nucleocapsida[modificare | modificare sursă]
Nucleocapsida este un complex ribonucleoproteic, constituit din ARN genomic viral și nucleoproteinele asociate acestuia.[4][141]
Genomul[modificare | modificare sursă]

Genomul este de tip ARN, liniar, monocatenar, de sens negativ, cu o greutate moleculară de aproximativ 4 x 106 Da. Constituie 1,1% din întreaga masă virală. Genomul este constituit dintr-o singură catenă de ARN liniar cu aproximativ 19000 nucleotide (19 kb), de polaritate negativă (sens negativ) și are 7 gene transcrise în șapte ARN mesageri care codifică șapte proteine structurale: extremitatea 3' (cu o secvență leader necodificantă), nucleoproteina (NP sau N), proteina virale VP35, VP40, GP, VP30, VP24, ARN-polimeraza (L), extremitatea 5 ' (cu o secvență terminală trailer necodificantă). Partea centrală a virionului este ocupată de un complex ribonucleoproteic (RNP) care este constituit dintr-o catenă ARN înconjurată de nucleoproteină (NP) ea însăși fiind legată de proteinele matricei VP30 și VP35 și de ARN polimerază. Acest complex este implicat în transcripția și replicarea virionilor.[4][149][150][151]
Compararea acestor secvențe ale genomului cu genomul altor mononegavirale a arătat o organizare genomică foarte apropiată de cea a Paramyxoviridae și Rhabdoviridae și sugerează mecanisme de transcripție și replicare similare. Compus de aproximativ 19000 de baze, genomul filovirusurilor posedă dimensiunea genomică cea mai importantă în ordinul Mononegavirales.[141]
Genele virusului Ebola și funcțiile lor:[141]
| Ordinea genelor | Gena / Proteina codificată | Funcția |
|---|---|---|
| – | Secvența Leader | Conține prima parte a promotorului de inițiere a transcripției ARNm. |
| 1 | Nucleoproteina (NP) | Nucleoproteină majoră; încapsidarea ARN-ului în timpul etapelor de transcriere și replicare a virusului Ebola |
| 2 | Proteina virală VP35 | Cofactor al complexului polimerazic; antagonist al răspunsului interferonului (inhibă producția de interferon α / β blocând fosforilarea factorului de reglare IRF-3 în celulele infectate) |
| 3 | Proteina virală VP40 | Proteină matriceală; participă în procesul de asamblare și înmugurire a virionului; antagonist al răspunsului interferonului |
| 4 | Glicoproteina (GP) | Formează peplomere (spiculi) la suprafața virionului; intrarea virionului în celula țintă; atașarea virionului la receptorii celulari și fuziunea învelișului virionului cu membrana celulară. Glicoproteina solubilă (sGP) și glicoproteina solubilă mică (ssGP) au funcții necunoscute |
| 5 | Proteina virală VP30 | Nucleoproteină minoră; încapsidarea ARN-ului și activare transcripției |
| 6 | Proteina virală VP24 | Proteină matriceală minoră; asamblarea virionului; antagonist al răspunsului interferonului |
| 7 | Polimeraza (L) | ARN polimerază -ARN dependentă; componentă enzimatică a complexului polimerazic |
| – | Secvența Trailer | Include semnale necesare pentru sinteza de noi genoame în timpul replicării virale. |
Genomul are succesiv genele nucleoproteinelor NP, VP35, VP40, glicoproteinelor GP, VP30, VP24 și polimerazei L. Secvențele codante ale virusurilor Marburg și Ebola sunt separate de regiuni intergenice (secvențe separatoare) de 3-7 nucleotide, cu excepția regiunilor dintre genele VP30 și VP24 a virusului Ebola care sunt constituite din 142 și 97 nucleotide, în funcție de specie. În mod similar, genele GP și VP30 ale virusului Marburg au o secvență intergenică de 126 nucleotide.[4][152]
Genele alăturate, VP35-VP40, GP-VP30 și VP24-L, pot fi suprapuse în funcție de tipul de virus. Prezența a trei regiuni scurte suprapuse de cinci nucleotide între genele VP35-VP40, GP-VP30 și VP24-L caracterizează genomul ebolavirusurilor Zair și Sudan, în timp ce genomul ebolavirusului Reston diferă prin absența acestui tip de regiuni între genele GP și VP30. La virusul Marburg, există o singură zonă suprapusă între genele VP30 și VP24. Poziția acestor zone suprapuse a fost utilizată ca un criteriu în clasificarea diferitelor specii din familia Filoviridae. Diferența localizării acestor regiuni la ebolavirusul Reston în comparație cu ebolavirusurile Zair și Sudan ar putea fi un indicator a unei divergențe evolutive de la un strămoș comun.[4][152][153][154][155]
Genele virusurilor Marburg și Ebola sunt delimitate prin secvențe consens (3'-5') - CUNCNUNUAAUU și (3'-5') - UAAUUCUUUUUN care au fost desemnate, prin analogie cu genomurilor altor mononegavirale, ca semnale de inițiere și întrerupere a transcripției. Pentamerul foarte conservat -UAAUU- la fiecare extremitate a regiunilor transcrise caracterizează genomului filovirusurilor. Au fost descrise secvențe complementare în regiunea de inițiere a transcripției care permite formarea unei structuri secundare în "ac de păr" la extremitatea 5' a ARNm a virusului Marburg și Ebola. Structura secundară prezisă diferă în funcție de secvența nucleotidică în aval de situsul de inițiere. Apariția mutațiilor compensatorii în secvența de inițiere modificată prin mutageneză demonstrează importanța acestei structuri secundare.[4][150][156][157]
Secvența de terminare a transcripției conține o serie de cinci (la virusul Marburg) sau șase (la virusul Ebola) reziduri de uridină. Situsurile de poliadenilare (polyA), similare cu cele observate la virusurile din genurile Paramyxovirus și Morbillivirus, funcționează ca o matrice pentru adăugarea unui cozi poliadenilate la extremitatea 3' a ARNm viral prin mașinăria celulară.[4][158]
Regiunea Leader, alcătuită din 55 de nucleotide la virusul Ebola și 48 de nucleotide la virusul Marburg, începe de la prima nucleotidă a genomului viral și se extinde până la semnalul de inițiere a transcripției nucleoproteinei NP. Ea conține prima parte a promotorului de inițiere a transcripției ARNm. Regiunea Trailer (5') are o lungime variabilă la filovirusuri. Ea este constituită din 677 și 381 nucleotide la ebolavirusurile Zair și Sudan, 25 de nucleotide la ebolavirusul Reston și 76 de nucleotide la virusul Marburg. Această regiune include semnale necesare pentru sinteza de noi genoame în timpul replicării virale. Extremitățile genomice Leader și Trailer ale filovirusurilor au un grad ridicat de complementaritate între ele.[150][154]
Nucleoproteine[modificare | modificare sursă]
Complexul ribonucleoproteic (nucleocapsida) conține 4 proteine: NP, VP30, VP35 și L, codificate de genele cu aceleași denumiri. Proteinele NP, VP35 și L sunt suficiente pentru procesele de transcripție și de replicare a virusului Marburg, iar proteina VP30 este necesară în etapa de transcripție a genomului ebolavirusului Zair.[4][141]
- Proteina NP (104 kDa) este o fosfoproteină strâns legată de ARN, fosforilarea ei permițând menținerea stabilității complexului. Funcțiile sunt similare celorlalte proteine NP ale mononegaviralelor care fac parte din complexul polimerazic.
- Proteina VP35 (35 kDa) este analoagă proteinei P a paramixovirusurilor și rabdovirusurilor, fără să fie fosforilată. În apropiere de N-terminal posedă un domeniu hidrofil, cu rol probabil în atașarea de ARN genomic. Legăturile cu acesta sunt mai slabe decât cele ale proteinei N.
- Proteina VP30 (30 kDa) este o fosfoproteină minoră, activă probabil în încapsidare sau cofactor al complexului polimerazic.
- Proteina L sau ARN-polimeraza (270 kDa) este o proteină mare, având în segmentul N-terminal omologii importante cu proteinele L ale celorlalte mononegavirale. Are un rol de ARN polimerază -ARN dependentă, replicază și transcriptază, posedă la C-terminal segmentul peptidic înalt conservat, GDNQ, încadrat de aminoacizi hidrofobi, care este probabil situsul catalitic.
Învelișul viral[modificare | modificare sursă]

Învelișul viral este format dintr-un dublu strat lipidic derivat din membrana plasmatică a celulei-gazdă, are inserate peplomere globulare, proeminente la suprafață, alcătuite din glicoproteina GP codificată de virus. Proteinele învelișului viral includ glicoproteina unică de suprafață (GP), glicoproteina GP solubilă (GPS), proteina matriceală VP40 asociată membranei, proteina matriceală VP24 asociată membranei.[4][141]
Glicoproteina GP[modificare | modificare sursă]
Glicoproteina GP (130-170 kDa), singura glicoproteină structurală constitutivă a învelișului viral, este formată din două fragmente legate printr-o punte disulfurică, una extracelulară, GP1, și alta ancorată în membrană, GP2.[151][159][160][161]
Glicoproteina GP, care se leagă preferențial de celulele endoteliale și celulele liniei monocitare prin GP1, permite intrarea virionului în celula țintă, și este responsabilă de disjuncția celulelor endoteliale și de citotoxicitatea față de vasele sanguine observate in vitro; ea are în plus o acțiune imunosupresivă prin intermediul unei secvențe peptidice omoloagă cu o secvență imunosupresivă a retrovirusurilor.[162][163][164][165][166][167][168]
Glicoproteina GP solubilă[modificare | modificare sursă]
Glicoproteina GP solubilă (GPS sau sGP) (50-70 kDa) este o proteină nestructurală. Are activități distincte de cele ale glicoproteinei GP structurală: 1) probabil de inhibiție la nivel efector umoral, blocând Ac (anticorpii) dirijați anti GP; 2) induce energie la nivel efector celular; 3) activitate imunosupresoare corelată cu concentrații mari, la pacienții cu sfârșit letal și absență a răspunsurilor imune; 4) inhibă activarea timpurie a neutrofilelor, prin atașare la CD16b.[169][170][171]
Proteinele VP40 și VP24[modificare | modificare sursă]
Proteinele VP40 și VP24 sunt considerate proteine matriceale, datorită poziției în genom, caracterului hidrofob și faptului că nu sunt asociate cu ribonucleoproteina, iar prin tratare cu detergenți neionici rămân legate de membrană. Proteinele VP40 și VP24 sunt legate de complexul RNP, pe de o parte, și pe suprafața internă a bistratului lipidic al învelișului virionului, pe de altă parte. Aceste proteine sunt implicate în formarea complexului RNP, asamblarea și înmugurirea virionilor pe suprafața celulelor infectate și selectarea celulelor țintă.[149][172][173][174][175][176][177][178]
Proteinele VP35 și VP24 joacă un rol major în patogenitatea virusului neutralizând răspunsurile antivirale ale celulelor infectate printr-o activitate inhibitoare specifică a sintezei IFN (interferon uman) de tip I.[179][180][181][182][183][184]
Epidemiologie[modificare | modificare sursă]
Rezervorul natural al virusului Ebola[modificare | modificare sursă]


Infecția cu virusul Ebola este o zoonoză (boală infecțioasă transmisibilă de la animale la om și invers).
Rezervorul natural al virusului Ebola nu este încă clar identificat. În Africa, se crede că liliecii frugivori, mai ales cei care aparțin speciilor Hypsignathus monstrosus, Epomops franqueti și Myonycteris torquata, sunt posibile gazde naturale (rezervor natural) ale virusului Ebola. Prin urmare, distribuția geografică a virusului Ebola se poate suprapune cu cea a liliecilor.[2] Această ipoteză se bazează pe mai multe argumente:[185]
- Mai multe cazuri de infectare cu virusul Marburg (virus asemănător cu virusul Ebola) au survenit după vizitele unor peșteri sau mine în care se aflau lilieci infectați. Liliecii trăiau în fabrica de bumbac la care erau angajați cazurile index de Ebola în epidemiile din 1976 și 1979.
- În laborator, liliecii frugivori pot fi infectați cu virusul Ebola și în ei are loc replicarea și eliminarea virusului prin scaune fără semne clinice de boală. Absența semnelor clinice de boală la acești liliecii infectați este caracteristică pentru speciile care servesc ca rezervor. Din 24 de specii de plante și 19 specii de vertebrate inoculate experimental cu Ebolavirus, numai liliecii s-au infectat.[186] Liliecii pot susține replicarea și circulația unor concentrații mari de virus Ebola.
- În zonele epidemice din Gabon și Congo au fost identificate secvențe genetice ale virusurilor Ebola prin amplificarea genomică RT-PCR și au fost observate numeroase seroconversii la liliecii aflați în aceleași zone unde au fost găsite carcasele maimuțelor moarte infectate.
Rezervorul natural al virusului Ebola a fost identificat numai după investigarea a mii de specii din pădurile tropicale umede de pe continentul african.[148]
Virusul a fost detectat în carcasele de gorile, cimpanzei și antilope de pădure (subfamilia Cephalophinae) în timpul epidemiilor din 2001 și 2003, care mai târziu au devenit sursă de infecții umane.[148] Primatele antropoide, cu toate că sunt la originea mai multor epidemii, nu pot reprezenta rezervorul virusului Ebola, deoarece mortalitatea ridicată a acestor specii infectate cu acest virus le face puțin probabil să fie un rezervor natural. Virusul Ebola pare a fi un pericol real de extincție a speciilor de maimuțe antropoide. Populațiile de primate antropoide (maimuțele mari și maimuțele mici) au fost decimate în zonele în care au avut loc epidemiile recente din Africa (Gabon și Republica Democrată Congo) cu Ebolavirusul Zair. Maimuțele par să joace un rol amplificator al virusului și de gazdă intermediară pentru om.[138]
Numeroase studii de teren, bazate pe capturarea animalelor sălbatice (vertebrate și nevertebrate), s-au desfășurat între 1976-1998 în diferite țări pentru a încerca să se identifice speciile potențial rezervoare ale virusurilor Ebola și Marburg. Virusurile au fost cercetate inițial prin izolare, apoi prin tehnici de biologie moleculară.[12][13][187][188][189][190][191] În total, printre aproape 7.000 de vertebrate (mamifere, mai ales rozătoare, păsări, reptile, amfibieni) și 30.000 de nevertebrate (artropode) analizate în regiunile epidemice pentru determinarea rezervorul natural al fiolovirusurilor, au fost detectate numai secvențe nucleotidice de ebolavirus Zair în organele a șase rozătoare (Mus musculus și Praomys sp.) și a unui chițcan de pădure (Sylvisorex ollula) colectate în Republica Centrafricană în 1999.[192][193] Din păcate, aceste rezultate nu au fost confirmate și nici o concluzie nu a putut fi trasă. În mod similar, numeroase inoculări experimentale cu virusul Ebola au fost încercate pe rozătoare, lilieci, păsări, reptile, moluște, artropode și plante, dar toate au eșuat.[186][194]
Cu toate acestea, unii lilieci aparținând genurilor Epomophorus și Tadarida au dezvoltat o viremie tranzitorie de circa 4 săptămâni, dar din nou fără dovezi concludente asupra rolului liliecilor ca gazde naturale ale filoviridelor. Datorită epidemiilor care au avut loc începând cu 2001, s-au făcut noi colecții în 2002 și 2003 în Gabon și Republica Congo pentru virusul Ebola pe de o parte, și în 2002 în Republica Democrată Congo, în 2005 în Gabon și în 2007 în Uganda pentru virusul Marburg, pe de altă parte, în zonele afectate de epidemii.[185][195][196][197][198]
În 2005, trei specii de lilieci frugivori (Hypsignathus monstrosus, Epomops franqueti și Myonycteris torquata) au fost identificate ca purtătoare ale virusului, în timp ce restul erau asimptomatice. În organele acestor 3 lilieci au fost detectate fragmente de ARN ale ebolavirusului Zair. Secvențializarea fragmentelor amplificate au confirmat specificitatea secvențelor.[148][199] În plus, anticorpi IgG anti-EBOV au fost detectați în serul a 16 exemplare de lilieci: 4 exemplare de Hypsignathus monstrosus, 8 de Epomops franqueti și 4 de Myonycteris torquata, însă ei nu au fost găsiți la alte specii de lilieci și la alte specii de animale.
Aceste rezultate au fost confirmate ulterior prin studii de seroprevalență efectuate pe 2.147 de animale colectate în Gabon și Republica Congo între 2003 și 2007. Niveluri ridicate și constante au fost obținute pe parcursul celor patru ani de capturi a celor trei specii, Hypsignathus monstrosus (7%), Epomops franqueti (4%) și Myonycteris torquata (3%). În plus, un studiu a arătat ca epidemia din Luebo din 2007 în Republica Democrată Congo a fost legată de migrația masivă a liliecilor frugivori, sugerând cu tărie că oamenii pot fi infectați de lilieci.[200]
În mod similar, anticorpi și secvențe nucleotidice ale virusului Marburg au fost găsite în organele indivizilor unei specii de lilieci frugivori (Rousettus aegyptiacus) în Gabon, Republica Democrată Congo și Uganda și la alte două specii de lilieci insectivori în Republica Democrată Congo: (Rhinolophus eloquens și Miniopterus inflatus). Studiile din 2007 a liliecilor frugivori egipteni (Rousettus aegyptiacus) cavernicoli care trăiesc în peștera Kitaka din Uganda au izolat ARN virusului Marburg din țesuturi și au demonstrat anticorpi specifici virusului.[195] Până în prezent, Gabon este singura țară în care liliacul Rousettus aegyptiacus s-a dovedit a fi rezervorul pentru ambele virusuri, Ebola și Marburg. Deși se știe că maimuțele au introdus virusul Marburg în Europa și virusul Ebola în Statele Unite și Italia, ele nu sunt privite ca fiind rezervorul natural al virusurilor.[185][195]
Ebolavirusul Reston spre deosebire de omologii săi africani este nepatogen pentru om. Marea mortalitate în rândul maimuțelor și apariția sa recentă la porci îl face un rezervor natural improbabil. Liliecii au fost implicați în infecțiile cu virus Marburg din 1975 și 1980.[148]
Ansamblul acestor date arată că unele specii de lilieci frugivori din Africa Centrală sunt rezervoarele (gazdele naturale) ale filovirusurilor.
Virusul Ebola la primate[modificare | modificare sursă]
Cu toate că primatele au fost sursa de infecție la om, ele nu sunt considerate a fi rezervorul, ci mai degrabă gazde accidentale ale virusului, ca și ființele umane. Începând cu 1994, s-au observat la cimpanzei și gorile focare de infecție cu 2 specii ale virusului Ebola: ebolavirusul Zair și ebolavirusul pădurii Taï. Ebolavirusul Reston a fost cauza focarelor severe de febră hemoragică Ebola la macaci crabivori (Macaca fascicularis) crescuți în Filipine și el a fost detectat la maimuțele importate în Statele Unite ale Americii în 1989, 1990 și 1996, precum și la maimuțele importate în Italia în 1992, provenite din Filipine.[148] Din 2008, ebolavirusul Reston a fost identificat în timpul mai multor focare de o boală mortală la porcii din Filipine și China.[30]
Virusul Ebola are un impact important asupra faunei sălbatice. Mai multe studii au arătat că virusul Ebola a fost responsabil între 1995 și 2005 de marile epidemii printre cimpanzei, gorile și antilope în Gabon și Republica Congo și a fost cauza unui declin brusc și rapid a populațiilor de maimuțe mari care trăiau în aceste țări. Astfel, numărul de cimpanzei a scăzut cu aproape 80% în nord-estul Gabonului în ultimul deceniu și sute de mii de gorile au pierit în nord-vest Republicii Congo.[201][202][203][204][205][206]
Un studiu serologic, efectuat pe 790 prelevări de la douăzeci de specii de primate din Camerun, Gabon și Republica Congo a arătat de asemenea că 12,9% dintre cimpanzei sălbatici aveau anticorpi IgG anti-Ebola, unele dintre eșantioane pozitive fiind prelevate înainte de primele epidemii din aceste regiuni.[207] Pe de altă parte, un studiu efectuat în pădurea Taï din Coasta de Fildeș a arătat dispariția a 11 membri ai unui grup de 43 de cimpanzei (sau a 26% din grup) într-o singură lună de noiembrie 1994.[208] Analiza imunohistochimică pozitivă a unui țesut provenit de la un cadavru de cimpanzeu sugerează că virusul Ebola (Ebolavirusul pădurii Taï) este responsabil de dispariția unei parți a acestui grup. Ansamblul rezultatelor epidemiologice și serologice sugerează că maimuțele mari care populează aceste regiuni sunt în mod regulat în contact cu virusul Ebola, care este probabil prezent de foarte multă vreme în blocul forestier din Africa Centrală.[209]
Pentru a înțelege modurile de contaminare a maimuțelor mari, partea codantă a GP (gena cea mai variabilă) a genomului viral, extrasă din țesuturile carcaselor gorilelor și cimpanzeilor, a fost sistematic amplificată apoi secvențată. Diferite secvențe virale au fost obținute pentru fiecare carcasă, inclusiv la două carcase de gorile găsite în aceeași zi la câțiva metri una de alta. Prin urmare, această diversitate genetică exclude o transmisie a virusului de la un individ la altul, deoarece ea ar fi fost asociată în acest caz cu secvențe identice. Ea indică, din contră, că infecția maimuțelor mari rezultă din contaminare simultană și independentă din surse animale diferite, probabil din rezervorul natural al virusului Ebola. În acest model de "multiemergență" trecerea virusului din rezervor la maimuțele mari se produce datorită unor condiții particulare ale mediului înconjurător.[201][207][210][211]
În afară de aceasta, existența a două linii evolutive distincte în interiorul speciei Zair, care s-au separat înainte de prima epidemie din 1976, și apariția unei recombinări genetice între virusurile acestor două linii, consolidează nu numai modelul de "multi-emergență", dar și ipoteza potrivit căreia virusul Ebola este prezent de mult timp în pădurile tropicale umede din Africa Centrală. Această recombinare a dus la geneza virusurilor Ebola recombinante între 1996 și 2001, care au provocat epidemiile de Ebola între 2001 și 2003 în Gabon și Republica Congo.[211]
Transmiterea[modificare | modificare sursă]

Noi dovezi demonstrează că liliecii frugivori (Hypsignathus monstrosus, Epomops franqueti și Myonycteris torquata), care sunt în mod natural rezistenți la infecție, sunt gazdele-rezervor ale ebolavirusurilor, cu toate că căile de întreținere enzootică locală și de transmitere a virusului Ebola în interiorul populațiilor de lilieci rămân necunoscute. Mai mult decât atât, acești lilieci se află în număr mare în arbori și consumă fructele acestora, în special în interiorul și în jurul satelor din Africa Centrală. Astfel, este posibil ca sătenii să se infecteze când manipulează sau consumă fructele contaminate cu saliva liliecilor care poate conține virusul Ebola. În mod similar se infectează și primatele.[212] Epizootiile animalelor cauzate de ebolavirusuri apar sporadic, producând o mortalitate ridicată în rândul primatelor neumane și antilopelor duiker (din subfamilia Cephalophinae) și pot preceda epidemiile umane. Transmiterea interumană este o caracteristică predominantă a epidemiilor. După infecția umană inițială prin contactul cu un liliac infectat sau alt animal sălbatic, de multe ori are loc transmiterea interumană de la om la om.[204][213]
Transmisia interumană este asociată în principal cu reutilizarea echipamentelor de injectare (acelor de seringă, seringilor) sau prin contact direct și neprotejat cu sângele, secrețiile sau excrețiile. În Kikwitt, nici o persoană care trăia sub același acoperiș cu bolnavii, dar neexpusă la contactele menționate mai sus, nu a fost infectată. Riscul de transmitere interumană este maxim în stadiile tardive ale afecțiunii. La transmiterea interumană și răspândirea infecției contribuie și ritualurile de înmormântare din Africa Centrală și Africa de Vest când decedatul este spălat de membrii familiei, care apoi își clătesc mâinile, împreună cu toți participanții la ritual, membrii familiei și prietenii, într-un vas cu apă.[3] Nu a fost comunicată infectarea persoanelor care au avut contact cu pacientul în timpul perioadei de incubație.[147]
Transmiterea aerogenă posibilă în laborator se poate face doar prin aerosolizarea picăturilor de sânge și nu prin clasicele picături Flügge,[3][214] și nu joaca nici un rol în practică în transmisia interumană.[148][215]
| Transmiterea virusului Ebola la om se realizează pe mai multe căi:[2][3][4][5][147][216] |
|---|
|
|
|
|
|
|
|
Printre persoanele care lucrează în contact cu maimuțele sau porcii infectați cu ebolavirusul Reston, au existat mai multe cazuri de infecții umane asimptomatice clinic. Ebolavirusul Reston pare mai puțin patogen pentru om decât alte specii de virus Ebola. Totuși, datele disponibile se referă numai pentru persoane adulte sănătoase. Ar fi prematur să se tragă concluzii cu privire la efectele acestui virus asupra sănătății în toate grupurile de populație, mai ales a pacienților imunodeprimați, la cei cu probleme medicale preexistente, la femeile gravide sau la copii. Vor fi necesare noii studii asupra ebolavirusului Reston înainte de a se putea trage concluzii definitive cu privire la patogenitatea și virulența acestuia pentru oameni.[2]
Personalul medical poate fi frecvent infectat ca urmare a utilizării acelor și seringilor contaminate sau neutilizării măsurilor de barieră, mănușilor, măștilor sau a dezinfectantelor. Epidemia din 1976 din Maridi a fost dramatic amplificată de infecțiile intraspitalicești (213 cazuri), ca urmare a internării unui pacient din Nazara. Nouăzeci și trei de cazuri (46%) au contractat boala în spital și 105 (52%) în comunitate. Din personalul medical de 230 oameni al spitalului din Maridi, 72 s-au infectat, 41 decedând. Rata maximă a infecțiilor a fost asociată cu îngrijirea pacienților cu hemoragii, care, în vârful epidemiei, ocupau majoritatea saloanelor. În epidemia din septembrie și octombrie 1976 din nordul Zairului după ce 13 oameni din personalul medical din 17 au contractat boala și 11 pacienți au decedat, spitalul a fost închis. Principalul factor de risc s-a dovedit a fi reutilizarea acelor nesterilizate, care erau în cantitate insuficiență. În 1995, în epidemia din Kikwit o echipă de resuscitare a fost infectată după ce a tratat un pacient greșit diagnosticat cu febră tifoidă. S-a produs transmiterea rapidă la personalul sanitar neprotejat și la alți pacienți, din care mulți au reintrodus boala în comunitate.[147][148]
Circulația virusului Ebola între epidemii[modificare | modificare sursă]
Caracterizarea zonelor de circulație ale filovirusurilor se bazează în principal pe evenimentele epidemice. Aceste informații sunt în mod inevitabil incomplete, deoarece ele nu iau în considerație circulația naturală a virusului printre speciile animale asimptomatic infectate, nici circulația virusului la persoanele care au numai forme clinice ușoare care trec neobservate deoarece sunt puțin caracteristice. În consecință, au fost folosite mai multe metode pentru a determina zonele de circulație a virusurilor Ebola și Marburg în afară de orice context epidemic. Metodele de teledetecție și calculele indicelui de vegetație ar putea sugera indirect că ariile de circulație sunt mult mai vaste decât cele delimitate de epidemii. În mod similar, cercetarea anticorpilor specifici (IgG) în mijlocul diferitelor populații umane a permis identificarea cu mai multă precizie a zonelor de circulație a acestor virusuri precum și a factorilor de expunere la virusuri.[193][210][217][218]
Un studiu serologic efectuat pe 4300 de persoane din 220 de sate răspândite în tot Gabonul a arătat o prevalență totală de 15,3% a anticorpilor IgG anti-ZEBOV, fără nici o diferență între satele epidemice și satele neepidemice. Cu toate acestea, valorile prevalenței (morbidității totale) a fost semnificativ mai mari în zonele de pădure (19,4%) decât în zonele de câmpie (12,4%), de savane (10,5%) sau în zonele mlăștinoase (2,7%). Nici un alt factor de risc nu a fost pus în evidență.[212][219] Aceste rezultate corespund cu cele obținute în anii '80 în mai multe țări din Africa Centrală, unde nici un caz clinic nu a fost înregistrat, cum ar fi Camerun sau Republica Centrafricană, unde s-au găsit că valorile prevalenței variază de la 2% la 21%. Aceste rezultate, bazate pe o metodă puțin specifică (imunofluorescența) au fost confirmate ulterior prin ELISA, mai sensibilă și mai specifică. Un nivelul al prevalenței de 9,3% a fost într-adevăr găsit în mai multe sate indemne din Republica Democrată Congo în jurul orașului Kikwit după epidemia din 1995 și niveluri de 13,2% au fost obținute în mai multe sate de pigmei din Republica Centrafricană.[220][221] Rezultatele obținute în Gabon au identificat prevalențe surprinzător de mari incompatibile cu epidemiologia virusului Ebola, caracterizate printr-un număr redus de epidemii, epidemii de mică anvergură (mai puțin de 100 de cazuri) și o letalitate ridicată (80%), care lasă puțini supraviețuitori după fiecare epidemie. Prin urmare, aceste valori ridicate exclud ipoteza după care aceste persoane IgG+ nu sunt decât niște supraviețuitori a unei infecții cu virusul Ebola și sugerează din contra o expunere regulată la virus și/sau contacte frecvente cu o sursă (surse) animală (animale), gazde naturale sau rezervoare potențiale, care probabil populează din abundență regiunile din Africa Centrală. Aceste rezultate au permis emiterea mai multor ipoteze explicative: expunerea la virus poate avea loc în timpul consumului de fructe contaminate cu saliva liliecilor (gazdele naturale ale virusurilor Ebola și Marburg); puterea patogenă (patogenitatea) reală a ebolavirusului Zair ar putea fi mult mai mică decât cea cunoscută până în prezent (nivelul letalității de 80%); imunitatea dezvoltată de către aceste persoane IgG+ poate fi protectoare. Într-adevăr, memoria imunitară indusă la maimuțele macac de vaccinurile candidate este susținută de IgG+ specifice și de limfocitele T CD8+ secretoare de IFN-γ (interferon γ) component al sistemului imunitar detectat la persoanele IgG+ recent identificate în Gabon.[222][223][224][225][226][227]
Patogeneza și imunitatea[modificare | modificare sursă]
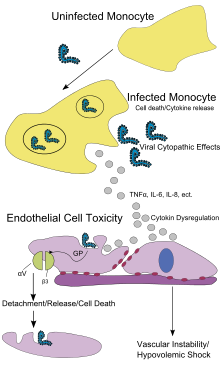
Infecția pe cale subcutanată a maimuțelor (Cercopithecus aethiops) și babuinilor (Papio hamadryas) a arătat că principala țintă a virusului Ebola după intrarea în organism sunt celulele prezentatoare de antigen, celulele dendritice, macrofagele și monocitele. Aceste celule, prezente în număr mare la nivelul pielii și mucoaselor, sunt infectate precoce și apoi diseminează virusul în interval de 3-4 zile în întregul organism prin circulația sanguină și limfatică, virusul fiind detectat în parenchimul și spațiile interstițiale ale viscerelor. Are loc infecția hepatocitelor, fibroblastelor și endoteliocitelor.[4][228][229][230][231]
Viremia se observă la maimuță la 24 h după inoculare, iar la bolnavi după 4-5 zile, replicarea virală fiind prezentă în toate organele într-un interval de 6-8 zile, cu producere masivă de virus infectant și liză celulară. În țesuturi și organele interne virusul se multiplica în organele limfoide secundare și în hepatocite, apoi, în faza terminală, infectează alte celule cum ar fi celulele endoteliale și epiteliale și fibroblastele.[232][233]
La babuin, examenele biochimice relevă disfuncții hepatice și renale începând din a 3-a zi, datorită creșterii permeabilității vaselor.[4]
Infecția letală[modificare | modificare sursă]
La pacienți și la animalele infectate experimental sau natural, cu o evoluție letală a bolii, se constată o viremie înaltă și răspunsuri imune absente. Infecția fatală provocată de filovirusuri este caracterizată printr-o disfuncție a imunității înnăscute și o prăbușire a imunității adaptive.[141][234][235]
Disfuncția imunității înnăscute[modificare | modificare sursă]
În primul rând, infecția monocitelor duce la hiperactivarea imună cu eliberare excesivă de mediatori inflamatori și chemokine, ca IL-1β, TNFα, IL-6, IL-15, IL-16, IL-1RA, sTNFR, IL-10, NO-, IL-8, GRO-α, CCL3, CCL4, CXCL10, MCP-1 și eotaxină. Această "furtună inflamatoare", deosebit de importantă în faza terminală a bolii, are o acțiune nefastă pentru organism.[229][236][237][238][239]
În al doilea rând, unele proteine virale au un efect imunosupresor și sunt capabile să neutralizeze imunitatea înnăscută prin inhibarea apărării antivirale a celulelor. Proteina virală VP35 inhibă sinteza de interferon IFNα/β împiedicând activarea factorului de reglare al interferonului IRF-3 și IRF-7 și interferează cu activarea dsARN-protein kinazei dependente (PKR), iar proteinele virale VP30 și VP40 inhibă "RNA silencing" (interferența ARN). În plus, proteina virală VP24 împiedică acumularea nucleară a proteinei STAT1 fosforilate, neutralizând prin urmare răspunsul la interferonii IFNα/β și IFNγ.[240][241] Astfel, inhibarea sintezei de interferon IFN de tip I pare a fi un element fundamental al virulenței virusului Ebola. De fapt, anumite mutații ale genei care codifică proteina VP35 au dus la atenuarea virulenței virusului Ebola in vitro și in vivo.[242][243] La pacienții cu evoluție letală s-au observat creșteri ale interferonului IFN γ de peste 100 pg/ml. Aceasta ar contribui la sindromul hemoragic al capilarelor, rash hemoragic și stare de șoc însoțită de febră, polipnee, insuficiență renală și alterări ale sistemului nervos central.[4]
Prăbușirea imunității adaptive[modificare | modificare sursă]
Forma fatală a infecției cu filovirusuri este, de asemenea, caracterizată printr-o prăbușire a imunității adaptive care se manifestă printr-o depleție a celulelor limfoide din ganglionii limfatici, splină și timus, apoptoză intravasculară a limfocitelor T și B și celulelor NK și absența producției de anticorpi IgG specifici.[230][238][244][245][246][247][248][249]
Limfocitele nu sunt infectate de virus și apoptoza rezultă din interacțiunile cu markerii de suprafață (Fas/FasL, TNF/TRAIL) și/sau cu mediatorii solubili apoptogeni și/sau cu o activitate superantigenică a anumitor proteine virale.[250]
Colapsul imunității adaptive poate, de asemenea, rezulta dintr-un defect al activării și maturării celulelor dendritice infectate care vor fi deci incapabile de a iniția răspunsuri imune.[228][230][251][252]
În absența răspunsurilor imune eficace, letalitatea mare de 50-90% se datorează hemoragiilor întinse și șocului consecutiv. Este probabil ca și sindromul de coagulare intravasculară să fie o cauză importantă, dar la om intervenția acestuia este controversată.[4]
Hipercoagulabilitatea[modificare | modificare sursă]
Parametrii sistemului de coagulare sangvină relevă fenomene similare sindromului de coagulare diseminată intravasculară: se constată o hipercoagulabilitate până în ziua a 4-a (indicele de trombină 148% și protrombină 156%), urmată de o hipocoagulabilitate înaintea decesului. Se constată diferențe specifice în funcție de speciile de maimuțe, la unele observându-se tromboze fibrinoase generalizate, pe când la babuini predomină hemoragiile. Hemoragiile masive observate la om și la animalele de experiență s-ar datora nu numai leziunilor extensive ale endoteliilor, ci și hiperactivării imune, cu intervenția supraproducției de interferon IFN care are originea în macrofagele / monocitele infectate.[4]
TNFα, NO- și alți compuși vasoactivi favorizează o exsudare vasculară prin creșterea permeabilității endoteliale, reducerea tonusului vascular și prin alterarea funcțiilor celulelor endoteliale.[229][244][253][254]
Infectarea macrofagelor favorizează, de asemenea, coagulopatii, inducând coagularea intravasculară diseminată prin intermediul unei expresii semnificative a factorului tisular (TF).[255][256][257]
Infecția neletală[modificare | modificare sursă]
Din contră, infecția neletală, ca și infecția asimptomatică, este asociată cu un răspuns inflamator precoce și moderat și implică răspunsuri adaptative care au drept consecință răspunsuri IgG și citotoxice specifice. Nu s-a observat nici un eveniment apoptogen al celulelor sistemului imunitar.[141][234][235]
Răspunsul umoral a fost studiat la animale și pacienți care au supraviețuit bolii. Anticorpii IgM au fost detectați la maimuțe (Macaca mulatta și Macaca fascicularis) la 6 zile după infecție, cu o persistență de până la 400 zile. Într-un studiu efectuat la 29 de convalescenți care au supraviețuit epidemiei din Kikwit-Congo din 1995 (315 cazuri cu 244 de decese) s-a constatat pe o perioadă de supraveghere de 21 de luni că în cursul bolii, anticorpii IgM au apărut la 2-9 zile de la debut și s-au menținut timp de 30-168 de zile, iar anticorpii IgG au fost detectați la 6-18 zile, persistând până la sfârșitul perioadei de supraveghere. Anticorpii IgG s-a dovedit că pot persista pe o durată de minimum 10 ani după îmbolnăvire. IgG au fost detectați în concentrații mici la unele persoane infectate în cursul epidemiei de la Marburg din 1967 și s-au menținut peste 20 ani. Nu au fost evidențiați anticorpi de tip neutralizant, ci numai anticorpi fixatori de complement (titrurile fiind extrem de mici) sau anticorpi evidențiați prin tehnici imunoenzimatice sau prin imunofluorescență indirectă.[4]
La convalescenții umani după infecția cu virus Marburg sau Ebola, virusurile au fost izolate 3-4 luni mai târziu în lichidul seminal sau, la un pacient cu uveită, în fluidul camerei anterioare a ochiului. Nu au existat dovezi de persistență pe termen lung, latență sau afecțiuni degenerative tardive la numărul mic de cazuri observate sau la maimuțele în curs de vindecare.[147]
Histopatologia[modificare | modificare sursă]
Exsudatele viscerale extinse, edemul pulmonar interstițial și disfuncția tubulară renală ce apar consecutiv leziunilor endoteliale, ducând la șoc hipovolemic, sunt elemente ce contribuie la deces. Pierderea acută și severă de lichid, acompaniată de hemoragii în țesuturi și tractul gastrointestinal este caracteristică și duce la deshidratare și perturbarea echilibrului acido-bazic.[147]
Leziunile histopatologice observate sunt asemănătoare la animalele infectate experimental și la oameni, caracterul lor predominant fiind acela de diateză hemoragică care este extinsă la toate organele.Se observă necroze focale, diseminate în ficat, organele limfatice, splină, rinichi, testicule și ovare. Caracteristice sunt necrozele hepatice, cele mai afectate fiind celulele Kupffer, care conțin niște incluzii virale eozinofile intracitoplasmatice. În focarele de necroză sunt prezenți corpusculi Councilman și o infiltrație scăzută de celule inflamatoare. Ca rezultat al replicării virusului apar necroze masive caracteristice ale ganglionilor limfatici. Datorită permeabilității vasculare crescute se observă numeroase focare hemoragice în creier, leziuni ale tubulilor renali, pneumonie interstițială, edeme tisulare. În vasele sangvine se constată trombusuri și depozite de fibrină. Leziunile de tip inflamator în organe sunt minime.[4][230][231][248][253][255]
Afectarea sistemelor și organelor în febra hemoragică Ebola: [258]
| Sistemele afectate | Leziuni tisulare | Leziuni celulare | Manifestări clinice |
|---|---|---|---|
| Sistemul nervos central | Endoteliul vascular, focare hemoragice în creier | Celulele endoteliale | Creșterea permeabilității vasculare prin lezarea endoteliului și prin implicarea macrofagelor, TNFα, NO- și altor compuși vasoactivi, hipotensiune arterială |
| Sistemul endocrin | Glandele suprarenale: degenerescența focală și necroza celulelor corticale din zona glomerulară și zona fasciculată | Celulele corticale suprarenale, celulele endoteliale care căptușesc sinusoidele, celulele de tip fibroblastic între celulele corticale suprarenale ale zonei glomerulare și țesuturile fibroelastice a capsulei | Insuficiență suprarenală, șoc, hipotensiune arterială |
| Sistemul gastrointestinal | Epiteliul limbii, esofagul, intestinul subțire și intestinul gros, canalele salivare, glandele gastrice, glandele duodenale Brunner | Celulele epiteliale, celule epiteliale glandulare | Grețuri, vomă, diaree, deshidratare, hipovolemie, hipotensiune arterială |
| Sistemul hepatic | Leziuni vacuolare hepatocelulare, degenerescență hepatică, necroze hepatice focale diseminate | Hepatocite, celulele Kuppfer, celulele endoteliale sinusoidale | Insuficiență hepatică, coagulopatii, sângerări |
| Sistemul imunologic | Necroze masive ale ganglionilor limfatici | Celulele dendritice, monocitele, macrofagele | Dereglare imunitară, imunosupresie |
| Sistemul respirator | Capilarele alveolare, epiteliul respirator al traheei și laringelui | Macrofagele alveolare și interstițiale, celulele epiteliale bronșice și bronhiolare, pneumocitele | Tahipnee, dispnee, insuficiență respiratorie |
| Tractul urogenital | Epiteliul tubular proximal renal, vezica urinară, epididimul, testiculele;necroze focale diseminate în rinichi, testicule și ovare, leziuni ale tubulilor renali | Celulele epiteliale, celulele interstițiale Leydig, celulele endoteliale | Leziuni renale acute, necroză tubulară, insuficiență renală |
Manifestări clinice[modificare | modificare sursă]
Virusul Ebola induce o viroză acută severă cu o evoluție rapidă marcată de o febră ridicată și o diateză hemoragică generalizată care survine în stadiu terminal, asociată cu o rată a mortalității care poate să se ridice până la 90%.[259][260][261][262][263][264]
Perioada de incubație, adică timpul între momentul infectării cu virus și debutul primelor simptome, este de la 2 la 21 zile, în medie 4-12 zile, iar în cazul transmiterii prin ac de seringă, 5-7 zile. Nu se cunoaște doza infectantă.[2][4][147][148][265]
Debutul este brusc, cu simptome nespecifice: febră mare, frison, cefalee (mai ales cefaleea frontală severă), mialgii, anorexie, astenie intensă și disconfort general.[2][4][147][148][265]
Aceste semne prodromale nespecifice sunt apoi rapid urmate în următoarele 2-3 zile de manifestări cutanate (exantemul cu o erupție cutanată eritematoasă, maculopapulară, morbiliformă sau veziculoasă timp de 5-7 zile, cu descuamare la supraviețuitori), simptome digestive violente (dureri abdominale, greață, vome severe, diaree profuză), tulburări respiratorii (faringită cu dureri în gât, tuse uscată, dureri toracice) și semne neurologice (prostrație, anxietate, confuzie, pierderi de memorie, instabilitate, delir, convulsii, tremurături), indicând o difuziune generalizată a virusului și o atingere multiviscerală. Semnele precoce includ și tahicardia și conjunctivita. Apare o insuficiență renală și hepatică care se exprimă prin teste de laborator modificate (fără icter).[2][4][147][148][265]
La gravide se produce avort în 66% dintre cazuri, iar la nou-născuții mamelor bolnave infecția este letală. Mortalitatea la gravide este 95,5%.[4]
Manifestările hemoragice cu sângerări pronunțate interne și externe apar între zilele cinci și șapte (melena, hematemeza, hemoptizii, echimoze și peteșii, hemoragii conjunctivale cu congestie conjunctivală, epistaxis, hemoragii necontrolabile la locurile de puncție venoasă) numai la aproximativ o treime din pacienți cu boala severă, de obicei în faza terminală a bolii (vezi imaginile de pe sit-ul Illustrated lecture notes on Tropical Medicine Arhivat în , la Wayback Machine.).[266] La necropsie în acest caz se constată exsudate hemoragice viscerale.[2][4][147][148][265]
În formele fatale, decesul survine de obicei între zilele 7-10 de la debut (limite 1-20 zile), prin șoc, hipovolemie și hemoragii externe și interne severe extinse și generalizate.[2][4][147][148]
În formele nefatale, simptomele se atenuează rapid, la 7-10 zile de la debut, simultan cu dispariția virusului din circulația sangvină. Convalescența după boală este în general îndelungată (câteva săptămâni sau luni) și dificilă, însoțită de accese febrile episodice, căderea abundentă a părului timp de 3 luni, astenie extremă, anorexie, pierdere ponderală, dureri abdominale, mialgii și artralgii, prostrație, amnezie, pierderea auzului după 6 luni de la episodul acut. Mialgiile și artropatiile sunt descrise și după 21 de luni.[2][4][147][148]
Pacienții atinși de boală rămân contagioși, atâta timp cât virusul este prezent în sângele și secrețiile lor. Nu au fost comunicate infectări ale persoanelor care au avut contact cu pacientul în timpul perioadei de incubație.[2][4][147][148]
Virusul Ebola persistă la pacienții în convalescență. ARN viral al virusului Ebola a fost izolat din prelevatele vaginale, rectale și conjunctivale la interval de 33 de zile. În lichidele seminale prezența ARN virusului Ebola s-a demonstrat în diverse studii, după 61, 82 și 91 de zile de la îmbolnăvire. Semne de orhită sau uveită, legate de persistența virusului în locurile protejate imunologic, sunt uneori observate timp de câteva săptămâni după dispariția simptomelor.[2][4][147][148][267][268]
Într-un studiu pe mai mult de 700 de pacienti efectuat în august și octombrie 2014, în cel mai mare spital pentru tratament febrei hemoragice Ebola din Monrovia, Liberia au fost observate următoarele manifestări clinice:[269]
| Stadiul bolii | Zile de la debutul bolii | Manifestări clinice |
|---|---|---|
| Stadiul febril precoce | 0–3 zile | Febră mare (de până la 40 °C), frison, stare de rău, fatigabilitate, dureri musculare |
| Stadiul gastrointestinal | 3–10 zile | Simptome și semne gastrointestinale: dureri epigastrice, greață, vome, diaree profuză (în volum de peste 5 litri pe zi), intoleranța alimentației orale
Simptome și semne asociate: febră persistentă, astenie, cefalee, hiperemie conjunctivală, dureri toracice, dureri abdominale, artralgii, mialgii, sughițuri. Simptomele respiratorii, cum ar fi tusea, sunt rare. Simptomele neurologice observate în mod obișnuit includ delirul, confuzia, diminuarea conștiinței sau agitația, mai rar, convulsii. În absența rehidratării adecvate apare o letargie severă și prostrație. |
| Șoc | 7–12 zile | Șoc (în 60%): diminuarea conștiinței sau comă, puls rapid filiform, oligurie, anurie, tahipnee. Extremitățile distale sunt reci în ciuda temperaturii ridicate ambiante. Hemoragii gastrointestinale semnificative clinic (melenă, hematemeză) apar la mai puțin de 5% din pacienți înainte de moarte. Moartea subită survine la un procent mic din pacienții care sunt în faza de recuperare din boală, posibil ca urmare al aritmiilor fatale. Cele mai multe decese au loc între zilele 7-12 de la debutul bolii. |
| Convalescență | 7–12 zile | Convalescență (în 40%) la circa 10 zile de la debut: dispariția simptomelor gastrointestinale, creșterea apetitului, toleranța alimentației orale, dispariția fatigabilității. |
| Complicații tardive | ≥10 zile | Hemoragii gastrointestinale, infecții secundare, meningoencefalită, anomalii neurocognitive persistente. Ulcere a cavității bucale și candidoză orală sau esofagiană, asociate cu dureri în gât și disfagie. |
Frecvența (%) simptomelor și semnelor înregistrate la 103 pacienți internați în timpul epidemiei de febra hemoragica Ebola din 1995 în Republica Democrată Congo: [264]
| Simptome și Semne | La 84 pacienți care au decedat, % | La 19 pacienți care au supraviețuit, % | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Simptome | |||||||||
| Astenie | 85 | 95 | |||||||
| Diaree | 86 | 84 | |||||||
| Grețuri și vome | 73 | 68 | |||||||
| Dureri abdominale | 62 | 68 | |||||||
| Cefalee | 52 | 74 | |||||||
| Dureri în gât, odinofagie sau disfagie | 56 | 58 | |||||||
| Artralgii sau mialgii | 50 | 79 | |||||||
| Anorexie | 43 | 47 | |||||||
| Dureri lombare | 12 | 26 | |||||||
| Tuse | 7 | 26 | |||||||
| Dureri toracice | 10 | 5 | |||||||
| Pierderea auzului | 5 | 11 | |||||||
| Tinitus | 1 | 11 | |||||||
| Disestezie | 0 | 5 | |||||||
| Semne nehemoragice | |||||||||
| Febră | 93 | 95 | |||||||
| Congestie conjunctivală | 42 | 47 | |||||||
| Tahipnee | 31 | 0 | |||||||
| Sughițuri | 17 | 5 | |||||||
| Erupții cutanate | 14 | 16 | |||||||
| Anurie | 7 | 0 | |||||||
| Hepatomegalie | 2 | 5 | |||||||
| Splenomegalie | 2 | 5 | |||||||
| Avort | 2 | 5 | |||||||
| Convulsii | 2 | 0 | |||||||
| Semne hemoragice | |||||||||
| Sângerări gingivale | 15 | 0 | |||||||
| Hematemeză | 13 | 0 | |||||||
| Melenă | 8 | 16 | |||||||
| Hematurie | 7 | 16 | |||||||
| Hemoragii în locurile de puncție venoasă | 8 | 5 | |||||||
| Scaune sanguinolente | 7 | 5 | |||||||
| Peteșii | 8 | 0 | |||||||
| Epistaxis | 2 | 0 | |||||||
| Hemoptizie | 0 | 11 | |||||||
| Hematoame | 2 | 0 | |||||||
Date paraclinice și de laborator[modificare | modificare sursă]
Analizele de laborator de bază[modificare | modificare sursă]
Analizele de laborator efectuate la animalele infectate experimental nu prezintă modificări specifice ale parametrilor sanguini.[270][271]
Examenele de laborator arată că infecția cu virusul Ebola sau virusul Marburg este adesea asociată cu o leucopenie precoce și ușoară, limfopenie precoce, urmată de o neutrofilie importantă și o trombocitopenie marcată (<100.000 plachete/mm3).[4][147][148][265]
Anomaliile de agregare plachetară ca prelungirea timpului de protrombină și creșterea derivaților de fibrină în sânge sunt indicatori ai coagulării intravasculare diseminate.[255][265][272]
Nivelele serice ale transaminazelor hepatice, aspartat aminotransferaza (AST) și alanin aminotransferaza (ALT), sunt crescute și caracterizate de un raport AST/ALT crescut, caracteristic (10-3 : 1). Se constată o bilirubinemie peste normal, fosfataza alcalină poate fi crescută sau normală, ca și γ-glutamiltransferaza. În paralel există o hiperproteinemie, proteinurie și o hematurie.[4][147][148][265]
Diagnostic[modificare | modificare sursă]
Diagnostic pozitiv[modificare | modificare sursă]
Diagnosticul de infecție cu virus Ebola trebuie luat în considerare la pacienții care prezintă o afecțiune acută febrilă și care au călătorit în regiuni rurale epidemice cunoscute sau regiuni endemice suspectate din Africa subsahariană, mai ales dacă sunt prezente manifestări hemoragice. Confirmarea suspiciunii de febră hemoragică Ebola este posibilă prin identificarea rapidă a antigenelor virale sau prin izolarea virusului pe culturi de celule. Diagnosticul indirect, serologic, este posibil prin evidențierea anticorpilor IgM și ulterior a anticorpilor IgG.[5]
Definiția de caz de febră hemoragică Ebola[modificare | modificare sursă]
Depistarea precoce este primordială pentru controlul infecției. Personalul medical trebuie să fie atent și să evalueze toți pacienții suspectați de a fi contractat febra hemoragică Ebola (FHE).[273][274]
| Caz suspect (persoană sub supraveghere) | O persoană care prezintă simptomele compatibile precum și factorii de risc următori:
1. Simptome clinice, care includ o febră mai mare de 38,6° și simptome adiționale ca cefalee intensă, mialgii, vome, diaree, dureri abdominale sau hemoragii inexplicabile; ȘI 2. Factori de risc epidemiologici în ultimele 21 de zile înainte de debutul simptomelor ca contactul cu sângele sau alte fluide corporale sau cu rămășițe umane ale unui pacient cunoscut de a avea sau suspectat de a fi contractat FHE; reședința sau călătoria într-o zonă în care transmiterea FHE este activă; sau manipularea directă a liliecilor sau primatelor neumane din zonele endemice. |
| Caz probabil | Întrunește criteriile cazului suspect al cărui factori de risc epidemiologic includ una sau multe expuneri cu risc ridicat sau scăzut (vezi mai jos) |
| Caz confirmat | Un caz confirmat de laborator pentru infecția cu virusul Ebola |
Nivelurile de expunere la risc[modificare | modificare sursă]
Nivelurile de expunere la risc sunt definite după cum urmează:[273][275]
| Expuneri cu risc ridicat | Expunerea cu risc ridicat includ următoarele:
|
| Expuneri cu risc scăzut | O expunerea cu risc scăzut include elementele următoare:
Un contact strâns este definit ca:
Activitățile și interacțiunile de scurtă durată, ca mersul pe lângă o persoană sau deplasările într-un spital nu constituie un contact strâns |
| Nici o expunere cunoscută | Călătoria într-o țară în care o epidemie FHE a avut loc în ultimele 21 de zile fără să fi avut o expunere la risc ridicat sau scăzut. |
Diagnostic de laborator[modificare | modificare sursă]
Toate țesuturile, sângele și serul recoltate în fazele acute ale bolii conțin mari cantități infectante de virus. Trebuie avută o grijă deosebită la recoltarea sau manipularea probelor de sânge, întrucât virusul este stabil timp îndelungat la temperatura camerei. Datorită severității extreme a bolii și riscului de transmitere a bolii prin intermediul sângelui se impune manipularea probelor patologice infecțioase și efectuarea diagnosticului doar în laboratoare cu nivel de siguranță microbiologică 4 (biohazard de nivel 4), ce dispun de dotare tehnică corespunzătoare. Toate acele și seringile trebuie aruncate în containere cu capac, rezistente la perforare, și incinerate.[276][277]
Testele de laborator utilizate în prezent în diagnosticul infecției cu virusul Ebola: [141]
| Testul | Ținta | Produsul prelevat | Observații | ||||||
|---|---|---|---|---|---|---|---|---|---|
| A. Teste primare | |||||||||
| PCR (polymeraze chain reaction), reacția în lanț a polimerazei | Acidul nucleic viral | Sânge, ser, țesuturi | Rapid și sensibil; necesită echipament special | ||||||
| ELISA (Antigen enzyme-linked immunosorbent assay, testul cu enzime legate de imunosorbenți) | Antigenul viral | Sânge, ser, țesuturi | Rapid și sensibil; necesită echipament special, dar are un randament mare | ||||||
| ELISA (captarea de IgM, IgG) | Anticorpii antivirali | Ser | Rapid, specific și sensibil; mai lent decât IFA la testarea unui număr mic de eșantioane | ||||||
| B. Teste de confirmare | |||||||||
| IFA (Indirect immunofluorescence assay, metodă de imunofluorescență indirectă) | Anticorpii antivirali | Ser | Rapid și simplu de efectuat, pot apărea reacții fals pozitive, interpretare subiectivă | ||||||
| Western blot | Anticorpii antivirali | Ser | Protein-specific; interpretarea este uneori dificilă | ||||||
| Imunohistochimie | Antigenul viral | Țesuturi (de ex., piele, ficat) | Lent; necesită eșantioane inactivate | ||||||
| Imunofluorescența | Antigenul viral | Țesuturi (de ex., ficat) | Rapid și simplu, dar interpretarea este subiectivă | ||||||
| Examinare directă la microscopul electronic | Particulele virale | Sânge, țesuturi | Morfologie virală unică (cu o posibilă imunocolorare); insensibil și necesită echipament costisitor | ||||||
| Izolarea virusului | Particulele virale | Sânge, țesuturi | Lent; izolatele virale sunt folosite în cercetări științifice | ||||||
Produse patologice recoltate[modificare | modificare sursă]
Se vor recolta următoarele produse patologice:
- În stadiul acut febril se recoltează ser, plasmă heparinizată, sânge, spălături nazo-faringiene, urină, efuziuni lichidiene acumulate în țesuturi moi, sufuziuni sangvine din țesuturile moi, biopsii cutanate. În cazul febrei hemoragică Ebola produsul patologic optim pentru diagnostic este sângele recoltat în timpul puseelor de febră. Probele de sânge trebuie recoltate fără anticoagulant.[4][147]
- În convalescență se recoltează lichid seminal, secreții oculare, lichid din camera anterioară a ochiului (conjunctivita apare frecvent în a 2-a săptămână de boală).[4][147]
- Postmortem se recoltează pentru izolarea virusului fragmente de organe pentru biopsie din splină, ganglioni limfatici, ficat, rinichi. La autopsie, produsele patologice trebuie recoltate doar de personalul medical experimentat și instruit în privința bolilor infecțioase cu risc maxim de transmitere.[4][147]
După recoltare, produsele patologice (sângele, serul etc.) se transferă în pungi de plastic impermeabile perfect închise cu inscripționări clare și se pun în containere rezistente, care nu permit scurgeri în afară, pentru transportul la un laborator de maximă securitate. Se va avea grijă ca exteriorul recipientelor să nu fie contaminat. Prelevatele vor fi conservate prin înghețare în azot lichid sau zăpadă carbonică la temperatura de -40 °C. Transportul trebuie efectuat în condiții de securitate biologică, conform regulamentelor de transport internaționale sau naționale, după consultarea cu oricare din laboratoarele de referință de maximă securitate.[4][147]
[modificare | modificare sursă]
- Examinare directă la microscopul electronic. În epidemiile produse de filoviride, examinare directă la microscopul electronic s-a dovedit utilă pentru identificarea virusurilor Marburg sau Ebola în fluidele și țesuturile organismului și în supernatantul culturilor celulare. În timpul epizootiei cu virus Reston, microscopia imunoelectronică, utilizată în asociere cu microscopia de transmisie standard (TEM) a celulelor infectate, a furnizat rezultate concludente. Cu toate acestea, tehnica nu poate diferenția speciile de filoviride. Virionii sunt vizualizați la microscopul electronic prin colorație negativă a probelor de sânge heparinizat și urină provenite de la bolnavi sau a lichidelor de culturi infectate și pe secțiuni ultrasubțiri de organe. Morfologia particulelor virale este caracteristică pentru diagnosticul de filovirus. Prin microscopie electronică a fost demonstrată prezența virusurilor Marburg sau Ebola în țesuturile maimuțelor, atât în epidemii, cât și experimental.[4][147][278][279][280]
- Antigenele virale. În izbucnirile epidemice se utilizează diagnosticul direct rapid prin evidențierea antigenelor virale. Antigenele virale sunt detectate pe amprente de sânge, sediment urinar sau amprente de organe prin imunofluorescență directă sau pe secțiuni de țesuturi bioptice fixate cu formol, prin imunohistochimie cu metode de colorare cu streptavidin-biotină și anticorpi monoclonali. Anticorpii monoclonali de șoarece, cu care s-a căptușit o suprafață solidă de plastic, captează antigenul Ebola prezent în probele de țesut sau sânge. Rezultate foarte bune s-au obținut prin aplicarea acestor metode la biopsii de tegument fixate cu formol. Preparatele de tegument relevă leziuni specifice histopatologice (edem dermic, extravazare eritrocitară, necroza endoteliilor etc.) și au avantajul că, prin fixare, infecțiozitatea este anihilată.[4][147][281][282]
- Genomul viral. Genomul viral este detectat în țesuturi infectate prin hibridizare in situ, cu sonde având secvențe ale genelor NP, GP, VP30 și VP35 (această tehnica nu este aplicată în mod curent) sau prin polimerizare în lanț cu revers-transcriptază (RT-PCR) pe probe de sânge de la bolnav, care este la fel de sensibilă ca și izolarea virusului, cu avantajul confirmării rapide a diagnosticului. Utilizarea sondelor cu reactivitate încrucișată și a celor cu specificitate de specie virală pentru reacția RT-PCR s-a dovedit deosebit de promițătoare ca instrument de diagnostic precoce al infecțiilor cu filovirusuri.[4][147][283]
Culturi de celule[modificare | modificare sursă]
Virusul Ebola poate fi izolat cu ușurință prin inocularea probelor de sânge sau ser recoltate în fazele acute ale bolii, proaspete sau depozitate (- 70 °C), pe culturi de celule Vero de țesut renal de maimuță. Liniile de celule Vero (mai ales clona E6) și MA-104 s-au dovedit cele mai sensibile și utile tipuri celulare pentru propagarea și testarea izolatelor proaspete și pentru pasajul în laborator al speciilor de filovirusuri. Linia de celule Vero este sensibilă atât pentru virusul Marburg, cât și pentru virusul Ebola, iar linia MA-104, de rinichi fetal de maimuță Rhesus, ca și linia celulară SW-13, pentru ebolavirusulul Sudan și ebolavirusulul Zair. Mai puțin susceptibile sunt linia BHK-21 și culturile diploide MRC5.[4][147]
Efectul citopatic apare de obicei la intervale de 2-7 zile, dar în majoritatea cazurilor sunt necesare pentru exprimarea acestuia pasaje oarbe. Izolarea primară prin utilizarea culturilor celulare produce rareori un efect citopatic specific, astfel încât dovezile de infecție se bazează pe apariția incluziilor citoplasmatice, evidențiate prin imunofluorescență la 2-5 zile după inoculare, utilizând antiser policlonal sau anticorpi monoclonali specifici pentru specia virală. Antigenele virale se identifică prin imunofluorescență directă în monostraturile celulare, iar în lichidele de cultură prin ELISA de captură sau RT-PCR; mai rar prin RFC, iar virusul prin microscopie electronică.[4][147]
Unele specii virale, cum ar fi ebolavirusulul Sudan, sunt dificil de cultivat pe culturi primare, reușita fiind ameliorată prin inocularea intraperitoneală la cobaii tineri. Cobaiul inoculat intraperitoneal răspunde printr-o reacție febrilă, iar după treceri repetate dezvoltă boala cu sfârșit letal. Virusul se evidențiază în sângele și organele cobaiului prin microscopie electronică și prezență de anticorpi. Șoarecele nou-născut inoculat intracerebral este susceptibil numai la infecția cu ebolavirusulul Zair.[4][147]
Inocularea animalelor în scop diagnostic se va face numai dacă izolarea în culturi nu este posibilă și dacă există condiții corespunzătoare de păstrare a animalelor infectate, fără riscuri ulterioare de contaminare.[4]
Diagnostic serologic[modificare | modificare sursă]
Pentru efectuarea testelor seroimunologice, serul poate fi manipulat în siguranță după inactivare prin iradiere sau încălzire la 60 °C timp de 30 minute. Anticorpii sunt absenți în cazurile severe decedate rapid, astfel încât diagnosticul serologic este utilizat ca test primar sau în convalescență. La pacienții care supraviețuiesc îmbolnăvirii se constată prezența anticorpilor, evidențiată prin:[4][147]
- Imunofluorescență (IF) - un test diagnostic fundamental pentru infecțiile cu filovirusuri și singurul unanim acceptat pentru diagnosticul infecției umane cu virus Ebola. Se folosește imunofluorescența indirectă, considerată test de elecție, începând din a 10-a zi de la debut. Infecția recentă se atestă prin: demonstrarea creșterii titrurilor pe specimene duble de ser recoltate la debut și în convalescență sau pe o singură probă de ser având anticorpi IgM specifici cu titru mai mare de 1/256. Când se utilizează imunofluorescența, problema reacțiilor fals pozitive cu titru scăzut face dificilă interpretarea testului atunci când se întreprind anchete seroepidemiologice ale primatelor și oamenilor. Imunofluorescența indirectă, deși folosită în mod curent, ridică probleme de reproductibilitate privind interpretarea subiectivă a titrului limită pozitiv.
- ELISA (enzyme-linked immunosorbent assay) se utilizează pentru detectarea anticorpilor IgM și IgG și are o specificitate înaltă și se pretează la aplicare în investigații serologice rapide din izbucniri epidemice. Creșterea titrului anticorpilor în serurile pereche sau un titru înalt al anticorpilor IgG (> 64) și prezența anticorpilor tip IgM, împreună cu simptome clinice compatibile cu o febră hemoragică, susțin diagnosticul.
- Western-blot, care relevă benzi pozitive pentru proteinele virale NP, VP30 și VP24, este considerat test de confirmare a diagnosticului și nu este folosit de rutină.
- RIA (radioimmunoassay) este, de asemenea, un test de confirmare, dar nu se aplică în mod curent.
Testele diagnostice rapide[modificare | modificare sursă]
Întreruperea lanțurilor de transmitere a virusului Ebola este foarte mult tributară de sprijinul laboratoarelor. Acest sprijin este necesar pentru a confirma sau infirma cazurile suspecte, a ghida triajul cazurilor și a deciziilor clinice, a ajuta investigațiile contactaților și a facilita depistarea precoce a persoanelor cu antecedente de expunere. Obiectivele OMS pentru depistarea energică a cazurilor și izolarea riguroasă a lor depinde de asemenea de suportul laboratoarelor. Eforturile de a stăpâni epidemiile de Ebola din Africa de Vest sunt în prezent frânate de testele diagnostice complexe, lente și greoaie, sursa unui număr de probleme logistice suplimentare, inclusiv exigențele unei securități biologice maxime în laboratoare și a unui personal competent pentru a folosi utilajele sofisticate din laborator. Testele moleculare standard utilizate în prezent în laboratoarele mobile și alte laboratoare pentru identificarea virusurilor Ebola includ testul RT-PCR (reverse-transcriptase polymerase chain reaction, reacția de polimerizarea în lanț cu revers-transcriptază). Acest test care folosește proceduri laborioase, dar furnizează rezultate extrem de precise atunci când este efectuat de un personal calificat. Fiecare test necesită un tub plin cu sânge și 2-6 ore pentru executare și costă aproximativ 100 dolari. Aceste cerințe sunt dificil de îndeplinit în unele țări din Africa de Vest ale căror resurse sunt foarte restrânse și limitează sever efectuarea acestor analize.[284]
Timpul pierdut pentru transportul eșantioanelor provenite de la pacienți pe drumurile proaste permit accesul la un număr mic de laboratoare disponibile în Africa de Vest și în consecință pacienții și familiile lor trebuie să aștepte cu neliniște câteva zile pentru a cunoaște rezultatele testelor. Această pierdere de timp înseamnă că persoanele infectate vor rămâne în comunitate, cu un risc crescut de a transmite virusul la alte persoane, fără a fi conștiente de acest fapt. În plus, în lipsa unui suport de laborator analitic rapid, persoanele purtătoare a altor boli infecțioase curente, cum ar fi malaria și febra denga, care au primele simptome similare cu cele din febra hemoragică Ebola, pot fi izolate în mod nejustificat într-un centru de "tranzit" pentru Ebola ca o măsură de precauție. Dacă ei nu sunt atinși de febra hemoragică Ebola atunci când ei intră în acest centru, pot, din nefericire, s-o contractează în interiorul acestor centre. Mai mult, pacienții nediagnosticați și fără asistență medicală reprezintă un risc serios pentru familia lor și comunitate și contribuie la schema de transmitere ciclică a infecției observată în prezent, în care cazurile încep să scadă dacă măsurile de luptă au efect, pentru a crește din nou dacă apar noi lanțuri de transmitere a infecției.[284]
OMS a stabilit un profil detaliat al testului diagnostic "ideal", care trebuie să fie rapid, sensibil, sigur și simplu. Testul ideal trebuie să fie potrivit pentru utilizarea în centrele de sănătate periferice, lipsite de o infrastructură de laborator. Procedurile testării trebuie să aibă mai puțin de 3 etape, să ofere rezultate în mai puțin de 30 de minute și să nu impună exigențe în ceea ce privește securitatea biologică dincolo de purtarea echipamentului de protecție individual. Cerințele operaționale suplimentare impun o facilitate a conservării și reconstituirii reactivilor și o perioadă a formării a personalului care să nu depășească o jumătate de zi. Testul ideal și echipamentul portabil asociat nu trebuie să necesite alimentare cu energie electrică și întreținere.[284]
Șaisprezece dosare documentare pentru testele diagnostice rapide au fost primite de către OMS la mijlocul lunii octombrie 2014 pentru evaluare. Ele includ kituri de diagnostic de tipul RT-PCR clasice, sisteme de PCR automatizate de un computer de birou cu procesarea integrată a eșantioanelor și teste noi capabile să detecteze o infecție cu virusul Ebola în timp de câteva minute pe un eșantion de sânge prelevat prin înțeparea degetului în locul unei eprubete pline cu sânge.[284]
Pe 20 februarie 2015 OMS a aprobat primul test pentru depistarea rapidă a infecției cu virusul Ebola - ReEBOV™ Antigen Rapid Test.[285][286][287] Testul a fost realizat de către o companie americană, Corgenix Medical Corp. Acest test este mai puțin precis decât metodele clasice de depistare a virusului Ebola, însă este mult mai ușor de utilizat, nu necesită alimentare cu curent electric, poate oferi rezultatul în mai puțin de 15 minute, necesită o mostră minimă de sânge aplicată pe o bandeletă de hârtie specială (dipstick) și poate identifica aproximativ 92% dintre pacienții infectați cu Ebola și 85% dintre cei care nu aveau acest virus în sânge. Testul rapid cu antigen ReEBOV se efectuează ca un test imunologic cu bandeletă (dipstick). El detectează prezența antigenului viral EBOV VP40 nativ (adică a proteinei matriceală VP40) în serul, plasma sau sângele integral a pacienților suspectați de a fi contractat febra hemoragică Ebola cu ajutorul anticorpilor specifici EBOV VP40, care sunt niște anticorpi policlonali caprini purificați prin afinitate, impregnați o pe membrană de nitroceluloză și conjugați cu nanoparticule de aur.[288]
Diagnostic diferențial[modificare | modificare sursă]
Afecțiunile produse de virusurile Marburg (febra hemoragică Marburg) și Ebola (febra hemoragică Ebola) nu pot fi practic diferențiate clinic.
Întrucât diagnosticul diferențial în faza acută inițială este dificil, trebuie luate în considerare alte cauze. Cele mai frecvente cauze de infecții evoluând ca o afecțiune febrilă acută, severă, sunt malaria și febra tifoidă. În consecință, diagnosticul diferențial și tratamentul precoce nu trebuie amânate. Cauzele alternative includ afecțiuni bacteriene, cum ar fi septicemia meningococică (meningita meningococică), infecția cu Yersinia pestis (pesta), holera, shigeloza, leptospiroza, antraxul, febra recurentă, rickettsiozele, cum ar fi tifosul exantematic și tifosul murin, și afecțiuni virale, ca febra pappataci, febra galbenă, febra de Chikungunya, febra Văii de Rift, infecțiile cu hantavirusuri, febra hemoragică de Crimeea-Congo, hepatita.[2][147][148]
Prognostic[modificare | modificare sursă]
Prognosticul pentru pacienții cu infecția cu virusul Ebola este nefavorabil. Cei care supraviețuiesc timp de 2 săptămâni au o convalescență îndelungată (câteva săptămâni sau luni) și dificilă.[2][4][147][148]
Cu excepția speciei Reston, virusul Ebola este asociat cu o morbiditate și mortalitate foarte mare printre pacienții care prezintă boală clinică, deși acestea variază în funcție de specia virusului Ebola. Cea mai letală specie a virusului Ebola este ebolavirusul Zair, care are o mortalitate de până la 90%. Ebolavirusul Sudan are, de asemenea, o mortalitate ridicată, variind de la 41% la 65%.[289]
Tratament[modificare | modificare sursă]
Tratamentul se limitează la tratamentul suportiv care constă în primul rând în menținerea constantă a volemiei, echilibrului electrolitic, combaterea hemoragiilor, a insuficienței renale, edemului cerebral, suprainfecțiilor bacteriene, hipoxiei și a șocului.[290]
Administrarea unui factor VIIa/TF inhibitor al căii TF (= factor tisular), sau de proteină C activată recombinantă permite activarea căii anticoagulante a proteinei C naturale, sau administrarea de mici catene ARN interferente sau de oligonucleotide antisens pentru a inhiba replicarea virală, au avut rezultate promițătoare.[256][291][292][293][294][295]
Nu există tratament omologat antiviral specific împotriva acestei boli. Ribavirin nu are efect asupra filovirusurilor, iar administrarea IFN (interferonul uman) nu a dat rezultate consistente nici în boala experimentală a maimuțelor, nici la pacienți.[141]
Tratamentul simptomatic[modificare | modificare sursă]
Conform Organizației Mondiale a Sănătății se va efectua următorul tratament simptomatic:[296]
| Simptom | Medicament | Doza |
|---|---|---|
| Grețuri, vome | Ondansetron |
|
| Diaree, deshidratare | Soluție pentru rehidratare orală și zinc | Soluție pentru rehidratare orală (formula recomandata de OMS). Cantitățile respective se consumă în decurs de 4 ore. În fazele inițiale ale tratamentului, când pacienții sunt încă deshidratați, adulții pot consuma până la 750 de ml pe oră, iar copiii pot consuma până la 20 ml pe kg greutate corporală și pe oră.
În plus, se administrează sulfat de zinc, în special copiilor:
|
| Dureri sau febră | Paracetamol | Doza se stabilește în funcție de vârsta și greutatea pacientului. Doza recomandată pentru o dată este de 15 mg paracetamol/kg.
|
| Dureri epigastrice | Omeprazol | O dată pe zi înainte de masă
|
| Roșeața ochilor (congestie conjunctivală), secreție oculară | Tetraciclină | Unguent ocular pentru aplicare topică |
| Agitație, confuzie | Diazepam | 2 – 5 mg per doză, până la 3 doze pe zi |
Medicamente experimentale[modificare | modificare sursă]
Febra hemoragică Ebola nu a fost niciodată o prioritate până în prezent pentru companiile farmaceutice, deoarece această boală, foarte letală, era rară și se limita la țările sărace din Africa. "Probabil că nu este un lucru foarte greu fabricarea unui vaccin împotriva febrei hemoragice Ebola, dar nu există nici un interes comercial, deoarece guvernele nu își pot permite să le cumpere", declara profesorul Didier Raoult, specialist în boli infecțioase emergente de la Facultatea de Medicina din Marsilia.[297]
Elaborarea unor tratamente eficiente noi pentru febra hemoragică Ebola este în prezent obiectul unor cercetări intense, motivate în special de gravitatea bolii, mortalitatea extrem de înaltă, extinderea rapidă a epidemiei din 2014 și riscurile utilizării virusului Ebola ca armă biologică sau în bioterorism. Moleculele candidate pentru tratament sunt variate și adesea promițătoare pe modelele animale, dar sunt încă în stadiul experimental și câteva dintre ele au ajuns în stadiul de studii clinice pe voluntari. Dificultatea majoră, în afară de crearea de noi tratamente și protecția lor care trebuie șă fie eficientă, fără efecte secundare inacceptabile, constă în necesitatea de a dezvolta molecule care pot fi transportate și stocate în zonele epidemice, mai ales în Africa ecuatorială; aceste dificultăți se referă în special la tratamentele elaborate pe bază de acizi nucleici, ca ARN interferenți mici, care sunt molecule instabile. Mai multe medicamente experimentale pot fi aprobate pentru tratarea febrei hemoragice Ebola la om.[258][298][299][300][301][302][303][304][305][306]
- Seroterapia constă în transfuziile de ser, care conține IgG anti-EBOV, pacienților cu febra hemoragică Ebola luat de la persoanele vindecate de această boală. Având în vedere caracterul urgent al situației din Africa și a lipsei unui tratament eficient împotriva febrei hemoragice Ebola, Organizația Mondială a Sănătății (OMS) a încurajat seroterapia și transfuziile de sânge integral pe 5 septembrie 2014 la o ședință din Geneva la care au participat aproape 200 de experți.[298] Între 6 și 22 iunie 1995, 8 pacienți din Kikwit, Republica Democrată Congo, care erau bolnavi de febră hemoragică Ebola, au fost transfuzați cu sânge donat de 5 pacienți convalescenți. Sângele donat conținea anticorpi IgG anti-EBOV, dar nici un antigen EBOV. Antigenele EBOV au fost detectate la toți primitorii de transfuzii sanguine chiar înainte de transfuzie. Cei 8 pacienți transfuzați aveau simptome clinice similare cu cele ale altor pacienți bolnavi de febră hemoragică Ebola. Toți erau în stare gravă cu astenie severă, 4 prezentau manifestări hemoragice, iar 2 au devenit comatoși în faza avansată a bolii. Din cei 8 pacienți transfuzați 7 s-au însănătoșit doar un singur pacient a decedat (12,5%); acest număr este semnificativ mai mic față de nivelul mortalității globale (80%) pentru epidemia Ebola din Kikwit și față de nivelul mortalității în alte epidemii Ebola. Cauza acestui nivel de mortalitate scăzut rămâne de explicat. Pacienții transfuzați nu au primit îngrijiri mai bune decât cele din faza inițială a epidemiei. Din păcate, ipoteza beneficiului seroterapiei nu a fost confirmată prin studii ulterioare. Când a fost testată această ipoteză într-un laborator, transfuzând sângele animalelor convalescente animalelor infectate cu virusul Ebola, toate animalele transfuzate au murit.[290][307][308][309] Medicul american Rick Sacra, 51 de ani, infectat în 2014 cu virusul Ebola în Liberia, unde lucra în cadrul unei organizații caritative creștine, a fost internat la un spital din Omaha în Nebraska (SUA) și s-a vindecat. Vindecarea s-ar putea explica prin două transfuzii de plasmă sanguină de la colegul său de la organizația caritativă "Samaritan's Purse", doctorul Kent Brantly, care s-a vindecat de infecție. Brantly s-a contaminat tot în Liberia, fiind transferat în Statele Unite. În afara transfuziilor de sânge, Rick Sacra a fost supus și unui tratament experimental cu TKM-Ebola.[310][311]
- Un studiu din 1998 a arătat că analogii adenozinei carbociclice (3-deazaadenozina carbociclică), funcționează ca inhibitori al SAH (S-adenozil-homocisteinhidrolaza sau adenozilhomocisteinaza) și au fost utilizați în tratarea infecției experimentale cu doze letale de virus Ebola la șoarece, cu rezultate promițătoare: supraviețuire până la 90% când tratamentul a început după 2 zile de la infecție și de 40%, după 3 zile.[312][313]
- Două studii publicate în primăvara anului 2014 au arătat că antiviralul favipiravir (T-705) (comercializat ca Avigan), un inhibitor al ARN-polimerazei ARN-dependente, utilizat experimental împotriva virusurilor ARN (inclusiv virusul gripal), a fost eficace la șoarecii infectați cu virusul Ebola, chiar dacă a fost administrat la șase zile după expunerea la virus.[314][315] Favipiravirul a fost produs de compania japoneză Toyama Chemical, o filială a Fujifilm cu sediul la Tokyo, și este un tratament posibil al febrei hemoragice Ebola din Africa de Vest.[316][317]
- Brincidofovirul (CMX001) este un antiviral oral dezvoltat de Chimerix, o companie biofarmaceutică americană. El este un analog nucleotidic cu un spectru antiviral larg in vitro împotriva a cinci familii de virusuri ADN care afectează oamenii, inclusiv cei din familia herpesviride și adenoviride. Acest tratament este în studiu clinic de faza 3 ca antiviral împotriva adenovirusurilor și citomegalovirusurilor. Brincidofovirul a fost testat numai în laborator împotriva virusului Ebola. El blochează virusul împiedicându-l să se înmulțească. Thomas Eric Duncan, primul pacient diagnosticat cu Ebola în SUA, a fost tratat cu brincidofovir, însă el a murit pe 8 octombrie 2014, la un spital din Dallas.[318][319][320] La studiul brincidofovirului participă și Diana Florescu, specialist român în boli infecțioase de la Nebraska Medical Center, SUA.[321][322]
- BCX4430 este un nucleozid, produs de BioCryst Pharmaceuticals, cu un spectru larg de activități antivirale (inclusiv virusul Ebola) care acționează ca un inhibitor al ARN polimerazei ARN-dependente (sau ARN replicazei) - o enzimă indispensabilă pentru replicarea virusurilor ARN cu polaritate negativă fără etapa ADN. Aceasta previne astfel transcripția și replicarea genomului viral. Acest tratament a beneficiat de o finanțare de 22 milioane dolari de la Institutul Național de Alergie și Boli Infecțioase (NIAID) în septembrie 2013, reevaluat la 26 de milioane în septembrie 2014. Testele pe animale au arătat o rată de supraviețuire de 83-100% la șoareci. Testările clinice de faza 1 pe oameni sunt planificate pentru sfârșitul anului 2014/începutul anului 2015. BioCryst Pharmaceuticals este o companie cu sediul în Durham, Carolina de Nord, specializată în producția de medicamente pentru tratamentul bolilor orfane, bolilor autoimune și medicamentelor antivirale. Ea este mai cunoscută pentru dezvoltarea unui antiviral, Peramivir, autorizat de FDA pentru utilizare de urgență împotriva virusului gripal H1N1.[323][324][325][326]
- ZMapp, un amestec de trei anticorpi monoclonali anti-Ebola umanizați (anticorpii c13C6 + c2G4 + c4G7) produși în Nicotiana benthamiana (o specie de tutun) a fost testat în 2012, cu rezultate bune pe maimuțele rhesus (Macaca mulatta).[327][328][329][330] ZMapp, produs de companie californiană Mapp BioPharmaceutical cu sediul în San Diego, a fost administrat pentru prima dată pe 31 iulie 2014 în Liberia unui om, Kent Brantly, un medic american care lucra pentru o organizație de caritate creștină Samaritan's Purse, la care au apărut la 22 iulie simptoamele febrei hemoragice Ebola; colega lui Nancy Writebol contaminată, de asemenea, cu virusul Ebola a primit două doze de acest tratament experimental pe 3 și 4 august.[331] Cei doi americani au fost repatriați în următoarele zile la Spitalul Universitar Emory din Atlanta pentru a fi supravegheați în colaborare cu CDC. Ambii pacienți americani tratați cu ZMapp au părăsit spitalul vindecați pe 21 august.[332] Cu toate acestea, preotul spaniol Miguel Pajares, în vârstă de 75 de ani, care a primit, de asemenea, acest tratament experimental, a murit pe 12 august în spitalul Carlos III din Madrid, unde a fost repatriat cu cinci zile mai devreme din Liberia, o țară în care el a contractat boala efectuând o misiune din partea unei ONG.[333] Ca urmare a mediatizării internaționale oferit de acest tratament, s-au ridicat voci pentru a impune utilizarea acestui medicament pe o scară mai mare,[334] constrângând autoritățile americane pentru a permite utilizarea sa în Liberia de la 11 august,[335] cu toate că Barack Obama a spus cu patru zile mai înainte că această opțiune ar fi prematură.[336] OMS a autorizat pe 12 august utilizarea medicamentelor experimentale în epidemia de Ebola din 2014 numai în anumite condiții,[337] deschizând calea pentru concurență între companiile farmaceutice pe o piață nouă.[338]
- TKM-Ebola este un ARN interferent mic (ARNsi) care inhibă expresia genelor virale L (ARN-polimeraza), VP24 și VP35 ale virusului Ebola Zair.[339] În ianuarie 2014, Tekmira a inceput un studiu clinic de faza I a TKM-Ebola pentru a evalua siguranța lui la persoanele sănătoase. FDA a oprit studiul clinic în iulie 2014, pentru a evalua rezultatele, după ce unii voluntari au avut simptome asemanatoare gripei. Pe 7 august FDA a anulat parțial întreruperea testărilor clinice, permițând utilizarea sa eventuală ca tratament în epidemia din Africa de Vest.[340][341][342]
- AVI-7537, AVI-6002 și AVI-6003 produse de Sarepta Therapeutics, sunt oligonucleotide morfolino fosforodiamidate (niște oligonucleotide antisens) cu sarcini pozitive (PMOplus®) care se leagă de ARNm-ul viral pentru a inhiba sinteza proteinelor virale și astfel întrerup replicarea virală. Testele pe animale au aratat un nivelul ridicat de supraviețuire între 60% și 80% la primate. 20-25 de doze vor fi disponibile la mijlocul lunii octombrie 2014 pentru a fi eventual testate pe pacienții infectați. O producție de 100 de doze este prevăzută pentru începutul anului 2015. Sarepta Therapeutics este o companie cu sediul în Cambridge. În 2010, un contract de 291 milioane dolari a fost alocat de către Pentagon pentru dezvoltarea unor tratamente în lupta împotriva virusilor Marburg și Ebola. Cu toate acestea, programul a fost oprit în 2012 din cauza restricțiilor bugetare. Compania a primit doar 80 milioane de dolari, și a fost nevoită să anuleze un studiu clinic pentru a testa inocuitatea, tolerabilitatea și farmacocinetica medicamentului AVI-7537 pe pacienții sănătoși care au fost programate pentru august 2012.[343][344][345][346][347][348]
- Alte medicamente care avut o activitate promițătoare împotriva virusului Ebola in vitro sau la șoarecii infectați cu virusul Ebola, dar pentru care sunt necesare date suplimentare înainte de a trece la studiile clinice, includ:
- Blocante ale canalelor ionice (amiodarona, dronedarona și verapamil) inhibă intrarea virusului Ebola în celulă.
- Modulatori ai receptorilor estrogenici (clomifenul și toremifenul), inhibă intrarea virusului Ebola în celulă la șoareci infectați.
- Clorochina este un medicament antimalaric care poate inhiba intrarea virusului Ebola în celule gazdă.
- Inhibitorii protein kinazei (erlotinib, sunitinib), azitromicina, sertralina.
Medicamentele experimentale pentru tratamentul febrei hemoragice Ebola: [304][305]
| Medicamentul / Compania producătoare | Categoria medicamentului | Acțiune împotriva virusului Ebola, date preclinice | Probleme de siguranță | Disponibilitate și considerații logistice | Comentarii |
|---|---|---|---|---|---|
| Favipiravir (Fuji/Toyama Japonia) | Analog nucleozidic antiviral cu moleculă mică. Are un larg spectru de activitate antivirală împotriva mai multor virusuri ARN. Acționează ca un inhibitor al ARN polimerazei ARN-dependente interferând cu ARN viral. Aprobat în Japonia pentru tratarea pandemiei de gripa (H5N1). | Concentrația inhibitorie 50% (CI50) in vitro este de 64 µM, mai mare decât cea necesară pentru virusul gripal.
Șoarecii sunt protejați la o doză de 300 mg/kg. La primatele neumane (NHP) este observat un efect antiviral, cu o reducere cu 2 log a viremiei. Testările pe primate sunt limitate din cauza anestezierii frecvente a lor pentru a putea fi administrat medicamentul pe cale orală. |
Utilizarea clinică la voluntarii sănătoși a unor doze de până la 3,6 g în prima zi, urmată de 800 mg de două ori pe zi. Nu au fost identificate probleme de siguranță. Dozele mari de medicamente pot cauza o disfuncție hepatică | Comprimate de 200 mg; doza inițială de 6 g în prima zi necesită 30 comprimate - posibil greu de înghițit. Sunt disponibile 1,6 milioane de comprimate (pentru 10.000 cure de tratament). Termostabil. | 4 pacienți au primit medicamentul în condiții de utilizare compasională. Nu au fost trase încă concluzii asupra eficacității lui la acești pacienți, dar nu au fost identificate probleme evidente de siguranță.
Studiile clinice a eficacității au început în Guineea în decembrie 2014. Doza țintă a fost de 6 g (în prima zi), urmată de o doză de 2,4 g pe zi (în a 2-10 zi). |
| Brincidofovir (Chimerix, SUA) | Analog nucleotidic antiviral cu moleculă mică cu activitate împotriva virușilor ADN dublu catenar. A fost dezvoltat și utilizat pentru tratamentul infecțiilor cu citomegalovirus. Teoretic, nu ar trebui să acționeze împotriva virusului Ebola (virus ARN), însă modul de acțiune poate fi diferit de cel împotriva virusurilor ADN. | Concentrația inhibitorie 50% (CI50) in vitro variază în funcție de test de la 120nM la 1,3 µM, considerată a fi o concentrație ușor realizabilă clinic. Indicele de selectivitate 290.
La șoareci nu a fost observat nici un beneficiu terapeutic în două studii separate, însă farmacocinetica nu a fost studiată și, prin urmare, nu se cunoaște dacă concentrație eficientă a fost atinsă. La primatele neumane, macacul Rhesus, testările nu sunt practicabile din cauza profilului farmacocinetic. La cobai este planificat un studiu pentru a determina farmacocinetica și eficacitatea. |
A fost testat la > 1000 de pacienți: principale reacții adverse sunt cele gastrointestinale și creșterile AST/ALT | Este disponibil pentru administrare orală sub formă de comprimate de 100 mg și suspensie orală 10 g/ml. Doza de încărcare inițială de 200 mg (sau 4 mg/kg) pe cale orală, urmată de 100 mg (sau 2 mg/kg) de două ori pe săptămână pentru un total de 14 zile (5 doze în total). Sunt disponibile 22.000 de comprimate de 100 mg (pentru > 3.500 de cure de tratament). Termostabil. | 5 pacienți au primit medicamentul în condiții de utilizare compasională. Nu au fost observate efecte secundare majore, doar unele modificări de laborator ale numărului de leucocite în sânge, ale bilirubinei și fosfatazei alcaline. Nu au fost trase concluzii în caz de administrarea concomitentă a altor medicamente experimentale anti-Ebola.
Studiile clinice ale eficacității au început în ianuarie 2015 în Liberia. Monitorizarea datelor preclinice suplimentare sunt în curs de desfășurare. |
| BCX-4430 (Biocryst, SUA) | Analog nucleozidic antiviral cu acțiune directă și spectru larg de activitate antivirală. Acționează ca un inhibitor al ARN polimerazei ARN-dependente | La primatele neumane infectate cu virusul Marburg asigură o protecție de 80-100% în doze de 15 mg/kg administrate la 1, 24, sau 48 de ore de la infectare.
La primatele neumane infectate cu virusul Ebola este eficient când este administrat la 30-120 de minute după infectare. Nu este eficient dacă se administrează la 48-72 de ore după infectare. La șoareci asigură o protecție 100% anti-Ebola. |
S-au inițiat studii de siguranță de faza I. Rezultatele sunt așteptate la începutul anului 2015 | Se administrează intramuscular sau intravenos. Cantitatea actuală de medicament oferită de producător este limitată pentru studii clinice. Un stoc pentru > 1000 de pacienți va fi disponibil în mai 2015. | Studiile de siguranță de faza I sunt în curs de desfășurare. Nu sunt încă planificate studii asupra eficacității. Sunt așteptate datele de siguranță din faza I. |
| TKM-100802 (Tekmira, Canada) | Este un ARN interferent mic care inhibă expresia ARN-polimerazei L virale și a proteinei virale VP35 și astfel reprimă replicarea virusului Ebola Zair în interiorul celulei. | TKM-100802 a fost studiat la primatele neumane infectate cu tulpina Kikwit a virusului EBOV (EBOV-k). Produsul disponibil în prezent nu este optimizat pentru utilizarea împotriva tulpinii EBOV-Guineea (EBOV-g), responsabilă de epidemia actuală de Ebola din Africa de Vest. La primatele neumane are o eficacitate de 67-100% administrat în 4-7 doze dacă tratamentul este inițiat la 30 minute postexpunere. | Un studiu de siguranță de faza I a arătat că apar reacții adverse legate de doze mari, inclusiv amețeli, senzație de apăsare în piept, ritm cardiac crescut. Dozele mai mici au fost bine tolerate. Un studiu la voluntarii sănătoși este în suspendare clinică parțială | Doza recomandată de companie este de 0,3 mg/kg pe zi, administrat în perfuzie intravenoasă timp de aproximativ 60 de minute. Câteva sute de doze sunt disponibile în prezent. Mai multe mii de doze ar putea fi disponibile într-o perioada scurtă de timp. Necesită refrigerare. | 6 pacienți au primit medicamentul în condiții de utilizare compasională. Nu au fost trase concluzii asupra eficacității posibile. Hipotensiunea observată la unii pacienți este probabil cauzată de administrarea medicamentului. Studiile clinice de eficacitate urmează să înceapă la începutul anului 2015. |
| AVI-7537 (Sarepta, SUA) | Oligonucleotidă morfolino-fosforodiamidată antisens. Inhiba replicarea virusului Ebola prin legarea de ARN viral din gena proteinei VP24. Este specifică pentru secvența tulpinii virusului Ebola care circulă în epidemia curentă din Africa de Vest. | La primatele neumane infectate cu virusul Marburg asigură o supraviețuire de 100% (folosind secvența Marburg), iar la cele infectate cu virusul Ebola asigură o supraviețuire de 50-60% (folosind secvența Ebola). | Studiile de siguranță din faza I s-au încheiat. AVI-7537 a fost în general bine tolerat. | Se administrează intravenos în doze de 16 mg/kg/zi timp de 14 zile. Sunt disponibile un număr limitat de doze. | Nu sunt planificate în acest moment studii clinice. |
Mutațiile și rezistența la tratament[modificare | modificare sursă]
Impactul mutațiile genomice ale virusului Ebola asupra eficienței tratamentelor experimentale ce conțin secvențele virusului Ebola a fost evaluat într-un studiu recent publicat de cercetători de la Harvard, Maryland și MIT în mBio, la 20 ianuarie 2015. ARN-ul interferent mic (SiARN) și oligomerii morfolino-fosforodiamidați (OMF) țintesc transcrierea genelor L, VP24 și/sau V35 ale genomului EBOV, iar imunoterapia pasivă bazată pe anticorpi sau pe un cocktail de anticorpi (ZMapp) au ca ținta epitopii EBOV. Ei inhibă pe termen scurt replicarea virusului: SiARN țintește transcrierile virale pentru degradare, OMF blochează translarea, iar imunoterapie pasivă neutralizează virusul, permițând gazdei să producă un răspuns imun eficient împotriva patogenului viral. Zece mutații ale virusului Ebola au modificat secvența siturilor de legare a anticorpilor monoclonali: (MAb) 13F6, MAb 1H3, MAb 6D8, MAb 13C6 si a țintelor SiARN EK-1, VP24 și VP35. Unele mutații pot avea un impact negativ asupra eficienței agenților terapeutici experimentali. Siturile de legare pentru agenții terapeutici experimentali bazați pe SiARN și OMF au fost create cu ajutorul unor secvențe virale derivate din tulpina Ebolavirusului Zair (EBOV) care a cauzat epidemia de Ebola din Zair (Congo) în 1976 . De atunci virusul Ebola s-a schimbat și continuă să se schimbe. Anticorpii monoclonali folosiți pentru imunoterapia pasivă din ZMapp au fost creați cu ajutorul glicoproteinei tulpinii EBOV care a produs epidemia de Ebola din Kikwit în 1995. Virusul utilizat pentru testarea eficienței tratamentelor în studiile postexpunere, a fost cel care a provocat epidemia din Kikwit. Epidemia de febră hemoragică Ebola din Africa de Vest din 2014-2015 a fost provocată de tulpina Makona a virusului Ebola (EBOV/Mak). Între tulpina actuală Makona a virusului Ebola și cea din Kikwit au fost identificate 640 de polimorfisme uninucleotidice. Patru mutații au fost localizate în regiunea de legare a agenților terapeutici experimentali siRNA sau OMF, iar 21 mutații induc schimbări nonsinonimice în epitopii recunoscuți de anticorpii monoclonali din cocktailurile de imunoterapie pasivă (ZMapp). Niciunul dintre polimorfismele uninucleotidice descoperite nu a fost asociat cu rezistența virusului Ebola la tratament. S-a demonstrat că 18 dintre modificări sunt tolerate de cocktailul ZMapp, care are o afinitate de legare crescută față de secvența glicoproteinei tulpinii Makona, ceea ce minimizează potențialul impact al mutațiilor.[349]
Prevenție[modificare | modificare sursă]
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |
Măsuri generale[modificare | modificare sursă]
Controlul virusului Reston la animalele[modificare | modificare sursă]
Nu există un vaccin veterinar contra acestui virus. Curățenia și dezinfectarea sistematică a fermelor de porci și maimuțe (cu hipoclorit de sodiu sau alți detergenți) trebuie să fie eficiente pentru inactivarea virusului. În caz de suspiciune a unui focar, localurile trebuie instituită imediat carantină. Sacrificarea animalelor infectate, cu o supraveghere riguroasă a înhumării sau incinerării carcaselor poate fi necesară pentru a reduce riscul de transmitere a virusului de la animale la om. Restricționarea sau interdicția deplasării animalelor din fermele infectate spre alte zone pot reduce propagarea bolii.
Întrucât focarele de infecție cu virusul Reston la porci și maimuțe au precedat cazurile de infecție la om, punerea în aplicare a unui sistem de supraveghere activă a sănătății animale este esențială pentru o alertă precoce a autorităților de sănătate publică și veterinară.
Deoarece se știe că primatele neumane au introdus virusul virusul Reston în Statele Unite ale Americii și Italia, administrația transporturilor și a unităților de carantină trebuie să se asigure că personalul înțelege pericolele asociate cu manipularea primatelor. Maimuțele importate vor fi menținute în carantină. Apariția deceselor la animalele carantinate și îmbolnăvirile îngrijitorilor, cu febră peste 38,5°, pe o durată mai mare de două zile, sunt elemente de suspiciune a unei infecții cu virusul Ebola și se vor lua măsuri în consecință. Personalul care se ocupă de animale bolnave trebuie să poarte echipament de protecție, incluzând mănuși de cauciuc și respiratoare cu mască facială.
Măsuri individuale[modificare | modificare sursă]
Nu există decât tratament simptomatic, iar vaccinul este un deziderat. În lipsa tratamentului eficient și vaccinului pentru oameni, gradul de conștientizare la factorii de risc și cunoașterea măsurilor de protecție care trebuie luate individual sunt singura modalitate de a reduce infecția și mortalitatea la oameni.
În Africa, în timpul focarelor de boală virală Ebola, mesajele educative de sănătate publică care urmăresc reducerea riscului se vor axa pe următoarele puncte:
- Reducerea riscului de transmitere între animale sălbatice și oameni prin contact cu liliecii sau maimuțele/primatele infectate și prin consumul de carne crudă provenită de la ele. Animalele vor fi manipulate cu mănuși și se va purta o îmbrăcăminte protectoare adecvată. Produsele (sângele și carnea) se vor fierbe bine înainte de a fi consumate.
- Reducerea riscului de transmitere interumană în comunitatea care rezultă din contactul direct sau apropiat (strâns) cu persoanele infectate, mai ales cu fluidele lor corporale. Se va evita orice contact apropiat cu pacienții infectați cu virusul Ebola. Se vor purta mănuși și un echipament individual de protecție adecvat în timpul îngrijirii pacienților la domiciliu. Este indispensabilă spălarea regulată a mâinilor după vizita rudelor bolnave aflate în spital sau după îngrijirea lor la domiciliu.
- Comunitățile afectate de virusul Ebola trebuie să informeze populația despre natura bolii și măsurile luate pentru a controla focarul, inclusiv în timpul ritualurilor funerare. Persoanele decedate prin această infecție trebuie să fie îngropate rapid și fără asumarea unor riscuri. În cazul decesului, este obligatorie incinerarea cadavrelor.
Fermele de porci din Africa pot juca un rol în amplificarea infecției din cauza prezenței liliecilor la aceste ferme. Trebuie luate măsuri de biosecuritate adecvate pentru a limita transmiterea infecției.
Pentru ebolavirusul Reston, mesajele educative de sănătate publică trebuie să se axeze pe reducerea riscului de transmitere de la porci la oameni care rezultă din practicile de creștere și sacrificare periculoase, precum și din consumul de sânge proaspăt, lapte sau țesuturi animale crude. Trebuie purtate mănuși și îmbrăcăminte de protecție adecvată în timpul manipulării animalelor bolnave, țesuturilor lor sau sacrificării lor. În regiunile în care au fost semnalate ebolavirusul Reston la porci, toate produsele de origine animală (sânge, carne și lapte) trebuie să fie fierte bine înainte de a fi consumate.
Măsuri în instituțiile medico-sanitare[modificare | modificare sursă]


Transportul cazului suspect sau a probelor biologice suspecte se va face cu transport special destinat în acest scop. Personalul care transportă cazul (medic, șofer) va purta echipament personal de protecție.
Pacienții vor fi menținuți în izolare strictă, eventual cu dispozitive izolatoare ale patului. Izolarea cazurilor se va face într-un pavilion sau clădire a spitalului separat de alte secții. Pacientul se va ala singur în cameră, iar camera va fi dotată cu baie proprie. Ușa de la camera va fi închisă. Se vor lua în considerare postarea permanentă a unei persoane la ușa salonului pentru a împiedica intrarea sau ieșirea în salon a persoanelor neechipate corespunzător.
Transmiterea interumană a virusului Ebola este în primul rând legată de contactul direct sau indirect cu sângele și fluidele corporale. El a fost semnalată la personalul medical atunci când nu au fost respectate măsurile suficiente de control al infecției. Nu este întotdeauna posibil de a identifica rapid pacienții cu febră hemoragică Ebola, deoarece simptomele inițiale pot fi nespecifice. Din acest motiv, este important ca personalul medical să aplice măsurile de precauție uzuale față de toți pacienții, indiferent de diagnostic, în orice practică profesională și în orice moment.
Aceste măsuri de precauție includ igiena mâinilor, igiena respiratorie, purtarea unui echipament personal de protecție (în funcție de lichidul infecțios eliminat de bolnav sau de alte contacte cu materiile infectate), siguranța injecțiilor și ritualurile funerare. În prezența unui caz suspect sau confirmat de infecție cu virusul Ebola, personalul medical care îngrijește bolnavul trebuie, în plus față de măsurile de precauție uzuale, să ia alte măsuri de luptă antiinfecțioasă pentru a evita orice expunerea la sângele sau fluidele corporale ale pacientului și orice contact direct cu mediul susceptibil de a fi contaminat. În timpul contactelor apropiate cu pacienții cu febră hemoragică Ebola (adică la mai puțin de un metru), trebuie de purtat o protecție facială (ecran facial sau mască chirurgicală și ochelari de protecție), un halat curat, nesteril, cu mâneci lungi și mănuși (sterile pentru unele proceduri medicale).
Echipamentul personal de protecție adecvat (EPP) este alcătuit din mănuși, ochelari de protecție, mască de protecție care acoperă complet partea din față și părțile laterale ale feței, halat de unică folosință impermeabil sau combinezon impermeabil, mască FP3. În caz de sângerări masive, vome sunt necesare în plus încă o pereche de mănuși, protecția picioarelor (cipici de unică folosință care acoperă pantofii). Procedurile invazive, care pot expune personalul medico-sanitar la infecție trebuie să se desfășoare în condiții stricte de siguranță. La ieșirea din camera pacientului sau zona de îngrijire, echipamentul personal de protecție trebuie să fie îndepărtat cu grijă, fără a contamina ochii, mucoasele sau hainele cu material potențial infecțios. Nu este permisă reutilizarea măștii sau mănușilor decât după prealabila lor decontaminarea riguroasă.
Igiena mâinilor de către personalul medical trebuie efectuată cât mai frecvent: înainte și după contactul cu pacientul, cu materialele potențial infecțioase, înainte și după scoaterea echipamentului personal de protecție, inclusiv a mănușilor. Igiena mâinilor se va asigura prin spălare cu apă și săpunuri sau cu substanțe dezinfectante pe baza de alcool, prin frecarea mâinilor.
Se va atrage atenția mai ales asupra riscului transmiterii virusului prin ace și alt instrumentar, contaminate cu sânge, secreții sau excrete. Injecțiile vor fi administrate în siguranță cu respectarea cu strictețe a precauțiunile standard. Echipamentul de administrare parenterală a tratamentului, după utilizare trebuie colectat într-un container special dedicat pacientului și va fi transportat la punctul de neutralizare.
Toate produsele provenite de la bolnavi, obiecte și instrumentele contaminate cu sânge sau cu alte produse de la bolnavi, trebuie manipulate cu grijă și aplicate măsuri riguroase de dezinfecție și de sterilizare. Rufele murdare se vor eticheta în mod clar în pungi etanșe și trimise direct la spălătorie. Echipamentele, suprafețele și obiectele contaminate se vor dezinfecta cu un dezinfectant de utilizare în spital sau cu o diluție 1:100 de hipoclorit de sodiu (clor). Toate acele și obiectele ascuțite vor fi manipulate cu grijă și vor fi strânse în containere sigilate și etichetate. Se vor limita utilizările acelor și obiectelor ascuțite cât mai mult posibil, iar flebotomiile, procedurile și testele de laborator vor fi limitate la minimum necesar pentru evaluare, diagnostic și tratament. Este de dorit pentru prevenirea contaminării cu aerosoli, ca aerul să fie filtrat cu filtre de tip HEPA (high-efficiency particulate air). Pe cât posibil se vor evita procedurile generatoare de aerosoli de către pacient.

Externarea pacienților confirmați cu boala virală Ebola se va face după recuperarea clinică, nu mai devreme de 42 de zile. Pacienții după externare vor evita contactul sexual timp de 3 luni de la boala clinică. În caz de deces cadavrul va fi manipulat în aceleași condiții de siguranță și transportat de la morga spitalului direct la cimitir sau crematoriu într-un cosciug închis.
Personalul de laborator este, de asemenea, expus la risc. Eșantioanele prelevate pentru diagnosticul cazurilor suspecte (ființe umane sau animale), trebuie să fie manipulate de către un personal calificat și prelucrate în laboratoare dotate corespunzător.
Profilaxie pasivă[modificare | modificare sursă]
Imunizarea pasivă cu plasma pacienților vindecați sau cu anticorpi monoclonali s-a dovedit ineficace de multe ori, confirmând că răspunsurile umorale nu joacă un rol important în controlul infecției cu EBOV.[307][308] În mod similar, administrarea de IFNα recombinant maimuțelor macac nu le protejează împotriva infecției.[350] Cu toate acestea, mai multe scheme terapeutice s-au dovedit eficiente recent. Vaccinul candidat VSVΔG/ZEBOV, administrat imediat după inoculare, protejează macacii de boală.
Profilaxie activă (vaccinuri)[modificare | modificare sursă]
Cu toate că izolarea bolnavilor și punerea în aplicare a măsurilor de protecție a anturajului pacienților sunt suficiente pentru a opri epidemiile, numeroase echipe își concentrează eforturile pe viitor asupra elaborării de tratamente și vaccinuri. Cu toate acestea, infrastructura necesară pentru manipularea virusului Ebola, precum și lipsa de modele animale pentru evaluarea vaccinurilor candidate sau moleculelor terapeutice, frânează considerabil progresele. Vaccinurile sunt în stadiu experimental, fiind implicate diverse metodologii de obținere: preparate vaccinale inactivate cu formol, vaccinuri conținând antigenele NP sau GP, ori vaccinuri recombinante care să exprime GP, GPS și NP.
În domeniul vaccinal, mai multe vaccinuri candidate s-au dovedit eficiente la cobai, însă parțial, ba chiar complet, ineficiente la macac, de exemplu preparatele virale inactivate prin căldură, formol sau raze γ, plasmidele care codifică GP sau NP, particule virale recombinante ale virusului encefalitei ecvine venezuelene care exprimă GP, vaccinurile variolice recombinante care exprimă GP, și particulele virale Ebola încapsulate în lipozomi.[351][352][353][354][355][356]
Recent, utilizarea de vectori virali vii, sau de particule virale, pentru a produce GP a permis elaborarea a două vaccinuri candidate care au fost eficace atât la cobai cât și la maimuța macac. Două protocoale vaccinale au fost testate, unul bazat pe administrarea unică a unei doze de 2x1012 particule de adenovirus 5 recombinant, care exprimă în același timp GP și NP (ADV-GP/NP), altul bazat pe două injecții la interval de 9 săptămâni. Ambele protocoale asigură o protecție totală și induc un răspuns CD8+IFNγ+ și un răspuns umoral după inocularea cu doze mici (13 pfu) și cu doze mari (1500 pfu) la 1 sau 4 săptămâni mai târziu (pfu = plaque forming units). Varianta simplă oferă o protecție mai rapidă, dar mai puțin durabilă decât varianta dublă. În mod similar, imunizarea unică cu o doză de 107 pfu de particule a virusului stomatitei veziculoase recombinant, viu și atenuat, care exprimă GP Ebola (VSVΔG/ZEBOV), asigură o protecție totală a macacilor împotriva unei inoculări de virus Ebola cu o doză mare (1000 pfu) la 28 zile mai târziu. Ele induc o creștere moderată a IgG anti-GP și o creștere accentuată a CD8+IFNγ+, CD8+TNFα+, CD4+IFNγ+ și CD4+ TNFα+. Până în prezent, aproape 30 de macaci au primit acestă imunizare și la nici unul dintre ei nu au apărut semne clinice.[357][358][359][360][361][362][363][364][365][366][367][368][369][370]
Vaccinuri candidate pentru febra hemoragică Ebola [357][371][372]
| Mecanismul | Platforma | Genele / proteine din vaccin | Observații |
|---|---|---|---|
| rVSV + ZEBOV-GP | Virusul stomatitei veziculoase recombinant (rVSV) | Glicoproteina (GP) ebolavirusului Zaire | Testările la primatele neumane au provocat un răspuns imunogen la aerosolii cu virus Ebola și la inocularea unei doze letale de virus Ebola. Protecție transmisă la primatele neumane expuse la virusul Ebola și imunocompromise. Vaccin candidat pentru administrare orală.[362][365] |
| rRABV + ZEBOV-GP | Virusul rabiei recombinant (rRABV) | Glicoproteina (GP) ebolavirusului Zaire | Testările la primatele neumane au provocat un răspuns imunogen la inocularea unei doze letale de virus Ebola.[373][374][375] |
| ADN + rAd5 + ZEBOV-GP, rAd5 + ZEBOV-GP | Serotipul 5 al adenovirusului recombinant (rAd5) cu sau fără ADN | Glicoproteina (GP) ebolavirusului Zaire | Este lipsit de pericol și imunogen în faza 1 de testări clinice. Pot fi necesare mai multe vaccinări. Posibilele interferențe cu imunitatea preexistentă la serotipul 5 al adenovirusului.[376] |
| Pseudoparticule virale + ZEBOV-GP + ZEBOV-NP + ZEBOV-VP40 | Pseudoparticule virale | Glicoproteina (GP) + nucleoproteina (NP) + proteina VP40 a ebolavirusului Zaire | Testările la primatele neumane au provocat un răspuns imunogen la inocularea unei doze letale de virus Ebola. Pseudoparticule virale pot fi produse în celule insectelor, ceea ce le face potrivite pentru producție pe scară largă.[364] |
| rHPIV3 + ZEBOV-GP | Tipul 3 al virusului paragripal uman recombinant (rHPIV3) | Glicoproteina (GP) ebolavirusului Zaire | Testările la cobai și primatele neumane au provocat un răspuns imunogen la inocularea unei doze letale de virus Ebola. Potențial pentru administrare fără ac.[377] |
| rCMV + ZEBOV-NP | Citomegalovirusul recombinant (rCMV) | Nucleoproteina (NP) ebolavirusului Zaire | Testările la șoareci au provocat un răspuns imunogen la inocularea unei doze letale de virus Ebola. Are o specificitate înaltă de specie.[378] |
| Vaccinul subunitar rEBOV + agonist TLR | Vaccinul subunitar al virusul Ebola recombinant (rEBOV) | Agonistul receptorului de tip Toll | Testările la șoareci au provocat un răspuns imunogen la inocularea unei doze letale de virus Ebola. Vaccinul subunitar este stabil la păstrare și livrare la temperatura mediului ambiant.[379] |
Primul test clinic al unui vaccin împotriva ebolavirusului Zaire realizat în SUA la începutul lunii septembrie 2014 pe un grup de voluntari nu a provocat până în prezent reacții adverse. Vaccinului împotriva virusului Ebola a fost dezvoltat de compania farmaceutică GlaxoSmithKline de mai mulți ani, împreună cu Institutele Naționale americane pentru Sănătate (NIH) și a dat rezultate foarte bune pe maimuțe și face în prezent obiectul unui studiu clinic asupra a zece persoane de la 2 septembrie 2014.[380] A fost folosit serotipul 3 al adenovirusului cimpanzeului (ChAd3). S-a recurs la adenovirusul de cimpanzeu și nu la serotipul uman 5 (Ad5) care poate infecta oameni și neutraliza vaccinul prin anticorpi prezenți în oameni. ChAd3 poartă gena glicoproteinei (GP) a ebolavirusului Zaire. Experimental, macacii au fost inoculați inițial cu serotipul 3 al adenovirusului cimpanzeului (ChAd3), care codifică proteina GP a virusului Ebola, iar după opt săptămâni s-a administrat alt vaccin, MVA (modified vaccinia Ankara), ce conține tulpina Ankara a virusului vaccinia (care provoacă variola vacilor) pentru a oferi o protecție completă și de lungă durată. Tulpina Ankara codifică de asemenea proteina GP.[381][382]
Virusul Ebola ca armă biologică[modificare | modificare sursă]
Virusul Ebola este clasificat ca armă biologică de categoria A, conform nomenclatorului agenților patogeni cu potențial bioterorist.[383]
Au existat suspiciuni că Uniunea Sovietică și SUA dezvoltau o armă biologică bazată pe virusurile Ebola și Marburg.[384] Pentagonul se temea încă de la sfârșitul anilor '70 că virusul Ebola poate fi folosit ca o armă bioteroristă. Însă specialiștii cred că riscul este scăzut. Cu toate că are o rată de letalitate de până la 90%, febra hemoragică Ebola este din fericire mai puțin contagioasă decât alte boli virale, deoarece se transmite mai ales prin contactul cu fluidele corporale: salivă, sânge, urină.
În anul 1992, membrii sectei japoneze apocaliptice Aum Shinrikyo, profitând de o epidemie de febră hemoragică Ebola, a încercat, fără succes, să procure virusul Ebola Zair în cadrul unei misiuni „umanitare” în Africa, conduse de șeful sectei, la care au participat 40 de membri ai sectei. Ei au preferat în cele din urmă gazul sarin, pe care l-au folosit pentru a comite atentatul din metroul din Tokyo în 1995.[3][385][386]
„Guvernul american ia în serios riscul Ebola ca un agent al bioterorismului și a investit zeci de milioane de dolari în elaborarea unor vaccinuri și terapii în ultimul deceniu”, a declarat Peter Walsh, profesor la Universitatea din Cambridge, citat de Washington Post.[387] Existența unor tratamente experimentale pentru febra hemoragică Ebola la ora actuală se datorează în oarecare măsură riscului folosirii virusului Ebola de către teroriști. În 2010 de exemplu, Departamentul Apărării al Statelor Unite a acordat 140 milioane de dolari pentru societatea canadiană Tekmira pentru dezvoltarea unui tratament pentru febra hemoragică Ebola. În 2013, Pentagonul a dat 4,4 milioane dolari Centrului de Vaccin Vanderbilt (Vanderbilt Vaccine Center) pentru studiul virusurilor Ebola și Marburg. ZMapp a fost dezvoltat de către o companie necunoscută până atunci, Mapp BioPharmaceutical, care are legături cu Departamentul Apărării al Statelor Unite.[297]
Note[modificare | modificare sursă]
- ^ http://www.cdc.gov/vhf/ebola Lipsește sau este vid:
|title=(ajutor) - ^ a b c d e f g h i j k l m n o p q r Ebola virus disease. World Health Organization (WHO)
- ^ a b c d e „Simin Florescu , Emanoil Ceaușu. Febra hemoragică Ebola. Viața medicală, Numărul 38 (1288). 15 august 2014”. Arhivat din original la . Accesat în .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq Elvira Sînziana Ciufescu. Virusologie medicală. Editura Medicală Națională. 2003
- ^ a b c Aurel Ivan - Tratat de epidemiologie a bolilor transmisibile. Polirom 2002
- ^ „Informații despre boala determinata de virusul Ebola (EVD). Institutul Național de Sănătate Publică”. Arhivat din original la . Accesat în .
- ^ a b c d WHO: Ebola Response Roadmap. Ebola Situation Report - 4 February 2015
- ^ CDC and Texas Health Department Confirm First Ebola Case Diagnosed in the U.S. CDC
- ^ Questions and Answers: Estimating the Future Number of Cases in the Ebola Epidemic—Liberia and Sierra Leone, 2014–2015. Center for Disease Control and Prevention USA
- ^ Martin I. Meltzer, Charisma Y. Atkins, Scott Santibanez, Barbara Knust, Brett W. Petersen, Elizabeth D. Ervin, Stuart T. Nichol, Inger K. Damon, Michael L. Washington. Estimating the Future Number of Cases in the Ebola Epidemic — Liberia and Sierra Leone, 2014–2015. MMWR, 23 septembrie 2014, Early Release, Vol. 63
- ^ a b „Smith DIH. Ebola haemorrhagic fever in Sudan, 1976. Bull World Health Organ 1978 ; 56 : 247-70” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b c „Johnson KM. Ebola haemorrhagic fever in Zaire, 1976. Bull World Health Organ 1978 ; 56 : 271-93” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b c „Heymann DL, Weisfeld JS, Webb PA, Johnson KM, Cairns T, Berquist H. Ebola hemorrhagic fever : Tandala, 1977-1978. J Infect Dis 1980 ; 142 : 372-76” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b „Baron RC, McCormick JB, Zubeir OA. Ebola virus disease in southern Sudan : Hospital dissemination and intrafamilial spread. Bull World Health Organ 1983 ; 61 : 997-1003” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b Le Guenno B, Formenty P, Wyers M, Gounon P, Walker F, Boesch C. Isolation and partial characterisation of a new strain of Ebola. The Lancet 1995 ; 345 : 1271-74.
- ^ a b Khan AS, Tshioko FK, Heymann DL, Le Guenno B, Nabeth P, Kerstiëns DL, et al. The reemergence of Ebola hemorrhagic fever, Democratic Republic of the Congo, 1995. J Infect Dis 1999 ; 179 : S76-S86.
- ^ a b c d e f Georges AJ, Leroy EM, Renaut AA, Tevi Benissan C, Nabias RJ, Trinh Ngoc M, et al. Ebola hemorrhagic fever outbreaks in Gabon, 1994-1997 : Epidemiologic and Health control issues. J Infect Dis 1999 ; 179 : S65-S75.
- ^ a b World Health Organization. Ebola haemorrhagic fever - South Africa. Weekly Epidemiological Record. 1996; 71(47):359.
- ^ a b c World Health Organization. Outbreak(s) of Ebola haemorrhagic fever, Congo and Gabon, October 2001- July 2002. Weekly Epidemiological Report. 2003; 78(26):223-225.
- ^ a b Formenty P, Libama F, Epelboin A, et al. Outbreak of Ebola hemorrhagic fever in the Republic of the Congo, 2003: a new strategy? Medecine Tropicale (Marseille). 2003; 63(3):291-295.
- ^ a b World Health Organization. Ebola haemorrhagic fever in the Republic of the Congo - Update 6. Weekly Epidemiological Record. 6 January 2004.
- ^ a b Okware SI, Omaswa FG, Zaramba S, Opio A, Lutwama JJ, Kamugisha J, et al. An outbreak of Ebola in Uganda. Trop Med Int Health 2002 ; 7 : 1068-75.
- ^ a b World Health Organization. Outbreak of Ebola haemorrhagic fever in Yambio, south Sudan, April-June 2004. Weekly Epidemiological Record. 2005; 80(43):370-375.
- ^ a b MacNeil A, Farnon EC, Morgan OW, et al. Filovirus Outbreak Detection and Surveillance: Lessons from Bundibugyo. Journal of Infectious Diseases. 2011; 204:S761-S767.
- ^ a b Jens H. Kuhn, Kristian G. Andersen, Sylvain Baize, Yīmíng Bào, Sina Bavari, Nicolas Berthet, Olga Blinkova, J. Rodney Brister, Anna N. Clawson, Joseph Fair, Martin Gabriel, Robert F. Garry, Stephen K. Gire, Augustine Goba, Jean-Paul Gonzalez, Stephan Günther, Christian T. Happi, Peter B. Jahrling, Jimmy Kapetshi, Gary Kobinger, Jeffrey R. Kugelman, Eric M. Leroy, Gael Darren Maganga, Placide K. Mbala, Lina M. Moses, Jean-Jacques Muyembe-Tamfum, Magassouba N’Faly, Stuart T. Nichol, Sunday A. Omilabu, Gustavo Palacios, Daniel J. Park, Janusz T. Paweska, Sheli R. Radoshitzky, Cynthia A. Rossi, Pardis C. Sabeti, John S. Schieffelin, Randal J. Schoepp, Rachel Sealfon, Robert Swanepoel, Jonathan S. Towner, Jiro Wada, Nadia Wauquier, Nathan L. Yozwiak, and Pierre Formenty. Nomenclature- and Database-Compatible Names for the Two Ebola Virus Variants that Emerged in Guinea and the Democratic Republic of the Congo in 2014. Viruses. 2014 Nov; 6(11): 4760–4799.
- ^ a b Hayes CG, Burans JP, Ksiazek TG, Del Rosario RA, Miranda MEG, Manaloto CR, et al. Outbreak of fatal illness among captive macaques in the Philippines caused by an Ebola-related filovirus. Am J Trop Med Hyg 1992 ; 46 : 664-71.
- ^ a b Miranda MEG, White ME, Dayrit MM, Hayes CG, Ksiazek TG, Burans JP. Seroepidemiological study of filovirus related to Ebola in the Philippines. Lancet 1991 ; 337 : 425-26.
- ^ a b Rollin PE, Williams RJ, Bressler DS, Pearson S, Cottingham M, Pucak G, et al. Ebola (subtype Reston) virus among quarantined nonhuman primates recently imported from the Philippines to the United States. J Infect Dis 1999 ; 179 : S108-S14.
- ^ a b World Health Organization. Ebola Reston in pigs and humans, Philippines. Weekly Epidemiological Record. 2009; 84(7):49-50.
- ^ a b c Barrette RW, Metwally SA, Rowland JM, Xu L, Zaki SR, Nichol ST, et al. Discovery of swine as a host for the Reston Ebolavirus. Science 2009 ; 325 : 204-6.
- ^ Emond RT, Evans B, Bowen ET, et al. A Case of Ebola Virus Infection. British Medical Journal. 1977; 2(6086):541-544.
- ^ Jahrling PB, Geisbert TW, Dalgard DW, Johnson ED, Ksiazek TG, Hall WC, et al. Preliminary report : Isolation of Ebola virus from monkeys imported to USA. Lancet 1990 ; 335 : 502-05.
- ^ Centers for Disease Control. Update: Filovirus Infection in Animal Handlers. Morbidity Mortality Weekly Report. 1990; 39(13):221.
- ^ „World Health Organization. Viral haemorrhagic fever in imported monkeys. Weekly Epidemiological Record. 1992; 67(24):183” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Miranda ME, Ksiazek TG, Retuya TJ, Khan AS, Sanchez A, Fulhorst CF, et al. Epidemiology of Ebola (subtype Reston) virus in the Philippines, 1996. J Infect Dis 1999 ; 179 : S115-S19.
- ^ Borisevich IV, Markin VA, Firsova IV, et al. Hemorrhagic (Marburg, Ebola, Lassa, and Bolivian) fevers: epidemiology, clinical pictures, and treatment. Voprosy Virusologii – Problems of Virology (Moscow). 2006; 51(5):8–16 (Russian).
- ^ Akinfeyeva LA, Aksyonova OI, Vasilyevich IV, et al. A case of Ebola hemorrhagic fever. Infektsionnye Bolezni (Moscow). 2005; 3(1):85–88 (Russian).
- ^ Declaration de son Excellence Monsieur le Ministre de la Santé Publique annonçant la fin de l'épidémie de FHV à virus Ebola dans les zones de santé de Mweka, Luebo et Bulape dans la Province du KasaiOccidental . Mardi, le 20 novembre 2007. Dr Victor Makwenge Kaput, Ministre de la Santé Publique
- ^ World Health Organization. Ebola virus haemorrhagic fever, Democratic Republic of the Congo - Update.. Weekly Epidemiological Record. 2007; 82(40):345-346.
- ^ World Health Organization. End of the Ebola Outbreak in the Democratic Republic of the Congo. Global Alert and Response. 17 Febuary 2009.
- ^ Shoemaker T, MacNeil A, Balinandi S, et al. Reemerging Sudan Ebola Virus Disease in Uganda, 2011. Emerging Infectious Diseases. 2012; 18(9):1480-1483.
- ^ a b c Albarino CG, Shoemaker T, Khristova ML, et al. Genomic analysis of filoviruses associated with four viral hemorrhagic fever outbreaks in Uganda and the Democratic Republic of the Congo in 2012. Virology. 2013; 442(2):97-100.
- ^ Ministry of Health Guinée – Conakry[nefuncțională]
- ^ a b WHO: Ebola response roadmap - Situation report update 14 November 2014
- ^ Gaël D. Maganga, Jimmy Kapetshi, Nicolas Berthet, Benoît Kebela Ilunga, Felix Kabange, Placide Mbala Kingebeni, Vital Mondonge, Jean-Jacques T. Muyembe, Eric Bertherat, Sylvie Briand, Joseph Cabore, Alain Epelboin, Pierre Formenty, Gary Kobinger, Licé González-Angulo, Ingrid Labouba, Jean-Claude Manuguerra, Jean-Marie Okwo-Bele, Christopher Dye, and Eric M. Leroy. Ebola Virus Disease in the Democratic Republic of Congo. New England Journal of Medicine, 2014; 371:2083-91.
- ^ „Ebola en RDC : une souche différente du virus, octobre 2014. L'Institut de recherche pour le développement (IRD)”. Arhivat din original la . Accesat în .
- ^ WHO declares end of Ebola outbreak in the Democratic Republic of Congo. WHO Statement, 21 November 2014
- ^ „WHO commends Sierra Leone for stopping Ebola virus transmission. WHO, 7 November 2015”. Arhivat din original la . Accesat în .
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 30 March 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 16 March 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 2 March 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 17 February 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 3 February 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 20 January 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 6 January 2016
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 30 December 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 23 December 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 16 December 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 9 December 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 2 December 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 25 November 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 18 November 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 11 November 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 4 November 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 28 October 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 21 October 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 14 October 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 7 October 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 30 September 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 23 September 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 16 September 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 9 September 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 2 September 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 26 august 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 19 august 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 12 august 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 5 august 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 29 July 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 22 July 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 15 July 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 08 July 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 01 July 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 24 June 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 17 June 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 10 June 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 3 June 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 27 May 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 20 May 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 13 May 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 6 May 2015
- ^ WHO: Ebola Response Roadmap.Ebola Situation Report - 29 April 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 22 April 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 15 April 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 8 April 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 1 April 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 25 March 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 18 March 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 11 March 2015.
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 4 March 2015.
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 25 February 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 18 February 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 11 February 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation Report - 28 January 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation report 21 January 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation report 14 January 2015
- ^ WHO: Ebola Response Roadmap. Ebola Situation report. 7 January 2015
- ^ WHO: Ebola Response Roadmap. Situation Report 31 December 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 24 December 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 17 December 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 10 December 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 3 December 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 26 november 2014
- ^ WHO: Ebola response roadmap. Situation report update 21 november 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 19 November 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 12 November 2014
- ^ WHO: Ebola Response Roadmap. Situation Report Update 7 November 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 5 November 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 31 October 2014
- ^ WHO: Ebola Response Roadmap. Situation Report 29 October 2014
- ^ WHO: Ebola response roadmap. Situation report update 25 october 2014
- ^ WHO: Ebola Response Roadmap Situation Report 22 October 2014
- ^ WHO: Ebola Response Roadmap Update 17 October 2014
- ^ WHO: Ebola Response Roadmap Situation Report 15 October 2014
- ^ WHO : Ebola response roadmap update 10 October 2014
- ^ WHO : Ebola Response Roadmap Situation Report 8 October 2014
- ^ WHO : Ebola response roadmap update 3 October 2014
- ^ WHO : Ebola Response Roadmap Situation Report 1 October 2014
- ^ WHO: Ebola response roadmap update 26 September 2014
- ^ WHO: Ebola response roadmap update 22 September 2014
- ^ WHO: Ebola response roadmap update 18 September 2014
- ^ WHO: Ebola response roadmap update 16 September 2014
- ^ WHO/AFRO Response to the Ebola Virus Disease (EVD) outbreak. An update by the Regional Director[nefuncțională]
- ^ Kiley, M. P. et al. (1982). Filoviridae: a taxonomic home for Marburg and Ebola viruses? Intervirol., 18: 24–32.
- ^ Pringle, C. R. (1991). Order Mononegavirales. Arch. Virol., 117: 137–40[nefuncțională]
- ^ Sanchez, A., Kiley, M. P., Klenk, H. D., and Feldman, H. (1992). Sequence analysis of the Marburg virus nucleoprotein gene: comparison to Ebola virus and other non-segmented negative stand RNA viruses. J. Gen. Virol., 73: 347–57.
- ^ „Bishop, D. H. L. and Pringle C. R. (1995). Order Mononegavirales. In: F. A. Murphy et al. (ed.) Virus Taxonomy, Sixth Report of the International Committee on Taxonomy of Viruses, pp. 265–67. Vienna: Springer-Verlag”. Arhivat din original la . Accesat în .
- ^ Feldmann H, Geisbert TW, Jahrling PB, Klenk HD, Netesov SV, Peters CJ, et al. Filoviridae. In «Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA. Virus taxonomy : VIIIth report of the international committee on taxonomy of viruses». Elsevier Academic Press ed, London, UK, 2005
- ^ a b Sanchez A, Geisbert TW, Feldmann H. Filoviridae : Marburg and Ebola viruses. In «Knipe DM, Howley PM. Fields virology » Lippincott Williams and Williams, ed, Philadelphia, 2007, 1409-48.
- ^ Kuhn, J. H.; Becker, S.; Ebihara, H.; Geisbert, T. W.; Johnson, K. M.; Kawaoka, Y.; Lipkin, W. I.; Negredo, A. I.; Netesov, S. V.; Nichol, S. T.; Palacios, G.; Peters, C. J.; Tenorio, A.; Volchkov, V. E.; Jahrling, P. B. (2010). "Proposal for a revised taxonomy of the family Filoviridae: Classification, names of taxa and viruses, and virus abbreviations". Archives of Virology 155 (12): 2083–2103.
- ^ Mason, C. (2008). The strains of Ebola. Can. Med. J., 178: 1266–67.
- ^ a b c d e f g h i j Heinz Feldmann, Anthony Sanchez, Thomas W. Geisbert. Filoviridae: Marburg and Ebola Viruses. In "David M. Knipe, Peter Howley. Fields Virology. 6th edition. Lippincott Williams & Wilkins, 2013"
- ^ E. M. Leroy, J-P Gonzalez1 and S. Baize. Ebola and Marburg haemorrhagic fever viruses: major scientific advances, but a relatively minor public health threat for Africa. Clinical Microbiology and Infection, Volume 17 Number 7, July 2011
- ^ Martini GA, Siegert R. Marburg virus disease. Springer ed, New York, 1971.
- ^ Kiley MP, Regnery RL, Johnson KM. Ebola virus : Identification of virion structural proteins. J Gen Virol 1980 ; 49 : 333-41. [nefuncțională]
- ^ Feldmann H, Kiley MP. Classification, structure, and replication of filoviruses. Curr Top Microbiol Immunol 1999 ; 235 : 1-21.
- ^ Sanchez A, Khan A, Zaki SR, Nabel GJ, Ksiazek TG, Peters CJ. Filoviridae : Marburg and Ebola viruses. In «Knipe DM, Howley PM. Fields Virology ». Lippincott Williams & Wilkins ed, Philadelphia, 2001
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac S.R. Palmer, Lord Soulsby, D.I.H. Simpson. Zoonoze. Editura Științelor Medicale. 2005
- ^ a b c d e f g h i j k l m n o p q r s t S.R. Palmer, Lord Soulsby, Paul Torgerson, David W. G. Brown. Oxford Textbook of Zoonoses: Biology, Clinical Practice, and Public Health Control (2 ed.). Oxford University Press. 2011
- ^ a b Huang Y, Xu L, Sun Y, Nabel GJ. The assembly of Ebola virus nucleocapsid requires virion-associated proteins 35 and 24 and posttranslational modification of nucleoprotein. Mol Cell 2002 ; 10 : 307-16.
- ^ a b c „Mühlberger E, Weik M, Volchkov VE, Klenk H-D, Becker S. Comparison of the transcription and replication strategies of Marburg and Ebola virus by using artificial replication systems. J Virol 1999 ; 73 : 2333- 2342”. Arhivat din original la . Accesat în .
- ^ a b Volchkov VE, Volchkova VA, Mühlberger E, Kolesnikova LV, Weik M, Dolnik O, et al. Recovery of infectious Ebola virus from complementary DNA : RNA editing of the GP gene and viral cytotoxicity. Science 2001 ; 291 : 1965-69.
- ^ a b H Feldmann, HD Klenk, A Sanchez. Molecular biology and evolution of filoviruses. Springer, 1993
- ^ Elliott, L. H., A. Sanchez, et al.. Ebola protein analyses for the determination of genetic organization. Arch Virol 1993, 133(3-4): 423-36.
- ^ a b Ikegami, T., A. B. Calaor, et al. Genome structure of Ebola virus subtype Reston: differences among Ebola subtypes. Brief report. Arch Virol 2001, 146(10): 2021-7.
- ^ Sanchez, A. and P. E. Rollin. Complete genome sequence of an Ebola virus (Sudan species) responsible for a 2000 outbreak of human disease in Uganda. Virus Res 2005, 113(1): 16-25.
- ^ Feldmann, H., E. Mühlberger, et al. Marburg virus, a filovirus: messenger RNAs, gene order, and regulatory elements of the replication cycle. Virus Res 1992, 24(1): 1-19.
- ^ Crary, S. M., J. S. Towner, et al. Analysis of the role of predicted RNA secondary structures in Ebola virus replication. Virology 2003, 306(2): 210-8.
- ^ Sanchez, A., M. P. Kiley, et al. Sequence analysis of the Ebola virus genome: organization, genetic elements, and comparison with the genome of Marburg virus. Virus Res 1993, 29(3): 215-40.
- ^ Sanchez A, Trappier SG, Mahy BWJ, Peters CJ, Nichol ST. The virion glycoproteins of Ebola viruses are encoded in two reading frames and are expressed through transcriptional editing. Proc Natl Acad Sci USA 1996 ; 93 : 3602-07.
- ^ Volchkov VE, Feldmann H, Volchkova VA, Klenk H-D. Processing of the Ebola virus glycoprotein by the proprotein convertase furin. Proc Natl Acad Sci USA 1998 ; 95 : 5762-67.
- ^ Volchkov VE, Volchkova VA, Slenczka W, Klenk HD, Feldmann H. Release of viral glycoproteins during Ebola virus infection. Virology 1998 ; 245 : 110-19.
- ^ Volchkov VE, Blinov VM, Netesov SV. The envelope glycoprotein of Ebola virus contains an immunosuppressive-like domain similar to oncogenic retroviruses. FEBS 1992 ; 305 : 181-84.
- ^ „Wool-Lewis RJ, Bates P. Characterization of Ebola virus entry by using pseudotyped viruses : Identification of receptor-deficient cell lines. J Virol 1998 ; 72 : 3155-60”. Arhivat din original la . Accesat în .
- ^ Chepurnov AA, Tuzova MN, Ternovoy VA, Chernukhin IV. Suppressive effect of Ebola virus on T cell proliferation in vitro is provided by a 125-kDa GP viral protein. Immunol Lett 1999 ; 68 : 257-61.
- ^ Yang ZY, Duckers HJ, Sullivan NJ, Sanchez A, Nabel EG, Nabel GJ. Identification of the Ebola virus glycoprotein as the main viral determinant of vascular cell cytotoxicity and injury. Nature Med 2000 ; 6 : 886-89.
- ^ „Chan SY, Speck RF, Ma MC, Goldsmith MA. Distinct mechanisms of entry by envelope glycoproteins of Marburg and Ebola (Zaire) viruses. J Virol 2000 ; 74 : 4933-7”. Arhivat din original la . Accesat în .
- ^ Chan SY, Empig CJ, Welte FJ, Speck RF, Schmaljohn A, Kreisberg JF, et al. Folate receptor -α is a cofactor for cellular entry by Marburg and Ebola viruses. Cell 2001 ; 106 : 117-26.
- ^ Yaddanapudi K, Palacios G, Towner JS, Chen I, Sariol CA, Nichol ST, et al. Implication of a retrovirus- like glycoprotein peptide in the immunopathogenesis of Ebola and Marburg viruses. FASEB J 2006 ; 20 : 2519-30.
- ^ Volchkova VA, Feldmann H, Klenk H-D, Volchkov VE. The nonstructural small glycoprotein sGP of Ebola virus is secreted as an antiparallel-orientated homodimer. Virology 1998 ; 250 : 408-14.
- ^ Feldmann H, Volchkov VE, Volchkova VA, Stroher U, Klenk HD. Biosynthesis and role of filoviral glycoproteins. J Gen Virol 2001 ; 82 : 2839-48. [nefuncțională]
- ^ Dolnik O, Volchkova V, Garten W, Carbonnelle C, Becker S, Kahnt J, et al. Ectodomain shedding of the glycoprotein GP of Ebola virus. Embo J 2004 ; 23: 2175-84.
- ^ Noda T, Sagara H, Suzuki E, Takada A, Kida H, Kawaoka Y. Ebola virus VP40 drives the formation of virus-like filamentous particles along with GP. J Virol 2002 ; 76 : 4855-65.
- ^ „Han Z, Boshra H, Sunyer JO, Zwiers SH, Paragas J, Harty RN. Biochemical and functional characterization of the Ebola virus VP24 protein : Implications for a role in virus assembly and budding. J Virol 2003 ; 77 : 1793-800”. Arhivat din original la . Accesat în .
- ^ „Watanabe S, Watanabe T, Noda T, Takada A, Feldmann H, Jasenosky LD, et al. Production of novel Ebola virus-like particles from cDNAs : An alternative to Ebola virus generation by reverse genetics. J Virol 2004 ; 78 : 999-1005”. Arhivat din original la . Accesat în .
- ^ Bamberg S, Kolesnikova L, Moller P, Klenk HD, Becker S. VP24 of Marburg virus influences formation of infectious particles. J Virol 2005 ; 79 : 13421-33. [nefuncțională]
- ^ Noda T, Watanabe S, Sagara H, Kawaoka Y. Mapping of the VP40-binding regions of the nucleoprotein of Ebola virus. J Virol 2007 ; 81 : 3554-62. [nefuncțională]
- ^ „Johnson RF, McCarthy SE, Godlewski PJ, Harty RN. Ebola virus VP35-VP40 interaction is sufficient for packaging 3E-5E minigenome RNA into viruslike particles. J Virol 2006 ; 80 : 5135-44”. Arhivat din original la . Accesat în .
- ^ Ruigrok RW, Schoehn G, Dessen A, Forest E, Volchkov V, Dolnik O, et al. Structural characterization and membrane binding properties of the matrix protein VP40 of Ebola virus. J Mol Biol 2000 ; 300 : 103-12.
- ^ „Basler CF, Mikulasova A, Martinez-Sobrido L, Paragas J, Muhlberger E, Bray M, et al. The Ebola virus VP35 protein inhibits activation of interferon regulatory factor 3. J Virol 2003 ; 77 : 7945-56”. Arhivat din original la . Accesat în .
- ^ Hartman AL, Towner JS, Nichol ST. A C-terminal basic amino acid motif of Zaire Ebolavirus VP35 is essential for type I interferon antagonism and displays high identity with the RNA-binding domain of another interferon antagonist, the NS1 protein of influenza A virus. Virology 2004 ; 328 : 177-84.
- ^ „Cardenas WB, Loo YM, Gale M, Jr., Hartman AL, Kimberlin CR, Martinez-Sobrido L, et al. Ebola virus VP35 protein binds double-stranded RNA and inhibits alpha/beta interferon production induced by RIG-I signaling. J Virol 2006 ; 80 : 5168-78”. Arhivat din original la . Accesat în .
- ^ „Hartman AL, Bird BH, Towner JS, Antoniadou ZA, Zaki SR, Nichol ST. Inhibition of IRF-3 activation by VP35 is critical for the high level of virulence of Ebola virus. J Virol 2008 ; 82 : 2699-704”. Arhivat din original la . Accesat în .
- ^ „Prins KC, Cardenas WB, Basler CF. Ebola virus protein VP35 impairs the function of interferon regulatory factor-activating kinases IKKepsilon and TBK-1. J Virol 2009 ; 83 : 3069-77”. Arhivat din original la . Accesat în .
- ^ Chang TH, Kubota T, Matsuoka M, Jones S, Bradfute SB, Bray M, et al. Ebola Zaire virus blocks type I interferon production by exploiting the host SUMO modification machinery. PLoS Pathog 2009 ; 5 : e1000493.
- ^ a b c Leroy EM, Kumulungui B, Pourrut X, Rouquet P, Hassanin A, Yaba P, et al. Fruit bats as reservoirs of Ebola virus. Nature 2005 ; 438 : 575-76.
- ^ a b Swanepoel R, Leman PA, Burt FJ. Experimental inoculation of plants and animals with Ebola virus. Emerg Infect Dis 1996 ; 2 : 321-25.
- ^ Arata AA, Johnson B. Approaches towards studies on potential reservoirs of viral haemorrhagic fever in southern Sudan (1977). In «Pattyn SR, ed. Ebola virus haemorrhagic fever». Elsevier/Netherland biomedical ed, Amsterdam, 1978, pp 191-202.
- ^ Breman JG, Johnson KM, van der Groen G, Robbins CB, Szczeniowski MV, Ruti K, et al. A search for Ebola virus in animals in the Democratic Republic of the Congo and Cameroon : Ecologic, virologic, and serologic surveys, 1979-1980. J Infect Dis 1999 ; 179 : S139-S47.
- ^ Reiter P, Turell M, Coleman R, Miller B, Maupin G, Liz J, et al. Field investigations of an outbreak of Ebola hemorrhagic fever, Kikwit, Democratic Republic of the Congo, 1995 : Arthropod studies. J Infect Dis 1999 ; 179 : S148-S54.
- ^ Leirs H, Mills JN, Krebs JW, Childs JE, Akaibe D, Woolen N, et al. Search for the Ebola virus reservoir in Kikwit, Democratic Republic of the Congo : Reflections on a vertebrate collection. J Infect Dis 1999 ; 179 : S155-S63.
- ^ Formenty P, Jahrling P, Rossi C, Artsob H, Swanepoel R, LeGuenno B, et al. Search for the Ebola virus reservoir in Taï forest, Côte d’Ivoire : 1996-1997, preliminary results. In : XIth International Congress of Virology. Sydney, Australia, 1999.
- ^ „Morvan JM, Deubel V, Gounon P, Nakoune E, Barriere P, Murri S, et al. Identification of Ebola virus sequences present as RNA or DNA in organs of terrestrial small mammals of the Central African Republic. Microbes Infect 1999 ; 1 : 1193-201” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b Peterson AT, Bauer JT, Mills JN. Ecologic and geographic distribution of filovirus disease. Emerg Infect Dis 2004 ; 10 : 40-47.
- ^ Turell MJ, Bressler DS, Rossi CA. Lack of virus replication in arthropods after intrathoracic inoculation of Ebola Reston virus. Am J Trop Med Hyg 1996 ; 55 : 89-90.
- ^ a b c Towner JS, Amman BR, Sealy TK, Carroll SA, Comer JA, Kemp A, et al. Isolation of genetically diverse Marburg viruses from Egyptian fruit bats. PLoS Pathog 2009 ; 5 : e1000536.[nefuncțională]
- ^ Pourrut X, Delicat A, Rollin PE, Ksiazek TG, Gonzalez JP, Leroy EM. Spatial and temporal patterns of Zaire ebolavirus antibody prevalence in the possible reservoir bat species. J Infect Dis 2007 ; 196 Suppl 2 : S176-83.
- ^ Towner JS, Pourrut X, Albarino CG, Nkogue CN, Bird BH, Grard G, et al. Marburg virus infection detected in a common African bat. PLoS ONE 2007 ; 2 : e764.
- ^ Swanepoel R, Smit SB, Rollin PE, Formenty P, Leman PA, Kemp A, et al. Studies of reservoir hosts for Marburg virus. Emerg Infect Dis 2007 ; 13 : 1847-51.
- ^ Pourrut, X., et al. (2009). Large serological survey showing cocirculation of Ebola and Marburg viruses in Gabonese bat populations, and a high seroprevalence of both viruses in Rousettus aegyptiacus. BioMed. Cen. Infect. Dis., 9: 159–69.
- ^ Leroy EM, Epelboin A, Mondonge V, Pourrut X, Gonzalez JP, Muyembe-Tamfum JJ, et al. Human Ebola outbreak resulting from direct exposure to fruit bats in Luebo, Democratic Republic of Congo, 2007. Vector Borne Zoonotic Dis 2009; 6 : 723-28.
- ^ a b Leroy EM, Rouquet P, Formenty P, Souquière S, Kilbourne A, Froment J-M, et al. Multiple Ebola virus transmission events and rapid decline of central african wildlife. Science 2004 ; 303 : 387-90.
- ^ Huijbregts B, De Wachter P, Ndong Obiang S, Akou Ella M. Ebola and the decline of gorilla Gorilla gorilla and chimpanzee Pan troglodytes populations in Minkebe forest, north-eastern Gabon. Oryx 2003 ; 37 : 437-43.
- ^ Walsh PD, Abernethy KA, Bermejo M, Beyers R, De Wachter P, Ella Akou M, et al. Catastrophic ape decline in western equatorial Africa. Nature 2003 ; 422 : 611-14.
- ^ a b Rouquet P, Froment J-M, Bermejo M, Kilbourne A, Karesh W, Reed P, et al. Wild animal mortality monitoring and human Ebola outbreaks, Gabon and Republic of Congo, 2001-2003. Emerg Infect Dis 2005 ; 11 : 283-90.
- ^ Bermejo M, Rodriguez-Teijeiro JD, Illera G, Barroso A, Vila C, Walsh PD. Ebola outbreak killed 5000 gorillas. Science 2006 ; 314 : 1564.
- ^ Caillaud D, Levrero F, Cristescu R, Gatti S, Dewas M, Douadi M, et al. Gorilla susceptibility to Ebola virus : The cost of sociality. Curr Biol 2006 ; 16 : R489-91.
- ^ a b Leroy EM, Telfer P, Kumulungui B, Yaba P, Rouquet P, Roques P, et al. A serological survey of Ebola virus infection in central African nonhuman primates. J Infect Dis 2004 ; 190 : 1895-9.
- ^ Formenty P, Boesch C, Wyers M, Steiner C, Donati F, Dind F, et al. Ebola virus outbreak among wild chimpanzees living in a rain forest of Cote d’Ivoire. J Infect Dis 1999 ; 179 Suppl 1 : S120-26.
- ^ „Pourrut X, Kumulungui B, Wittmann T, Moussavou G, Délicat A, Yaba P, et al. The natural History of Ebola virus in Africa. Microbes Infect 2005 ; 7 : 1005-14” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b Peterson AT, Carroll DS, Mills JN, Johnson AM. Potential mammalian filovirus reservoirs. Emerg Infect Dis 2004 ; 10 : 2073-81.
- ^ a b Wittmann TJ, Biek R, Hassanin A, Rouquet P, Reed P, Yaba P, et al. Isolates of Zaire ebolavirus from wild apes reveal genetic lineage and recombinants. Proc Natl Acad Sci USA 2007 ; 104 : 17123-7.
- ^ a b Becquart P, Wauquier N, Mahlakoiv T, Nkoghe D, Padilla C, Souris M, et al. High prevalence of both humoral and cellular immunity to Zaire Ebolavirus among rural populations in Gabon. PLoS One 2010; 5 : e9126.
- ^ Virus Ecology Graphic. CDC
- ^ Johnson E, Jaax N, White J, Jahrling P. Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus. Int J Exp Pathol. Aug 1995; 76(4):227-36.
- ^ Jean-Marie Huraux, Jean-Claude Nicolas, Henri Agut, Hélène Peigue-Lafeuille. Traité de virologie médicale, 2003
- ^ Costin Cernescu. Virusologie medicală. Editura Medicală. 2012
- ^ Pinzon JE, Wilson JM, Tucker CJ, Arthur R, Jahrling PB, Formenty P. Trigger events : Enviroclimatic coupling of Ebola hemorrhagic fever outbreaks. Am J Trop Med Hyg 2004 ; 71 : 664-74. [nefuncțională]
- ^ Peterson AT, Lash RR, Carroll DS, Johnson KM. Geographic potential for outbreaks of Marburg hemorrhagic fever. Am J Trop Med Hyg 2006 ; 75 : 9-15. [nefuncțională]
- ^ Leroy EM, Baize S, Volchkov VE, Fisher-Hoch SP, Georges-Courbot M-C, Lansoud-Soukate J, et al. Human asymptomatic Ebola infection and strong inflammatory response. Lancet 2000 ; 355 : 2210-15.
- ^ Busico KM, Marshall KL, Ksiazek TG, Roels TH, Fleerackers Y, Feldmann H, et al. Prevalence of IgG antibodies to Ebola virus in individuals during an Ebola outbreak, Democratic Republic of the Congo, 1995. J Infect Dis 1999 ; 179 : S102-S07.
- ^ Gonzalez JP, Nakoune E, Slenczka W, Vidal P, Morvan JM. Ebola and Marburg virus antibody prevalence in selected populations of the Central African Republic. Microbes Infect 2000 ; 2 : 39-44.
- ^ Ivanoff B, Duquesnoy P, Languillat G, Saluzzo JF, Georges AJ, Gonzalez J-P, et al. Haemorrhagic fever in Gabon. I. Incidence of Lassa, Ebola and Marburg viruses in Haut-Ogooué. Trans R Soc Trop Med Hyg 1982 ; 76 : 719-20.
- ^ Bouree P, Bergmann JF. Ebola virus infection in man : A serological and epidemiological survey in the Cameroons. Am J Trop Med Hyg 1983 ; 32 : 1465-66.
- ^ Gonzalez JP, Josse R, Johnson ED, Merlin M, Georges AJ, Abandja J, et al. Antibody prevalence against haemorrhagic fever viruses in randomized representative Central African populations. Res Virol 1989 ; 140 : 319-31.
- ^ Johnson BK, Wambui C, Ocheng D, Gichogo A, Oogo S, Libondo D, et al. Seasonal variation in antibodies against Ebola virus in Kenyan fever patients. Lancet 1986 ; 1 : 1160.
- ^ Johnson ED, Gonzalez JP, Georges AJ. Filovirus activity among selected ethnic groups inhabiting the tropical forest of equatorial Africa. Trans R Soc Trop Med Hyg 1993 ; 87 : 536-38.
- ^ Gonzalez JP, Herbreteau V, Morvan J, Leroy EM. Ebola virus circulation in Africa: A balance between clinical expression and epidemiological silence. Bull Soc Pathol Exot 2005 ; 98 : 210-7.
- ^ a b Mahanty S, Hutchinson K, Agarwal S, McRae M, Rollin PE, Pulendran B. Cutting edge : Impairment of dendritic cells and adaptive immunity by Ebola and Lassa viruses. J Immunol 2003 ; 170 : 2797- 801.
- ^ a b c „Ströher U, West E, Bugany H, Klenk H-D, Schnittler H-J, Feldmann H. Infection and activation of monocytes by Marburg and Ebola viruses. J Virol 2001 ; 75 : 11025-33”. Arhivat din original la . Accesat în .
- ^ a b c d Geisbert TW, Hensley L, Larsen T, Young HA, Reed DS, Geisbert JB, et al. Pathogenesis of Ebola hemorrhagic fever in Cynomolgus macaques : Evidence that dendritic cells are early and sustained targets of infection. Am J Pathol 2003 ; 163 : 2347-70
- ^ a b Lisa E. Hensley, Derron A. Alves, Joan B. Geisbert, Elizabeth A. Fritz, Christopher Reed, Tom Larsen, Thomas W. Geisbert. Pathogenesis of Marburg Hemorrhagic Fever in Cynomolgus Macaques. J Infect Dis. (2011) 204 (suppl 3)
- ^ Ryabchikova EI, Kolesnikova LV, Luchko SV. An analysis of features of pathogenesis in two animal models of Ebola virus infection. J Infect Dis 1999; 179 : S199-S202.
- ^ Baskerville A, Fisher-Hoch SP, Neild GH, Dowsett AB. Ultrastructural pathology of experimental Ebola haemorrhagic fever virus infection. J Pathol 1985 ; 147 : 199-209.
- ^ a b Wong G, Kobinger GP, Qiu X. Characterization of host immune responses in Ebola virus infections. Expert Rev Clin Immunol. 2014 Jun;10(6):781-90.
- ^ a b Zampieri CA, Sullivan NJ, Nabel GJ. Immunopathology of highly virulent pathogens: insights from Ebola virus. Nature Immunology 2007 Nov; 8(11):1159-64.
- ^ Gupta M, Mahanty S, Ahmed R, Rollin PE. Monocyte-derived human macrophages and peripheral blood mononuclear cells infected with Ebola virus secrete MIP-1α and TNF-α and inhibit poly- IC-induced IFN-α in vitro. Virology 2001 ; 284 : 20-5.
- ^ Baize S, Leroy EM, Georges AJ, Georges-Courbot M-C, Capron M, Bedjabaga I, et al. Inflammatory responses in Ebola virus-infected patients. Clin Exp Immunol 2002; 128 : 163-68.
- ^ a b Wauquier N, Becquart P, Padilla C, Baize S, Leroy EM. Human fatal Zaire Ebola virus infection is associated with an aberrant innate immunity and massive lymphocyte apoptosis. PLoS Neg Trop Dis 2010 ; 4 : e837.
- ^ Villinger F, Rollin PE, Brar SS, Chikkala NF, Winter J, Sundstrom JB, et al. Markedly elevated levels of interferon (IFN)-γ, IFN-α, Interleukin (IL)-2, IL-10, and Tumor Necrosis Factor-α associated with fatal Ebola virus infection. J Infect Dis 1999 ; 179 : S188-91.
- ^ Reid SP, Leung LW, Hartman AL, Martinez O, Shaw ML, Carbonnelle C, et al. Ebola virus VP24 binds karyopherin alpha1 and blocks STAT1 nuclear accumulation. J Virol 2006 ; 80 : 5156-67.
- ^ Reid SP, Valmas C, Martinez O, Sanchez A, Basler CF. Ebola virus VP24 proteins inhibit the interaction of NP1-1 subfamily karyopherin alpha proteins with activated STAT1. J Virol 2007 ; 81 : 13469-77.
- ^ „Hartman AL, Ling L, Nichol ST, Hibberd ML. Whole-genome expression profiling reveals that inhibition of host innate immune response pathways by Ebola virus can be reversed by a single amino acid change in the VP35 protein. J Virol 2008 ; 82 : 5348-58”. Arhivat din original la . Accesat în .
- ^ „Prins KC, Delpeut S, Leung DW, Reynard O, Volchkova VA, Reid SP, et al. Mutations abrogating VP35 interaction with double-stranded RNA render Ebola virus avirulent in guinea pigs. J Virol 2010 ; 84 : 3004-15”. Arhivat din original la . Accesat în .
- ^ a b Hensley L, Young HA, Jahrling PB, Geisbert TW. Proinflammatory response during Ebola virus infection of primate models : Possible involvement of the tumor necrosis factor receptor superfamily. Immunol Letters 2002 ; 80 : 169-79.
- ^ Baize S, Leroy EM, Georges-Courbot M-C, Capron M, Lansoud-Soukate J, Debré P, et al. Defective humoral responses and extensive intravascular apoptosis are associated with fatal outcome in Ebola virus-infected patients. Nature Med 1999 ; 5 : 423-26.
- ^ Ksiazek TG, E. RP, Williams AJ, Bressler DS, Martin ML, Swanepoel R, et al. Clinical virology of Ebola hemorrhagic fever (EHF) : Virus, virus antigen, and IgG and IgM antibody findings among EHF patients in Kikwit, Democratic Republic of the Congo, 1995. J Infect Dis 1999 ; 179 : S177-87.
- ^ Baize S, Leroy EM, Mavoungou E, Fisher-Hoch SP. Apoptosis in fatal Ebola infection. Does the virus toll the bell for the immune system ? Apoptosis 2000 ; 5 : 5-7
- ^ a b Geisbert TW, Hensley LE, Gibb TR, Steele KE, Jaax NK, Jahrling PB. Apoptosis induced in vitro and in vivo during infection by Ebola and Marburg viruses. Lab Invest 2000 ; 80 : 171-86.
- ^ Reed DS, Hensley LE, Geisbert JB, Jahrling PB, Geisbert TW. Depletion of peripheral blood T lymphocytes and NK cells during the course of Ebola hemorrhagic fever in Cynomolgus macaques. Viral Immunol 2004 ; 17 : 390-400.
- ^ „Leroy EM, Becquart P, Wauquier N, Baize S. Evidence for Ebola virus superantigen activity. J Virol 2011 ; 85 : 4041-2”. Arhivat din original la . Accesat în .
- ^ Bosio CM, Aman MJ, Grogan C, Hogan R, Ruthel G, Negley D, et al. Ebola and Marburg viruses replicate in monocyte-derived dendritic cells without inducing the production of cytokines and full maturation. J Infect Dis 2003 ; 188 : 1630-8.
- ^ Jin H, Yan Z, Prabhakar BS, Feng Z, Ma Y, Verpooten D, et al. The VP35 protein of Ebola virus impairs dendritic cell maturation induced by virus and lipopolysaccharide. J Gen Virol 2010 ; 91 : 352-61. [nefuncțională]
- ^ a b Feldmann H, Bugany H, Mahner F, Klenk HD, Drenckhahn D, Schnittler HJ. Filovirus-induced endothelial leakage triggered by infected monocytes/ macrophages. J Clin Invest 1996 ; 70 : 2208-14. [nefuncțională]
- ^ Schnittler HJ, Feldmann H. Molecular pathogenesis of filovirus infections : Role of macrophages and endothelial cells. Curr Top Microbiol Immunol 1999 ; 235 : 175-204.
- ^ a b c Geisbert TW, Young HA, Jahrling PB, Davis KJ, Kagan E, Hensley L. Mechanisms underlying coagulation abnormalities in Ebola hemorrhagic fever : Overexpression of tissue factor in primate monocytes/macrophages is a key event. J Infect Dis 2003; 188 : 1618-29.
- ^ a b Geisbert TW, Hensley L, Jahrling PB, Larsen T, Geisbert JB, Paragas J, et al. Treatment of Ebola virus infection with a recombinant inhibitor of factor VII/tissue factor : A study in rhesus monkeys. Lancet 2003 ; 362 : 1953-58.
- ^ Ruf W. Emerging roles of tissue factor in viral hemorrhagic fever. Trends Immunol 2004 ; 25 : 461-4.
- ^ a b Paul E. Kilgore, John D. Grabenstein, Abdulbaset M. Salim, Michael Rybak. Treatment of Ebola Virus Disease. Pharmacotherapy. Volume 35, Number 1, 2015
- ^ Colebunders R, Tshomba A, Van Kerkhove MD, Bausch DG, Campbell P, Libande M, et al. Marburg hemorrhagic fever in Durba and Watsa, Democratic Republic of the Congo : Clinical documentation, features of illness, and treatment. J Infect Dis 2007 ; 196 Suppl 2 : S148-53.
- ^ Martini GA. Clinical syndrome. In Gustav Adolf Martini, Rudolf Siegert. Marburg virus disease. Springer-Verlag ed, New York, 1971 : 1-9.
- ^ S. R. Pattyn. Ebola Virus Haemorrhagic Fever: Proceedings of an International Colloquium on Ebola Virus Infection and Other Haemorrhagic Fevers, Held in Antwerp, Belgium, 6-8 Dec. 1977. Elsevier/North-Holland, 1978
- ^ Peters CJ, Khan AS. Filovirus diseases. In «Klenk HD. Current topics in microbiology and immunology : Filovirus disease». Springer-Verlag, Berlin, 1999, 85-95.
- ^ Peters CJ, LeDuc JW. An introduction to Ebola : The virus and the disease. J Infect Dis 1999 ; 179 Suppl 1 : ix-xvi.
- ^ a b Bwaka MA, Bonnet M-J, Calain P, Colebunders R, De Roo A, Guimard Y, et al. Ebola hemorrhagic fever in Kikwit, Democratic Republic of the Congo: Clinical observations in 103 patients. J Infect Dis 1999 ; 179 : S1-7.
- ^ a b c d e f g Mark G. Kortepeter, Daniel G. Bausch, and Mike Bray. Basic Clinical and Laboratory Features of Filoviral Hemorrhagic Fever. The Journal of Infectious Diseases 2011; 204:S810–S816
- ^ „Illustrated lecture notes on Tropical Medicine”. Arhivat din original la . Accesat în .
- ^ Smith DH, Isaacson M, Johnson KM, Bagshawe A, Johnson BK, Swanapoel R, et al. Marburg-virus disease in Kenya. Lancet 1982 ; I : 816-20.
- ^ Rowe AK, Bertolli J, Khan AS, Makunu R, Muyembe-Tamfum JJ, Bressler D, et al. Clinical, virologic, and immunologic follow-up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. J Infect Dis 1999 ; 179 : S28-S35.
- ^ Daniel S. Chertow, Christian Kleine, Jeffrey K. Edwards, Roberto Scaini, Ruggero Giuliani, Armand Sprecher. Ebola Virus Disease in West Africa — Clinical Manifestations and Management. The New England Journal of Medicine; 371:2054-2057 27 noiembrie 2014
- ^ Fisher-Hoch SP, Lloyd G, Platt GS, Simpson DIH. Hematological and biochemical monitoring of Ebola infection in rhesus monkeys : Implications for patient management. Lancet 1983 ; 2 : 1055-58.
- ^ Fisher-Hoch SP, Platt GS, Neild GH, Southree T, Baskerville A, Raymond RT, et al. Pathophysiology of shock and hemorrhage in a fulminating viral infection (Ebola). J Infect Dis 1985; 152 : 887-94.
- ^ Geisbert TW, Young HA, Jahrling PB, Davis KJ, Larsen T, Kagan E, et al. Pathogenesis of Ebola hemorrhagic fever in primate models : Evidence that hemorrhage is not a direct effect of virus-induced cytolysis of endothelial cells. Am J Pathol 2003 ; 163 : 2371-82.
- ^ a b Définition de cas de maladie à virus Ebola (EVD). CDC
- ^ „Procedura Operațională pentru managementul cazului suspect/confirmat cu boala produsă de virusul Ebola (EVB). Institutul Național de Sănătate Publică, Ministerului Sănătății”. Arhivat din original la . Accesat în .
- ^ „Informații despre boala determinata de virusul Ebola (EVD). Institutul Național de Sănătate Publică”. Arhivat din original la . Accesat în .
- ^ Elliot, L. H., McCormick, J. B., and Johnson, K. M. (1982). Inactivation of Lassa, Marburg, and Ebola viruses by Gamma irradiation. J. Clin. Microbiol., 16(4): 704–8. [nefuncțională]
- ^ Department of Health (2007). Transport of Infectious Substances Best Practice Guidance for Microbiology Laboratories. [nefuncțională – arhivă]
- ^ Geisbert TW, Jahrling PB. Differentiation of filoviruses by electron microscopy. Virus Res. Dec 1995; 39(2-3): 129-50.
- ^ Geisbert, T. W. and Jahrling, P. B. (1990). Use of immunoelectron microscopy to show Ebola virus during the 1989 United States epizootic. J. Clin. Pathol., 43: 813–16.
- ^ Baskerville, A., Fisher-Hoch, S. P., Neilds, G. H., and Dowsett, A. B. (1985). Ultrastructure pathology of experimental Ebola haemorrhagic fever virus infection. J. Path., 147: 199–209.
- ^ Ksiazek, T. G., Rollin, P. E., Jahrling, P. B., Johnson, E., Dalgard, D. W., and Peters, C. J. (1992). Enzyme immunosorbent assay for Ebola virus antigens in tissues of infected primates. J. Clin. Microbiol., 30: 947–50. [nefuncțională]
- ^ Zaki, S. R. et al. (1999). A novel immunohistochemical assay for the detection of Ebola virus in skin: implications for diagnosis, spread, and surveillance of Ebola hemorrhagic fever. Commission de Lutte contre les Epidemies a Kikwit. J. Infect. Dis., 179(Suppl.1): S36–47.
- ^ Leroy, E. M. et al. (2000). Diagnosis of Ebola haemorrhagic fever by RT-PCR in an epidemic setting. J. Med. Virol., 60: 463–67.
- ^ a b c d WHO. Urgently needed: rapid, sensitive, safe and simple Ebola diagnostic tests. 18 November 2014
- ^ WHO. First Antigen Rapid Test for Ebola through Emergency Assessment and Eligible for Procurement.
- ^ FDA. Emergency Use Authorizations.
- ^ WHO. ReEBOV™ Antigen Rapid Test Kit. Emergency Use Assessment and Listing for Ebola Virus Disease IVDs. Public Report.
- ^ ReEBOV™ Antigen Rapid Test (Ebolavirus VP40 Antigen Detection). Instructions for Use. 2015, Corgenix, Inc.
- ^ Ebola Virus Infection. Medscape
- ^ a b Danielle V. Clark, Peter B. Jahrling, James V. Lawler. Clinical Management of Filovirus-Infected Patients. Viruses 2012, 4, 1668-1686.
- ^ Warfield KL, Swenson DL, Olinger GG, Nichols DK, Pratt WD, Blouch R, et al. Gene-specific countermeasures against Ebola virus based on antisense phosphorodiamidate morpholino oligomers. PLoS Pathog 2006 ; 2 : e1.
- ^ Hensley LE, Stevens EL, Yan SB, Geisbert JB, Macias WL, Larsen T, et al. Recombinant human activated protein C for the postexposure treatment of Ebola hemorrhagic fever. J Infect Dis 2007 ; 196 Suppl 2 : S390-9.
- ^ Geisbert TW, Lee AC, Robbins M, Geisbert JB, Honko AN, Sood V, et al. Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference : A proof-ofconcept study. Lancet 2010 ; 375 : 1896-905.
- ^ Warren TK, Warfield KL, Wells J, Enterlein S, Smith M, Ruthel G, et al. Antiviral activity of a small-molecule inhibitor of filovirus infection. Antimicrob Agents Chemother 2010 ; 54 : 2152-9. [nefuncțională]
- ^ Warren TK, Warfield KL, Wells J, Swenson DL, Donner KS, Van Tongeren SA, et al. Advanced antisense therapies for postexposure protection against lethal filovirus infections. Nat Med 2010; 16 : 991-4.
- ^ WHO. Manual for the care and management of patients in Ebola Care Units/ Community Care Centres. Interim emergency guidance. 30 January 2015
- ^ a b Ebola, histoire secrète d'un sérum. Le Point. 20.08.2014
- ^ a b Statement on the WHO Consultation on potential Ebola therapies and vaccines. 5 September 2014. WHO
- ^ John Maurice. WHO meeting chooses untried interventions to defeat Ebola. The Lancet, Volume 384, Issue 9948, Pages e45 - e46, 20 September 2014
- ^ Jesse L. Goodman. Studying “Secret Serums” — Toward Safe, Effective Ebola Treatments. N Engl J Med 2014; 371:1086-1089. 18 septembrie 2014
- ^ Thomas W. Geisbert. Medical research: Ebola therapy protects severely ill monkeys. Nature. 2014 Aug 29.
- ^ Lei Zhang, Hao Wang. Forty years of the war against Ebola. Journal of Zhejiang University SCIENCE B. September 2014, Volume 15, Issue 9, pp 761-765
- ^ Ying Zhong, Jun Xu, TaiSheng Li, XueZhong Yu, MiaoMiao Sheng. Potential clinical treatment for Ebola pandemic. Science China Life Sciences. September 2014
- ^ a b „Categorization and prioritization of drugs for consideration for testing or use in patients infected with Ebola. WHO 15 January 2015” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ a b „Medicinal products under development for the treatment of Ebola. European Medicines Agency, 2015” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Ebola vaccines, therapies, and diagnostics. Questions and Answers. WHO, 21 January 2015
- ^ a b Mupapa K, Massamba M, Kibadi K, Kuvula K, Bwaka A, Kipasa M, et al.Treatment of Ebola hemorrhagic fever with blood transfusions from convalescent patients. J Infect Dis 1999 ; 179 : S18-23.
- ^ a b Jahrling PB, Geisbert JB, Swearengen JR, Larsen T, Geisbert TW. Ebola hemorrhagic fever : Evaluation of passive immunotherapy in nonhuman primates. J Infect Dis 2007 ; 196 Suppl 2 : S400-3.
- ^ Feldmann H, Geisbert TW. Ebola haemorrhagic fever. The Lancet 2011, 377 (9768): 849–862.
- ^ Ebola survivor Dr Kent Brantly gives blood to fellow medical missionary friend Dr Rick Sacra, currently being treated for the virus in Nebraska. Daily Mail. 11 September 2014
- ^ Ebola survivor donates blood to infected American. CNN. 12 septembrie 2014
- ^ Erik De Clerq. Carbocyclic adenosine analogues as S-adenosylhomocysteine hydrolase inhibitors and antiviral agents: recent advances.Nucleosides and Nucleotides, Volume 17, Issue 1-3, 1998
- ^ John Huggins, Zhen-Xi Zhang, Mike Bray. Antiviral Drug Therapy of Filovirus Infections: S-Adenosylhomocysteine Hydrolase Inhibitors Inhibit Ebola Virus In Vitro and in a Lethal Mouse Model. The Journal of Infectious Diseases 1999; 179(Suppl 1):S240–7
- ^ Sophie J. Smither, Lin S. Eastaugh, Jackie A. Steward, Michelle Nelson, Robert P. Lenk et Mark S. Lever, Post-exposure efficacy of Oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model, Antiviral Research, vol. 104, avril 2014, p. 153-155
- ^ Lisa Oestereich, Anja Lüdtke, Stephanie Wurr, Toni Rieger, César Muñoz-Fontela et Stephan Günther, Successful treatment of advanced Ebola virus infection with T-705 (favipiravir) in a small animal model, Antiviral Research, vol. 105, mai 2014, p. 17-21
- ^ „T-705. Toyama Chemical”. Arhivat din original la . Accesat în .
- ^ Megumi Fujikawa, Fujifilm Drug Eyed As Possible Treatment for Ebola Virus sur The Wall Street Journal Japan, 8 août 2014
- ^ „About Brincidofovir (Brinci, CMX001). Chimerix Fact Sheet” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ „Frequently Asked Questions on the Potential Use of Brincidofovir in the Ebola Outbreak. Chimerix”. Arhivat din original la . Accesat în .
- ^ Obama calls on other nations to step up their efforts to end Ebola outbreak. BMJ 2014, 07 October 2014.
- ^ „Dr. Diana Florescu. Omaha Science Media Project”. Arhivat din original la . Accesat în .
- ^ DF Florescu, SA Pergam, MN Neely, F Qiu et al. Safety and efficacy of CMX001 as salvage therapy for severe adenovirus infections in immunocompromised patients. Biology of Blood and Marrow Transplantation. Volume 18, Issue 5, May 2012, Pages 731–738.
- ^ Warren TK, Wells J, Panchal RG, et al. Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430. Nature 2014; 508:402-405
- ^ „Justin Julander. BCX4430, an adenosine analog, with potent activity against yellow fever virus in a hamster model. 2nd Antivirals Congress. 2012” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ „BCX4430. BioCryst Pharmaceuticals”. Arhivat din original la . Accesat în .
- ^ „BioCryst Receives Additional NIAID Funding for Manufacture and Development of BCX4430 to Treat Hemorrhagic Virus Diseases. BioCryst Pharmaceuticals Inc Press Release - BENNETT Robert - 18/09/2014”. Arhivat din original la . Accesat în .
- ^ Gene Garrard Olinger, James Pettitt, Do Kim, Cara Working, Ognian Bohorov, Barry Bratcher, Ernie Hiatt, Steven D. Hume, Ashley K. Johnson, Josh Morton, Michael Pauly, Kevin J. Whaley, Calli M. Lear, Julia E. Biggins, Corinne Scully, Lisa Hensley et Larry Zeitlin. Delayed treatment of Ebola virus infection with plant-derived monoclonal antibodies provides protection in rhesus macaques. Proceedings of the National Academy of Sciences of the United States of America, vol. 109, no 44, 30 octobre 2012, p. 18030-18035
- ^ „Pettitt J, Zeitlin L, Kim H, et al. Therapeutic intervention of Ebola virus infection in rhesus macaques with the MB-003 monoclonal antibody cocktail. Sci Transl Med 2013; 5: 199ra113 (2013)” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ ZMapp. Mapp Biopharmaceutical
- ^ X Qiu, G Wong, J Audet, A Bello, L Fernando et al. Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. Nature, 21 august 2014
- ^ Le ZMapp, un traitement contre Ebola expérimenté sur deux Américains infectés LeMonde, 5 aug. 2014
- ^ Dr. Kent Brantly, Nancy Writebol leave hospital after Ebola recovery. CBC Television, 21 aug. 2014
- ^ VIDEO. Ebola: le prêtre espagnol ayant reçu le sérum expérimental est décédé. L'Express, 12 aug. 2014
- ^ Why do two white Americans get the Ebola serum while hundreds of Africans die? The Washington Post, 6 aug. 2014
- ^ Liberia says US authorities OK use of experimental Ebola drug. CNBC, 11 aug. 2014
- ^ Obama: 'Premature' to Say U.S. Should Green-light New Ebola Drug. NBC News, 7 aug. 2014
- ^ Ethical considerations for use of unregistered interventions for Ebola virus disease (EVD). OMS, 12 aug. 2014
- ^ Andrew Pollack. As Ebola’s Toll Rises, Drug Makers Race to Test Medicines. New York Times, 13 aug. 2014
- ^ Thomas W. Geisbert, Amy C. H. Lee, Marjorie Robbins, Joan B. Geisbert, Anna N. Honko, Vandana Sood, Joshua C. Johnson, Susan de Jong, Iran Tavakoli, Adam Judge, Lisa E. Hensley et Ian MacLachlan. Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study. The Lancet, vol. 375, no 9792, 29 mai 2010, p. 1896-1905
- ^ About Investigational TKM-Ebola Therapeutic. Tekmira.
- ^ Tekmira Conference Call and Webcast Advisory: Corporate Update and Second Quarter Financial Results. Tekmira
- ^ Ebola: un traitement expérimental canadien suscite l'intérêt des Américains. Le Figaro, 9 aug. 2014
- ^ Patrick L. Iversen, Travis K. Warren, Jay B. Wells, Nicole L. Garza, Dan V. Mourich, Lisa S. Welch, Rekha G. Panchal and Sina Bavari. Discovery and Early Development of AVI-7537 and AVI-7288 for the Treatment of Ebola Virus and Marburg Virus Infections. Viruses 2012, 4(11), 2806-2830;
- ^ „AVI-7537 Sarepta Therapeutics”. Arhivat din original la . Accesat în .
- ^ A Study to Assess the Safety, Tolerability and Pharmacokinetics of AVI-7537 in Healthy Adult Volunteers" - ClinicalTrials.gov
- ^ Sarepta's AVI-7537: Hope for an Ebola Cure is Rekindled in Cambridge. BostInno BERNARD Gillis - 06/08/2014
- ^ Heald AE, Iversen PL, Saoud JB, Sazani P, Charleston JS, Axtelle T, Wong M, Smith WB, Vutikullird A, Kaye E. Safety and pharmacokinetic profiles of phosphorodiamidate morpholino oligomers with activity against Ebola virus and Marburg virus: results of two single ascending dose studies. Antimicrobial Agents and Chemotherapy, 25 august 2014.[nefuncțională]
- ^ Studies of AVI-6002 and AVI-6003 Are the First to Evaluate Safety and Tolerability of AVI's PMOplus Platform Chemistry in Humans. Sarepta Therapeutics.[nefuncțională]
- ^ „Jeffrey R. Kugelman, Mariano Sanchez-Lockhart, Kristian G. Andersen, Stephen Gire, Daniel J. Park, Rachel Sealfon, Aaron E. Lin, Shirlee Wohl, Pardis C. Sabeti, Jens H. Kuhn, Gustavo F. Palacios. Evaluation of the Potential Impact of Ebola Virus Genomic Drift on the Efficacy of Sequence-Based Candidate Therapeutics. mBio. 20 January 2015” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Jahrling PB, Geisbert TW, Geisbert JB, Swearengen JR, Bray M, Jaax NK, et al. Evaluation of immune globulin and recombinant interferon-α2b for treatment of experimental Ebola virus infections. J Infect Dis 1999 ; 179 : S224-S34.
- ^ Geisbert TW, Pushko P, Anderson K, Smith J, Davis KJ, Jahrling PB. Evaluation in nonhuman primates of vaccines against Ebola virus. Emerg Infect Dis 2002 ; 8 : 503-07.
- ^ Lupton HW, Lambert RD, Bumgardner DL, Moe JB, Eddy GA. Inactivated vaccine for Ebola virus efficacious in guinea pig model. Lancet 1980 ; 2 : 1294-95.
- ^ Xu L, Sanchez A, Yang Z-Y, Zaki SR, Nabel EG, Nichol ST, et al. Immunization for Ebola virus infection. Nature Med 1998 ; 4 : 37-42.
- ^ Pushko P, Bray M, Ludwig GV, Parker M, Schmaljohn A, Sanchez A, et al. Recombinant RNA replicons derived from attenuated Venezuelan equine encephalitis virus protect guinea pigs and mice from Ebola hemorrhagic fever virus. Vaccine 2000 ; 19 : 142-53.
- ^ „Rao M, Bray M, Alving CR, Jahrling P, Matyas GR. Induction of immune responses in mice and monkeys to Ebola virus after immunization with liposome-encapsulated irradiated Ebola virus : Protection in mice requires CD4(+) T cells. J Virol 2002 ; 76 : 9176-85”. Arhivat din original la . Accesat în .
- ^ Thomas Hoenen, Allison Groseth, Heinz Feldmann. Current Ebola vaccines. Expert Opin Biol Ther. 2012 July ; 12(7): 859–872.
- ^ a b Steven B Bradfute, John M Dye, Sina Bavari. Filovirus vaccines. Human Vaccines 7:6, 701-711; June 2011
- ^ Sullivan NJ, Geisbert TW, Geisbert JB, Xu L, Yang Z-Y, Roederer M, et al. Accelerated vaccination for Ebola virus haemorrhagic fever in nonhuman primates. Nature 2003 ; 424 : 681-84.
- ^ Gary J. Nabel, Nancy J. Sullivan, Thomas W. Geisbert, Peter B. Jahrling. Method of accelerated vaccination against Ebola viruses. US Patent, 2009
- ^ Jones SM, Feldmann H, Stroher U, Geisbert JB, Fernando L, Grolla A, et al. Live attenuated recombinant vaccine protects nonhuman primates against Ebola and Marburg viruses. Nat Med 2005 ; 11 : 786-90.
- ^ Sullivan NJ, Geisbert TW, Geisbert JB, Shedlock DJ, Xu L, Lamoreaux L, et al. Immune protection of nonhuman primates against Ebola virus with single low-dose adenovirus vectors encoding modified GPs. PLoS Med 2006 ; 3 : e177.
- ^ a b Feldmann H, Jones SM, Daddario-DiCaprio KM, Geisbert JB, Stroher U, Grolla A, et al. Effective post-exposure treatment of Ebola infection. PLoS Pathog 2007 ; 3 : e2.
- ^ Bukreyev A, Rollin PE, Tate MK, Yang L, Zaki SR, Shieh WJ, et al. Successful topical respiratory tract immunization of primates against Ebola virus. J Virol 2007 ; 81 : 6379-88. [nefuncțională]
- ^ a b Warfield KL, Swenson DL, Olinger GG, Kalina WV, Aman MJ, Bavari S. Ebola virus-like particle- based vaccine protects nonhuman primates against lethal Ebola virus challenge. J Infect Dis 2007 ; 196 Suppl 2 : S430-7.
- ^ a b Geisbert TW, Daddario-Dicaprio KM, Lewis MG, Geisbert JB, Grolla A, Leung A, et al. Vesicular stomatitis virus-based Ebola vaccine is well-tolerated and protects immunocompromised nonhuman primates. PLoS Pathog 2008 ; 4 : e1000225.
- ^ Geisbert TW, Daddario-DiCaprio KM, Williams KJ, Geisbert JB, Leung A, Feldmann F, et al. Recombinant vesicular stomatitis virus vector mediates postexposure protection against Sudan Ebola hemorrhagic fever in nonhuman primates. J Virol 2008 ; 82 : 5664-8. [nefuncțională]
- ^ „Swenson DL, Wang D, Luo M, Warfield KL, Woraratanadharm J, Holman DH, et al.Vaccine to confer to nonhuman primates complete protection against multistrain Ebola and Marburg virus infections. Clin Vaccine Immunol 2008 ; 15 : 460-7”. Arhivat din original la . Accesat în .
- ^ „Geisbert TW, Geisbert JB, Leung A, Daddario- DiCaprio KM, Hensley LE, Grolla A, et al. Single- injection vaccine protects nonhuman primates against infection with Marburg virus and three species of Ebola virus. J Virol 2009 ; 83 : 7296-304”. Arhivat din original la . Accesat în .
- ^ „Pratt WD, Wang D, Nichols DK, Luo M, Woraratanadharm J, Dye JM, et al. Protection of nonhuman primates against two species of Ebola virus infection with a single complex adenovirus vector. Clin Vaccine Immunol 2010 ; 17 : 572-81”. Arhivat din original la . Accesat în .
- ^ Hensley LE, Mulangu S, Asiedu C, Johnson J, Honko AN, Stanley D, et al. Demonstration of cross-protective vaccine immunity against an emerging pathogenic Ebolavirus Species. PLoS Pathog 2010 ; 6 : e1000904.
- ^ „Alison P. Galvani, Martial L. Ndeffo-Mbah, Natasha Wenzel, James E. Childs. Ebola Vaccination: If Not Now, When? Annals of Internal Medicine, 2014 Aug 21” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Darryl Falzarano, Thomas W Geisbert, Heinz Feldmann. Progress in filovirus vaccine development: evaluating the potential for clinical use. Expert Rev Vaccines. 2011 January ; 10(1): 63–77.
- ^ Blaney JE, Wirblich C, Papaneri AB, Johnson RF, Myers CJ, Juelich TL, et al. Inactivated or live-attenuated bivalent vaccines that confer protection against rabies and Ebola viruses. J Virol. 2011; 85:10605-16. [nefuncțională]
- ^ Joseph E. Blaney, Andrea Marzi, Mallory Willet, Amy B. Papaneri, Christoph Wirblich, Friederike Feldmann, Michael Holbrook, Peter Jahrling, Heinz Feldmann et Matthias J. Schnell. Antibody Quality and Protection from Lethal Ebola Virus Challenge in Nonhuman Primates Immunized with Rabies Virus Based Bivalent Vaccine, PLoS Pathogens, vol. 9, no 5, 30 mai 2013
- ^ Rabies Vaccine Protects Nonhuman Primates Against Deadly Ebola Virus. NIAID, 15 juillet 2013.
- ^ „Martin JE, Sullivan NJ, Enama ME, Gordon IJ, Roederer M, Koup RA, et al. A DNA vaccine for Ebola virus is safe and immunogenic in a phase I clinical trial. Clin Vaccine Immunol. 2006; 13:1267-77”. Arhivat din original la . Accesat în .
- ^ „Bukreyev A, Yang L, Zaki SR, Shieh WJ, Rollin PE, Murphy BR, et al. A single intranasal inoculation with a paramyxovirus-vectored vaccine protects guinea pigs against a lethal-dose Ebola virus challenge. J Virol. 2006; 80:2267-79”. Arhivat din original la . Accesat în .
- ^ Tsuda Y, Caposio P, Parkins CJ, Botto S, Messaoudi I, Cicin-Sain L, et al. A replicating cytomegalovirus-based vaccine encoding a single Ebola virus nucleoprotein CTL epitope confers protection against Ebola virus. PLoS Negl Trop Dis. 2011; 5
- ^ Phoolcharoen W, Dye JM, Kilbourne J, Piensook K, Pratt WD, Arntzen CJ, et al. A nonreplicating subunit vaccine protects mice against lethal Ebola virus challenge. Proc Natl Acad Sci USA. 2011; 108:20695-700.
- ^ „Ebola vaccine trials fast-tracked by international consortium. GSK”. Arhivat din original la . Accesat în .
- ^ Stefano Colloca, Antonella Folgori et al. Generation and screening of a large collection of novel simian Adenovirus allows the identification of vaccine vectors inducing potent cellular immunity in humans. A range of novel simian adenoviral vectors, which are capable of priming high levels of T cell responses in man, has been defined. Sci Transl Med. 2012 January 4; 4(115)
- ^ DA Stanley, AN Honko, C Asiedu, JC Trefry. Chimpanzee adenovirus vaccine generates acute and durable protective immunity against ebolavirus challenge. Nature Medicine. 2014 Sep 7.
- ^ Bioterrorism Agents/Diseases. CDC
- ^ Mariapia Viola Magni. Detection of Bacteria, Viruses, Parasites and Fungi: Bioterrorism Prevention (NATO Science for Peace and Security Series A: Chemistry and Biology). Springer; 2010
- ^ Jonathan M. McComb. Closing Pandora’s Box: The Threat of Terrorist Use of Weapons of Mass Destruction. Global Security Studies, Winter 2013, Volume 4, Issue 1
- ^ Dan Longo, Anthony Fauci, Dennis Kasper. Harrison's Principles of Internal Medicine. 18th edition. 2011
- ^ Why Ebola worries the Defense Department. Washington Post. Aug 5, 2014
Bibliografie[modificare | modificare sursă]
- WHO. Manual for the care and management of patients in Ebola Care Units/ Community Care Centres. Interim emergency guidance. 30 January 2015
- Infecția cu virus EBOLA. Institutul Național de Sănătate Publică. Arhivat în , la Wayback Machine.
- Hotărâre nr.4 privind aprobarea procedurilor operaționale pentru managementul cazului suspect/confirmat cu boala produsă de virusul Ebola. Guvernul României. Comitetul național pentru situații speciale de urgentă. 08.10.2014 Arhivat în , la Wayback Machine.
- Elvira Sînziana Ciufescu. Virusologie medicală. Editura Medicală Națională. 2003
- Aurel Ivan. Tratat de epidemiologie a bolilor transmisibile. Polirom 2002
- S.R. Palmer, Lord Soulsby, D.I.H. Simpson. Zoonoze. Editura Științelor Medicale. 2005
- A. Cupșa. Boli infecțioase transmisibile. Curs universitar și recomandări pentru activitate practică. Ediția medicală, Universitatea Craiova, 2007.
- Costin Cernescu. Virusologie medicală. Editura Medicală. 2012
- Viorel Alexandrescu. Informatii despre Ebola. Curs. INCDMI Cantacuzino. Facultatea de Medicina - Universitatea “Titu Maiorescu“ Arhivat în , la Wayback Machine.
- Klenk, Hans-Dieter (ianuarie 1999). Marburg and Ebola Viruses (Current Topics in Microbiology and Immunology). Springer-Verlag Telos. ISBN 978-3-540-64729-4. Parametru necunoscut
|locație=ignorat (ajutor) - Klenk, Hans-Dieter; Feldmann, Heinz (). Ebola and Marburg viruses: molecular and cellular biology. Horizon Bioscience. ISBN 978-0-9545232-3-7. Parametru necunoscut
|locație=ignorat (ajutor) - Kuhn, Jens H. (). Filoviruses: A Compendium of 40 Years of Epidemiological, Clinical, and Laboratory Studies. Archives of Virology Supplement, vol. 20. SpringerWienNewYork. ISBN 978-3-211-20670-6. Parametru necunoscut
|locație=ignorat (ajutor) - McCormick, Joseph; Fisher-Hoch, Susan (). Level 4: Virus Hunters of the CDC. Horvitz, Leslie Alan (ed. a 3-a). Barnes & Noble. ISBN 978-0-7607-1208-5.
- Pattyn, S. R. (). Ebola Virus Haemorrhagic Fever. Elsevier/North-Holland Biomedical Press. ISBN 0-444-80060-3. Arhivat din original la . Accesat în . Parametru necunoscut
|locație=ignorat (ajutor) - Ryabchikova, Elena I.; Price, Barbara B. (). Ebola and Marburg Viruses: A View of Infection Using Electron Microscopy. Battelle Press. ISBN 978-1-57477-131-2. Parametru necunoscut
|locație=ignorat (ajutor) - Virusul Ebola. Informații pentru personalul medical. Institutul Național de Sănătate Publică, Ministerului Sănătății Arhivat în , la Wayback Machine.
- Ebola virus disease. World Health Organization (WHO)
- Ebola Virus Infection. eMedicine, Medscape.
- Ebola Hemorrhagic Fever. Center for Disease Control and Prevention USA
- About Ebola Hemorrhagic Fever. Center for Disease Control and Prevention USA
- Ebola Hemorrhagic Fever. Fact Sheet. Center for Disease Control and Prevention USA
- S.R. Palmer, Lord Soulsby, Paul Torgerson, David W. G. Brown. Oxford Textbook of Zoonoses: Biology, Clinical Practice, and Public Health Control (2 ed.). 2011
- Jeremy Farrar, Peter Hotez, Thomas Junghanss. Manson's Tropical Diseases: Expert Consult - Online and Print, 23ed, 2013
- Mandell Douglas And Bennett's - Principles And Practice Of Infectious Diseases - 7th Edition 2010
- Brian W.J. Mahy, Marc H.V. van Regenmortel. Desk Encyclopedia of Human and Medical Virology. 2010
- Jean-Marie Huraux, Jean-Claude Nicolas, Henri Agut, Hélène Peigue-Lafeuille. Traité de virologie médicale, 2003
Legături externe[modificare | modificare sursă]
- WHO. Situation reports: Ebola response roadmap
- OMS. Documentation sur la maladie à virus Ebola 2014-2015
- WHO. Technical guidance on Ebola virus disease preparedness and response
- ViralZone: Ebola-like viruses – Baza de date virologică a Institutului Elvețian de Bioinformatică, accesat la 6 septembrie 2014
- CDC: Ebola hemorrhagic fever – Centers for Disease Control and Prevention, Special Pathogens Branch, accesat la 6 septembrie 2014
- WHO: Ebola haemorrhagic fever – Organizația Mondială a Sănătății, Alerta Globală și Reacție, accesat la 6 septembrie 2014
- Virus Pathogen Database and Analysis Resource (ViPR): Filoviridae, accesat la 6 septembrie 2014
- 3D macromolecular structures of the Ebola virus archived in the EM Data Bank(EMDB) Arhivat în , la Wayback Machine., accesat la 6 septembrie 2014
- Google Map of Ebola Outbreaks Arhivat în , la Wayback Machine., accesat la 6 septembrie 2014
- Understanding the Ebola virus, 5 noiembrie 2014, John Timmer, Ars Technica
- Cum a fost descoperit, de fapt, virusul Ebola, 19 iulie 2014, Radu Eremia, Adevărul
- Science Documentary Ebola - Ebola Virus Documentary. National Geographic. YouTube Video
