Utilizator:XXxWikipedianxXx/test1
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |

Proteinele sunt substanțe organice macromoleculare formate din lanțuri simple sau complexe de aminoacizi; ele sunt prezente în celulele tuturor organismelor vii în proporție de peste 50% din greutatea uscată. Toate proteinele sunt polimeri ai aminoacizilor, în care secvența acestora este codificată de către o genă. Fiecare proteină are secvența ei unică de aminoacizi, determinată de secvența nucleotidică a genei. Celula nu are funcția de a face proteina.
Etimologie
[modificare | modificare sursă]Prima menționare a cuvântului proteină a fost făcută de către Jakob Berzelius, descoperitorul acestora, în scrisoarea sa către Gerhardus Johannes Mulder din 10 iulie 1838, scrisoare în care menționează:
„The name protein that I propose for the organic oxide of fibrin and albumin, I wanted to derive from [the Greek word] πρωτειος, because it appears to be the primitive or principal substance of animal nutrition”.
(Numele de proteină pe care îl propun pentru denumirea compusului organic rezultat prin oxidarea fibrinei sau albuminei, l-am derivat din grecescul πρωτειος (proteios) deoarece pare a fi substanța primitivă sau principală din nutriția animalelor).

Sinteza proteinelor
[modificare | modificare sursă]Biosinteza
[modificare | modificare sursă]
Biosinteza proteinelor este un proces prin care fiecare celulă își sintetizează proteinele proprii, prin intermediul unui proces care include multe etape, sinteza începând cu procesul de transcripție și terminând cu procesul de translație. Procesul deși similar, este diferit în funcție de celulă, eucariotă sau procariotă.
Transcripția
[modificare | modificare sursă]Procesul de transcripție necesită prezența unei singure molecule de ADN dublu catenar, numit ADN „șablon”, moleculă care intră în procesul de „inițiere”. Aici acționează enzima ARN polimeraza, enzimă care se leagă de o anumită regiune din molecula de ADN, regiune (denumită promoter), de unde va începe transcripția. Pe măsură ce ARN polimeraza se leagă de promoter, lanțurile de ADN vor începe să se desfacă. Următorul proces în care intră ADN-ul este procesul de elongație (alungire a catenei). Pe măsură ce ARN polimeraza se mișcă de-a lungul catenei de ADN, are loc sinteza ribonucleotidelor complementare (ARNm - ARN mesager). Acest ARN, după cum îi arată și numele, se poate deplasa și în alte părți ale celulei cum ar fi reticulul endoplasmatic sau citoplasma.

. Are loc adiția unei grupări 5', grupare dinucleotidică care are rolul de a asigura stabilitatea ARN și de a-l transforma în ARN matur. O secvență de aminoacizi este grefată în poziția 3' terminală pentru protecție dar și pentru a sluji drept șablon pentru procesele următoare.Mai departe are loc formarea ARN, care este apoi utilizat in ribozomi pentru sinteza proteinelor. La procariote legarea ARN de ribosomi are loc după ce acesta este îndepărtat de nucleoid; în contrast la eucariote acest proces are loc chiar în membrana nucleară și apoi translocat în citoplasmă. Rata sintezei proteice poate ajunge la circa 20 aminoacizi la procariote, mult mai puțin la eucariote.
Translația
[modificare | modificare sursă]În timpul translației ARNm transcris din ADN este decodat de ribozomi pentru sinteza proteinelor.Acest proces este divizat în 3 etape:
- Inițierea
- Elongarea
- Faza terminală.
Ribozomul are situsuri de legare care permit altei molecule de ARNt (ARN de transfer), să se lege de o moleculă de ARn m, proces însoțit de prezența unui anticodon. Pe măsură ce ribozomul migrează de-a lungul moleculei de ARNm (un codon o dată) o altă moleculă de ARNt este atașată ARNm. Are loc eliberarea ARNt primar, iar aminoacidul care este atașat de acesta este legat de ARNt secundar, care îl leagă de o altă moleculă de aminoacid. Translația continuă pe măsură ce lanțul de aminoacid este format. La un moment dat apare un codon de stop, o secvență formată din 3 nucleotide (UAG, UAA), care semnalează sfîrșitul lanțului proteic. Chiar după terminarea translației lanțurile proteice pot suferi modificări post-translaționale și plierea lanțului proteic, responsabilă de structura secundară și cea terțiară. Modificările post-translaționale se referă la posibilitatea formării de legături disulfidice, sau de atașarea la scheletul proteic a diferite grupări ca rol biochimic: acetat, fosfat etc.
Sinteza chimică
[modificare | modificare sursă]Procesul de sinteză chimică poate avea loc în laborator, dar pentru lanțuri mici de proteine. O serie de reacții chimice cunoscute sub denumirea de sinteza peptidelor, permit producerea de cantități mari de proteine. Prin sinteza chimică se permite introducerea în lanțul proteic a aminoacizilor ne-naturali, atașarea de exemplu a unor grupări fluorescente. Metodele sunt utilizate în biochimie și în biologia celulei. Sinteza are la bază cuplarea grupării carboxil -COOH (carbon terminus) cu gruparea -amino -NH2 (segmentul N terminus). Se cunosc 2 metode de sinteză pe cale chimică_
- Sinteza în fază lichidă, metoda clasică, care a fost înlocuită cu sinteza în fază solidă.
- Sinteza în fază solidă (solid-phase peptide synthesis, SPPS), a cărei bază a fost pusă de Robert Bruce Merrifield. Prin acestă metodă, se pot sintetiza proteine D, cu aminoacizi D. În prima fază Merrifield a folosit metoda tBoc (terț-butil-oxi-carbonil). Pentru înlăturarea acestuia din lanțul peptidic se folosește acidul fluorhidric (HF), care este foarte nociv, periculos, iar din acest motiv, metoda nu se mai utilizează. Atunci când este vorba de sinteza analogilor peptidici non-naturali de tip bază (depsi-peptidele) este necesară.
O altă metodă este cea introdusă de Robert C. Sheppard (1932–2019) în anul 1971, și are la bază folosirea Fmoc (fluorenil metoxi carbonil), iar pentru îndepărtarea acesteia se folosește de obicei mediu bazic asigurat de o soluție 20% piperidină/DMF (dimetil formamidă). Îndepărtarea grupării din lanțul proteic se face prin incubare în acid trifluoracetic (TFA).

Protejarea grupării prin intermediul Fmoc este de obicei lentă, deoarece anionul nitro produs la sfârșitul reacției nu este un produs favorabil desfășurării reacției.
Rol
[modificare | modificare sursă]Datorită compoziției, fiind formate exclusiv din aminoacizi, se întâlnesc alături de alți compuși importanți de tipul polizaharidelor, lipidelor și acizilor nucleici începând cu structura virusurilor, a organismelor procariote, eucariote și terminând cu omul. Practic nu se concepe viață fără proteine. Proteinele pot fi enzime care catalizează diferite reacții biochimice în organism, altele pot juca un rol important în menținerea integrității celulare (proteinele din peretele celular), în răspunsul imun și autoimun al organismului.
Nutriția
[modificare | modificare sursă]Majoritatea microorganismelor și plantelor pot sintetiza toți cei 20 aminoacizi standard, în timp ce organismele animale obțin anumiți aminoacizi din dietă (aminoacizii esențiali). Enzime cheie, cum ar fi de exemplu aspartat kinaza, enzimă care catalizează prima etapă în sinteza aminoacizilor lizină, metionină și treonină din acidul aspartic, nu sunt prezente în organismele de tip animal. La aceste organisme aminoacizii se obțin prin consumul hranei conținând proteine. Proteinele ingerate sunt supuse acțiunii acidului clorhidric din stomac și acțiunii enzimelor numite proteaze, proces în urma căruia lanțurile proteice sunt scindate (denaturate). Ingestia aminoacizilor esențiali este foarte importantă pentru sănătatea organismului, deoarece fără acești aminoacizi nu se poate desfășura sinteza proteinelor necesare organismului. De asemenea, aminoacizii sunt o sursă importantă de azot; unii aminoacizi nu sunt utilizați direct în sinteza proteică, ci sunt introduși în procesul de gluconeogeneză, proces prin care organismul asigură necesarul de glucoză în perioadele de înfometare (mai ales proteienele aflate în mușchi).
Tipuri de proteine
[modificare | modificare sursă]În funcție de compoziția lor chimică ele pot fi clasificate în:
- Holoproteine cu următoarele clase de proteine
- Proteine globulare (sferoproteine) sunt de regulă substanțe solubile în apă sau în soluții saline: protaminele, histonele, prolaminele, gluteinele, globulinele, albuminele.
- Proteinele fibrilare (scleroproteinele) caracteristice regnului animal, cu rol de susținere, protecție și rezistență mecanică: colagenul, cheratina și elastina.
- Heteroproteinele sunt proteine complexe care sunt constituite din o parte proteică și o parte prostetică; în funcție de această grupare se pot clasifica astfel:
- Glicoproteine
- Lipoproteine
- Nucleoproteine
Proprietăți fizico-chimice
[modificare | modificare sursă]Masă moleculară
[modificare | modificare sursă]Datorită formării aproape în exclusivitate din aminoacizi, putem considera proteinele ca fiind de fapt niște polipeptide, cu masă moleculară foarte mare, între 10.000 și 60.000.000. Masa moleculară se determină prin diferite metode, mai ales în cazul proteinelor cu masa moleculară foarte mare ca de exemplu proteina C reactivă. Masa moleculară a diferitelor proteine
| Denumirea proteinei | Sursa proteinei/Izolată din | Masa moleculară |
|---|---|---|
| Lactalbumină | lapte | 17.000 |
| Gliadina | grîu | 27.500 |
| Insulina | pancreas | 12,000 |
| Hordeina | orz | 27.500 |
| Hemoglobina | globule roșii | 68.000 |
| Hemocianina | moluște(sînge) , artropode(sînge) | 2.800.00 |
| Miozina | mușchi | 850.000 |
| Pepsină | stomac | 36.000 |
| Peroxidaza | rinichi | 44.000 |
| Virusul mozaicului tutunului (capsida) | tutun | 17.000.000 |
Deoarece la multe proteine masa moleculară apare ca un multiplu de 17,500, multă vreme s-a mers pe ipoteza că particulele proteice sunt formate prin unirea mai multor molecule de bază ce au masa moleculară în jurul valorii de 17,500. Aceste molecule de bază s-ar putea uni între ele prin așa numitele valențe reziduale, ducând la formarea de agregate moleculare. Atunci când are loc ruperea acestor valențe reziduale ar avea loc doar modificarea proprietăților fizice ale proteinelor, în timp ce dacă are loc ruperea legăturilor principale (legăturile peptidice), proteina își modifică proprietățile fizico-chimice.
Solubilitatea proteinelor
[modificare | modificare sursă]Proteinele sunt substanțe solide, macromoleculare, solubile în general în apă și insolubile în solvenți organici nepolari. Unele proteine sunt solubile în apă dar insolubile în alcool, altele sunt solubile în soluții apoase de electroliți, acizi organici. Datorită gradului diferit de solubilitate în diferiți solvenți, proteinele se pot izola, identifica și separa. Solubilitatea lor depinde foarte mult de legăturile care se stabilesc între grupările libere de la suprafața macromoleculelor și moleculele solventului. La suprafața macromoleculelor proteice se găsesc grupări libere de tip polar,-COOH, -NH2, -OH, -SH, -NH, grupări cu caracter hidrofil care favorizează dizolvarea proteinelor în apă. De asemenea există grupări de tip apolar, hidrofobe, de regulă radicali de hidrocarburi -CH3, -C6H5, -C2H5, care favorizează dizolvarea proteinelor în alcool. Însă în marea lor majoritate predomină grupările polare, determinante pentru caracterul hidrofil. În contact cu apa proteinele greu solubile manifestă fenomenul de gonflare, datorită tendinței de hidratare datorată grupărilor polare. Gelatina de exemplu se îmbibă foarte puternic cu apa dând naștere prin răcire la geluri. La dizolvarea proteinelor în apă, are loc fenomenul de formare a coloizilor hidrofili. S-a constatat că în soluții diluate se găsesc macromolecule proteice izolate, iar în cazul soluțiilor concentrate se formează agregate de macromolecule proteice. Soluțiile coloidale ale proteinelor, coagulează prin încălzire, prezintă efectul Tyndall (dispersia fasciculului de lumină).
Punctul izoelectric și caracterul amfoter
[modificare | modificare sursă]Caracter amfoter
[modificare | modificare sursă]Proteinele, la fel ca și aminoacizii, sunt substanțe amfotere și formează în soluții apoase amfioni: , în prezența H2O
În mediu acid proteinele se comportă ca baze slabe, ele primind protoni și formând cationi proteici: , cation al proteinei. Reacția stă la baza electroforezei proteinelor, datorită încărcării pozitive cationii migrează spre catod, fenomen numit cataforeză, proteina fiind în acest caz electropozitivă.
În mediu bazic proteinele se comportă ca acizii slabi, ele cedând protoni, se formează astfel anioni proteici, care migrează spre anod fenomenul fiind denumit anaforeză, proteina avînd încărcare electronegativă. , anion al proteinei.
Datorită caracterului amfoter proteinele pot neutraliza cantități mici de substanță acidă sau bazică, având în acest fel rol de soluție tampon, prin acest lucru contribuind la menținerea echilibrului acido-bazic al organismului. În general caracterul amfoter este imprimat de grupările -NH2 și -COOH libere care nu sunt implicate în legăturile peptidice. Dacă în molecula proteinei există mai mulți aminoacizi dicarboxilici atunci molecula se va comporta ca un acid slab, iar în cele în care predomină aminoacizii diaminați se comportă ca baze slabe. Chiar dacă într-o moleculă există un număr egal de grupări amino și carboxil, deci teoretic molecula ar trebui sa fie neutră, în realitate datorită gradului de ionizare mult mai mare a grupării carboxil față de gruparea amino, molecula proteinei va avea un caracter slab acid, în soluția ei întâlnindu-se amfioni proteici, anioni proteici și protoni (H+).
Punct izoelectric
[modificare | modificare sursă]Prin acidulare echilibrul reacției se deplasează spre formarea de cationi proteici. La o anumită concentrație a H+, proteina devine neutră deoarece gruparea aminică și cea carboxilică sunt la fel de disociate și deci molecula este neutră din punct de vedere electric. În acel moment se vor găsi în soluție amfiioni, H+, ioni hidroxil -HO; pH-ul la care soluția unei proteine conține anioni și cationi în proporție egală poarta denumirea de punct izoelectric, se notează cu pHi, fiind o constantă foarte importantă a proteinelor. Fiecare proteină la punctul izoelectric are un comportament specific, având o solubilitate și reactivitate chimică minimă; de asemenea hidratarea particulelor coloidale, vâscozitatea și presiunea osmotică sunt de asemenea minime. Precipitarea proteinei la punctul izoelectric este în schimb maximă, dar nu se deplasează sub influența curentului electric. De obicei valorile punctului izoelectric variază între 2,9 și 12,5 [1] [2] și se determină prin diferite metode: potențiometrice, electroforetice.
Precipitarea proteinelor
[modificare | modificare sursă]Sub acțiunea diferiților factori fizici (ultrasunete, radiații cu diferite lungimi de undă, căldură), factori chimici (acizi, baze, diferiți solvenți organici), sau mecanici (agitare), are loc fenomenul de precipitare a proteinelor, precipitarea care poate fi reversibilă sau ireversibilă.
Precipitare reversibilă
[modificare | modificare sursă]Precipitarea reversibilă se poate produce sub acțiunea soluțiilor concentrate ale sărurilor alcaline dar și în prezența unor dizolvanți organici miscibili cu apa în orice proporție, cum sunt de exemplu acetona și alcoolul. În cadrul acestei precipitări molecula proteinei suferă unele modificări fizico-chimice, dar nu are loc afectarea structurii moleculare. Puterea de precipitare a proteinelor de către diferiți ioni este data de seria liofilă a lui Franz Hofmeister [3]. Dacă anionul rămâne același, puterea de precipitare a cationilor scade în următoarea ordine: Li+>Na+>NH4+> când cationul rămâne același anionii se comportă astfel: SO42->PO43->CH3COO->Citrat->tartrat->Cl->NO3->ClO3->Br->I->SCN-. Solvenții de tipul alcoolului sau acetonei, în funcție de concentrația lor, pot forma fie precipitate reversibile, fie ireversibile. Sărurile alcaline au un comportament diferit față de proteine, în soluții diluate mărind solubilitatea proteinelor, iar în soluții concentrate determinând precipitarea lor reversibilă. De altfel soluțiile sărurilor alcaline de diferite concentrații se folosesc pentru precipitarea fracționată a proteinelor din amestecuri.
Precipitare ireversibilă
[modificare | modificare sursă]În cursul acestei precipitări molecula proteinei suferă modificări fizico-chimice ireversibile având loc și modificarea structurii moleculare. De regulă se produce la adăugarea de soluții ale metalelor grele (Cu,Pb, Hg, Fe), a acizilor minerali tari (HNO3, H2SO4) acidul tricloracetic, a soluțiilor concentrate de alcool sau acetonă, sau, în cazul anumitor proteine, în prezența căldurii. Prin precipitare ireversibilă proteinele își pierd activitatea biologică (enzimatică, hormonală, etc.), are loc o descreștere a solubilității, modificarea activității optice și, de asemenea, sunt mai ușor de degradat sub acțiunea unor enzime proteolitice. Prin îndepărtarea factorilor care au dus la precipitare, proteinele nu revin la forma lor inițială și nu își pot reface structura moleculară. Proteinele precipitate își pierd din proprietățile hidrofile „obținând” proprietăți hidrofobe.
Proprietăți chimice
[modificare | modificare sursă]Aminoacizi standard
[modificare | modificare sursă]Din punct de vedere chimic, proteinele sunt heteropolimeri constituiți din 20 de L-α aminoacizi (așa numiții aminoacizi standard, vezi tabelul), în care grupările carboxil se pot combina cu grupările amino formând legături peptidice și rezultând lanțurile peptidice. Aminoacizii standard au proprietăți variate, proprietăți care sunt direct responsabile de structura tridimensională a proteinei, dar și de proprietățile acesteia.
| Denumirea (Residue) | cod 3-litere |
cod 1 literă code |
Abundență />(%) E.C. |
|---|---|---|---|
| Alanină | ALA | A | 13.0 |
| Arginină | ARG | R | 5.3 |
| Asparagină | ASN | N | 9.9 |
| Aspartat | ASP | D | 9.9 |
| Cisteină | CYS | C | 1.8 |
| Acid glutamic | GLU | E | 10.8 |
| Glutamină | GLN | Q | 10.8 |
| Glicină | GLY | G | 7.8 |
| Histidină | HIS | H | 0.7 |
| Izoleucină | ILE | I | 4.4 |
| Leucină | LEU | L | 7.8 |
| Lizină | LYS | K | 7.0 |
| Metionină | MET | M | 3.8 |
| Fenilalanină | PHE | F | 3.3 |
| Prolină | PRO | P | 4.6 |
| Serină | SER | S | 6.0 |
| Treonină | THR | T | 4.6 |
| Triptofan | TRP | W | 1.0 |
| Tirozină | TYR | Y | 2.2 |
| Valină | VAL | V | 6.0 |
(4) În lanțul polipeptidic aminoacizii formează legăturile peptidice prin cuplarea grupei carboxil cu o grupă amino; odată legat în lanțul proteic aminoacidul se "transformă" în aminoacid "rezidual" iar atomii de carbon, azot, hidrogen și oxigen implicați în legături formează "scheletul" proteinei. Atunci cînd lanțul proteic se termină cu o grupă carboxil poartă denumirea de carboxi-terminus (sau C -terminus), în timp ce, dacă se termină cu gruparea amino, devine amino-terminus (N-terminus).
Responsabile de proprietățile chimice sunt aceleași grupări carboxil și amino libere, neimplicate în formarea legăturilor peptidice, însă mai intervin și diferiții radicali grefați pe scheletul proteinei.
- Datorită grupărilor carboxil și amino libere ele dau aceleași reacții ca și la aminoacizi.
- Caracterul amfoter este responsabil de formarea de săruri atât cu bazele cât și cu acizii
- Legătura peptidică este responsabilă de formarea de combinații complexe denumie chelați.
- Prezența diferiților radicali alchilici, sau arilici determină formarea unor derivați ai substanțelor proteice (derivații halogenați și nitrici sunt cei mai importanți).
Reacții de culoare
[modificare | modificare sursă]Datorită existenței anumitor aminoacizi în molecula proteinelor, a legăturilor peptidice formate în molecula proteinei dar și grupările funcționale libere sunt responsabile de reacțiile de culoare.
| Denumirea reacției | Reactivul folosit | Culoarea rezultată | Tipul de aminoacid identificat |
|---|---|---|---|
| Xantoproteică | acid azotic,hidroxid de amoniu | portocalie | aminoacizii aromatici (formează nitroderivați) |
| Millon | azotat de mercur în acid azotic/azotit | precipitat roșu cărămiziu sau colorație roșie | aminoacizi ciclici cu grupare hidroxil (tirozina) |
| Sulfurii de plumb | Acetat sau azotat de plumb în mediu alcalin | precipitat negru de sulfură de plumb | aminoacizi cu sulf în moleculă : cisteină, metionină cistină |
| Sakaguchi | α naftol și hipoclorit de sodiu în mediu bazic | roșie carmin | arginină cu grupare guanidinică |
| Adamkiewicz-Hopkins | acid acetic glacial/acid glioxilic/acid sulfuric fumans | violetă | aminoacid cu nucleu indolic (triptofan) |
| Pauly | carbonat de sodiu și acid diazobenzen sulfonic | roșie vișinie | histidină și tirozină |
| Ninhidrinei | ninhidrină | albastră | caracteristică atît pentru aminoacizi cît și pentru proteine |
| Biuretului | soluție diluată de sulfat de cupru în mediu bazic | albastră violetă | legatura peptidică și se datorează formării de combinații complexe |
| Biuretului | nichel în mediu bazic | portocalie | legătura peptidică |
| Nitroprusiatului de sodiu | nitroprusiat de sodiu în soluție amoniacală | roșie | aminoacizi cu grupăre tiol (-SH) liberă |

Structura proteinelor
[modificare | modificare sursă]După cum s-a văzut mai sus lanțurile peptidice sunt formate de grupările carboxil și aminice a aminoacizilor; există de fapt 2 forme pentru fiecare proteină, numite forme de rezonanță:
- una datorată dublei legături care asigură rigiditatea și nu permite rotația în jurul axei sale;
- a doua formă de rezonanță este dată de unghiul diedru φ(planul atomilor C'-N-Cα-C'), ψ (planul atomilor N-Cα-C'-N), ω (planul atomilor Cα-C'-N-Cα), unghiurile φ și ψ pot avea diferite valori fiind responsabile de gradul de libertate a proteinelor, controlând structura tridimensională a lanțului proteic.
Structura substanțelor proteice este încă insuficient cunoscută datorită dinamicității structurii proteinelor, deoarece ele sunt în permanență supuse unor procese de sinteză și de degradare. Pentru evidențierea succesiunii aminoacizilor în structura proteinelor se folosesc 2 metode:[4]
- Degradarea Edman

Prin degradarea Edman se poate identifica o secvență de până la 30 aminoacizi, cu o eficiență de 98%/aminoacid. Un alt avantaj ar fi cantitatea de numai 10-100 pmol de peptide necesare pentru determinare.
Degradarea Edman folosește ca reactiv izotiocianatul de fenil care evidențiază selectiv aminoacidul. Grupa amino terminală se adiționează la izotiocianat trecând printr-un derivat de tiouree. După ce se tratează cu un acid slab, aminoacidul marcat sub formă de feniltiohidantoină se detașează de restul polipeptidei. Aceasta cu noul său aminoacid terminal poate fi supusă la un nou ciclu de tratări pentru identificarea următoarei grupe amino.
- Degradarea Sanger are la bază tratarea polipeptidei cu fluoro-2,4-dinitrobenzen, având loc atacul reactivului asupra grupării amino a aminoacidului N-terminal. Metoda Sanger are dezavantajul degradării complete a polipeptidei.
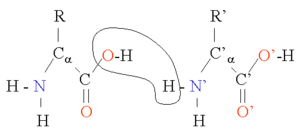
S-a ajuns la concluzia că există 4 niveluri (structuri), care alcătuiesc edificiul proteic.
Structura primară
[modificare | modificare sursă]Structura primară este dată de aminoacizii care intră în lanțul proteic prin formarea legăturilor peptidice.

În proteinele naturale legătura peptidică se stabilește între gruparea carboxilică de la C1 și gruparea aminică de la C2, încât lanțul peptidic va fi format dintr-o succesiune de unități CO-NH-CH, legate cap-cap.

Legătura peptidică -CO-NH- se găsește în același plan, iar carbonul -CH- se poate roti, putând să apară în planuri diferite. Datorită lungimii relativ mici a catenelor laterale, ele se pot aranja de o parte și de alta a lanțului proteic, astfel că lanțul proteic nu este ramificat.

Datorită numărului relativ mic de aminoacizi care intră în structura proteinelor, teoretic ar trebui să se formeze proteine cu masa moleculară în jur de 4200. Însă în realitate masele moleculare ale proteinelor au valori de peste 10,000 ceea ce a dus la concluzia că cel puțin o parte de aminoacizi se repetă de mai multe ori în cadrul unei molecule. Ipoteza că proteinele sunt formate din lanțuri lineare de aminoacizi a fost formulată pentru prima dată în anul 1902, la a 74-a reuniune a Societății Oamenilor de Știința din Germania, ținută în orașul Karlsbad, de către Franz Hofmeister (ținând cont de reacția biuretului) și Emil Fischer (care aduce clarificări asupra scheletului proteic). Ipoteza că în molecula proteinelor există legături amidice fusese elaborată de chimistul francez Édouard Grimaux încă din anul 1882. În ciuda evidențelor care demonstrau faptul că proteinele supuse acțiunii proteolitice se scindează în oligopeptide, ideea că lanțul proteic este liniar, au fost idei greu de „digerat”. În perioada respectivă, numeroși savanți (William Astbury, Hermann Staudinger), punând la îndoială acest lucru, prin argumentarea că legăturile amidice nu sunt îndeajuns de puternice pentru a susține o moleculă proteică lungă.
Cu timpul au apărut diverse ipoteze:
- Ipoteza coloidală, care susținea că proteinele sunt ansambluri moleculare coloidale formate din molecule mai mici - ipoteză contrazisă de măsurarea ultracentrifugării de către Svedberg care a arătat faptul că proteinele sunt molecule bine definite, au greutate moleculară, iar prin electroforeză Arne Tiselius a demonstrat că proteinele sunt molecule unice.
- Ipoteza „ciclol”, avansată de Dorothy Wrinch, primul model structural al unei proteine globulare pliate[6], are la bază 3 elemente:
- Reacția „ciclol” în care gruparea carbonil și gruparea amino a două peptide se încrucișează: C=O + HN → C(OH)-N (așa numita legătură în cruce); aceste legături sunt de tip covalent, similare cu legăturile covalente de hidrogen propuse de William Astbury, pentru a explica stabilitatea structurii proteice;
- Lanțurile beta vecine au la bază o serie de reacții de tip „ciclol”;
- Structura proteinelor mici corespund așa numitelor poliedre platonice, fără ca să existe colțuri libere.
Alte ipoteze au fost lansate de către Emil Abderhalden (modelul dicetopiperazinic), sau Niels Troesengaard în anul 1944 (modelul pirol/piperidină)[7]. Toate aceste modele au fost infirmate de Frederick Sanger care reuși să identifice secvența aminoacizilor din insulină, dar și de determinările cristalografice efectuate de Max Perutz și John Kendrew asupra mioglobinei și hemoglobinei.
Structura secundară
[modificare | modificare sursă]

Structura secundară se referă la forma și la lungimea lanțurilor polipeptidice, proprietăți induse de legăturile de hidrogen. Cele mai întâlnite tipuri de structură secundară sunt α-elice și β-laminară (sau β-foaie). Alte structuri în formă de elice, cum ar fi 310-elice și π-elice sunt, din punct de vedere energetic, favorabile formării legăturilor de hidrogen, dar sunt rareori observate în proteinele naturale exceptând părțile terminale ale α-elicei în timpul formării scheletului proteic (de obicei centrul elicei). Aminoacizii au un comportament diferit vis-a-vis de posibilitatea formării structurii secundare. Prolina și glicina sunt cunoscuți ca așa numiții „helix breakers” (spărgători de elice), deoarece afectează configurația scheletului proteic; ambii aminoacizi au abilități conformaționale neobișnuite și de regulă se găsesc în colțurile scheletului proteic. Aminoacizii care preferă să adopte conformația α-elicei proteică fac parte din așa numita serie MALEK (codurile formate din 1 literă a aminoacizilor: metionină, alanină, leucină, acid glutamic și lizina); prin contrast aminoacizii aromatici (triptofanul, tirozina și fenilalanina, dar și aminoacizii cu legare prin carbonul beta (izoleucina, valina și treonina), adoptă configurația β.
Structura secundară cunoaște câteva ipoteze privind formarea ei:
- Teoria polipeptidică formulată de către Franz Hofmeister în 1902[8] și dezvoltată ulterior de către Emil Fischer, are la bază conceptul conform căruia moleculele proteice sunt formate din lanțuri polipeptidice foarte lungi. Teoria are câteva dezavantaje:
- nu explica diferențierea biologică a anumitor proteine;
- unele proteine sunt rezistente la acțiunea enzimelor proteolitice (deși datorită lungimii lanțului nu ar trebui).
- Teoria plierii și răsucirii lanțurilor polipeptidice, publicată de către Linus Pauling, Robert B. Corey și Herman R. Branson în 1951[9], și fost confirmată prin spectrele de difracție cu raze X, prin măsurarea unghiurilor de valență a distanțelor interatomice. Asta este teoria acceptată în ziua de azi. Teoria include următoarele structuri:
- Structura elicoidală (α-elice): lanțul polipeptidic se prezintă înfășurat sub formă de spirală. În acest model, fiecare spiră conține de obicei 27 aminoacizi, iar distanța între spire este de 5,44 Å. Fiecare aminoacid mărește spira cu 1,47 Å. În fața fiecărei grupări -CO-, va apare la o distanță de 2,8 Å o grupare NH de la al treilea aminoacid. Între aceste grupări se stabilesc punțile de hidrogen care asigură stabilitatea α-elicei. În acest model lanțul polipeptidic se prezintă sub forma unui șurub cu pasul fie spre dreapta, fie spre stânga. În cazul proteinelor naturale, acestea datorită conținutului în L-aminoacizi, pasul elicei va fi spre dreapta, și catenele laterale ies în afara corpului propriu-zis putând reacționa fie cu moleculele solventului fie cu alte catene polipeptidice. Canalul format în interiorul elicei este foarte îngust, și de aceea în el nu poate pătrunde molecula solventului. Legăturile peptidice sunt plane, iar ouă planuri consecutive -CO-NH- formează un unghi de 180°, și rotirea lanțului se face la carbonul α (metinic).
- Structura în foaie pliantă (β-foaie): plierea catenei are loc prin formarea legăturilor de hidrogen între gruparea carboxilică a unui aminoacid și gruparea aminică a aminoacidului vecin. Lanțul polipeptidic pliat se prezintă ca o panglică îndoită alternativ la dreapta și la stânga, plierea având loc în dreptul carbonilor metinici. Mai multe lanțuri pliate polipeptidice pliate dau naștere unei rețele, putându-se de asemenea forma, între aceste lanțuri pliate, legături de hidrogen, acestea fiind în număr mai mare când grupările terminale a două lanțuri sunt aranjate diferit (-NH2 și COOH, sau HOOC-și -NH2). Catenele polipeptidice pliate predomină în proteinele fibrilare și mai puțin în cele globulare. După valoarea perioadei de identitate se cunosc mai multe tipuri de proteine cu structură pliată. Prin perioada de identitate se înțelege distanța cea mai mică la care se repetă aminoacizii identici din moleculă.
Structura terțiară
[modificare | modificare sursă]Prin intermediul cristalografiei cu raze X s-a dovedit faptul că macromoleculele proteice au o conformație tridimensională, realizată de obicei prin intermediul cuplării mai multor lanțuri polipeptidice scurte între ele, cuplare care duce la formarea fibrelor proteice; legăturile inter catenare pot fi principale sau secundare:

- Legături de hidrogen, sunt legături coordinativ heteropolare care se stabilesc cu ușurință între gruparea carbonil C=O (electronegativă) și gruparea NH- (electropozitivă), din 2 lanțuri polipeptidice alăturate, sau în cazul formelor lactam-lactimă între gruparea -OH și azotul aminic =NH[10]. Legăturile de hidrogen se pot stabili și între catenele lateralecare au grupări carboxil, hidroxil, amino sau tiolice. Din punct de vedere energetic legătura de hidrogen nu este puternică dar datorită răspândirii relativ uniforme de-a lungul scheletului proteic oferă proteinei stabilitatea necesară.

- Legături disulfidice: legătura este rezistentă la hidroliză, însă se poate desface iar prin reducere formează tioli(SH), iar prin oxidare formează acizi. În general legătura sulfidică se întâlnește la proteinele transformate, care au o rezistență mecanică mare.
În afară de aceste legături se mai pot stabili alte tipuri de legături: legături ionice (stabilite de obicei între grupările aminice și cele carboxilice ionizate), legături de tip van der Waals (legături electrostatice slabe care se stabilesc între radicalii hidrofobi), legături fosfodiesterice (între 2 resturi de serină și acid fosforic), legături eterice (stabilite la nivelul aminoacizilor cu grupări hidroxilice).
Structura cuaternară
[modificare | modificare sursă]Structura cuaternară se referă la modul în care se unesc subunitățile proteice. Enzimele care catalizează asamblarea acestor subunități poartă denumirea de holoenzime, în care o parte poartă denumirea de subunități reglatoare și subunități catalitice.
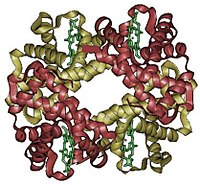
Proteine care au structura cuaternară: hemoglobina, ADN polimeraza și canalele ionice, dar și nucleozomi și nanotubuli, care sunt complexe multiproteice. Fragmentele proteice pot suferi transformări în structura cuaternară, transformări care se reflectă fie în structurile individuale fie în reorientările fiecărei subunități proteice. Numărul subunităților din oligomerice sunt denumite prin adăugarea sufix-ului -mer (grecescul pentru subunitate), precedat de numele subunității:
|
|
Note
[modificare | modificare sursă]- ^ Instructor_Resources/Chapter_24
- ^ Instructor_Resources/Chapter_24
- ^ Hofmeister series
- ^ BC Online: 2B - Composition, Sequence, Analysis Proteins
- ^ http://www.lhup.edu/jwhitlin/Chem410/Lecture2/Notes/chapter_3_notes.htm
- ^ Tiselius, Arne (), „The Chemistry of Proteins and Amino Acids”, Annual Review of Biochemistry, 8 (1), pp. 155–184, doi:10.1146/annurev.bi.08.070139.001103, ISSN 0066-4154, accesat în
- ^ Troensegaard, N.; Munksgaard, E.; Millford, H.; Vickery, H. B. (), „On the Structure of the Protein Molecule.”, The Journal of Physical Chemistry, 50 (3), pp. 284–285, doi:10.1021/j150447a013, ISSN 0092-7325, accesat în
- ^ Hofmeister, F. (), „Über Bau und Gruppierung der Eiweisskörper”, Ergebnisse der Physiologie (în germană), 1 (1), pp. 759–802, doi:10.1007/BF02188398, ISSN 0080-2042, accesat în
- ^ Pauling, Linus; Corey, Robert B.; Branson, H. R. (), „The structure of proteins: Two hydrogen-bonded helical configurations of the polypeptide chain”, Proceedings of the National Academy of Sciences (în engleză), 37 (4), pp. 205–211, doi:10.1073/pnas.37.4.205, ISSN 0027-8424, PMC 1063337
 , PMID 14816373, accesat în
, PMID 14816373, accesat în
- ^ OpenEye Scientific Software | Documentation
Legături externe
[modificare | modificare sursă]![]() Materiale media legate de XXxWikipedianxXx/test1 la Wikimedia Commons
Materiale media legate de XXxWikipedianxXx/test1 la Wikimedia Commons
Punct izoelectric
- http://wps.prenhall.com/wps/media/objects/340/348272/Instructor_Resources/Chapter_24/Text_Images/FG24_02-02T021.JPG
- http://wps.prenhall.com/wps/media/objects/340/348272/Instructor_Resources/Chapter_24/Text_Images/FG24_02-02T022.JPG
Precipitare
- http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1301610
- http://www.lsbu.ac.uk/water/hofmeist.html
- http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1301610&blobtype=pdf
- http://web.lemoyne.edu/~giunta/hofmeister.html
Structura proteinelor
- A. Lehninger, Biochimie vol I-II, Editura Tehnică, București 1987-1992
- Nenițescu C.D Tratat elementar de chimie organică vol II Editura Tehnică , București 1958




