Acid bromhidric
| Acid bromhidric | |
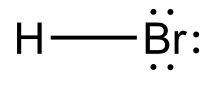 Structura acidului bromhidric | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | bromură de hidrogen |
| Identificare | |
| Număr CAS | 10035-10-6 |
| Informații generale | |
| Formulă chimică | HBr |
| Aspect | Gaz incolor, care fumegă în aer, cu miros înțepător |
| Masă molară | 80,91 g/mol |
| Proprietăți | |
| Densitate | 2,529 g cm−3 |
| Starea de agregare | gaz |
| Punct de topire | -86,9 °C |
| Punct de fierbere | -66,8 °C |
| Solubilitate | Bună, formează soluții apoase |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul bromhidric este o soluție apoasă a compusului hidrogen bromurat și un acid anorganic tare. Sărurile acidului bromhidric se numesc bromuri. Formula chimică a acidului bromhidric este HBr.
Obținere[modificare | modificare sursă]
Acidul bromhidric se obține în laborator prin reacția dintre acidul sulfuric (sau un alt acid anorganic, mai tare decât acidul bromhidric) și una dintre bromuri, NaBr de exemplu:
Acidul sulfuric nu trebuie să fie foarte concentrat, deoarece acțiunea sa oxidantă poate transforma acidul bromhidric proaspăt obținut în brom elementar, Br2.
Utilizări[modificare | modificare sursă]
Acidul bromhidric este folosit, de obicei, pentru producerea bromurilor anorganice, în special bromura de zinc, bromura de calciu și bromura de sodiu.
Proprietăți[modificare | modificare sursă]
Aspecte specifice[modificare | modificare sursă]
În condiții obișnuite de temperatură și presiune, acidul bromhidric este un gaz incolor care fumegă în aer, fiind foarte avid de apă. Are miros înțepător, atacând violent mucoasele organelor respiratorii. Sărurile acestui acid se numesc bromuri. Majoritatea bromurilor sunt solubile în apă, deși unele sunt greu solubile, ca de exemplu: PbBr2, HgBr, AgBr, TlBr, etc.
Este solubil în apă circa 600 litri de hidrogen bromurat gazos per litru de apă la temperatura ambientală.
Fizice[modificare | modificare sursă]
Densitatea acidului bromhidric este de 2,529 g/cm3 la temperatura de 0° Celsius. Punctul de fierbere este de -66,8° Celsius, iar punctul de topire (acidul se poate solidifica în cristale incolore) este de -86,9° Celsius.
Chimice[modificare | modificare sursă]
Este instabil sub acțiunea luminii, producând brom liber.[1]
Căldura de formare este de 51 kJ per mol.[2]
Păstrarea[modificare | modificare sursă]
Acidul bromhidric se păstrează în sticle de culoare închisă, bine astupate, la loc rece, datorită faptului că acesta se oxidează mai ușor ca acidul clorhidric punând în libertate molecula diatomică de brom Br2. Spre deosebire de acidul clorhidric, acidul bromhidric se combină (la temperatura scăzută) cu mercurul și argintul, rezultând bromurile respective și degajându-se hidrogen.
Impurități[modificare | modificare sursă]
Acidul bromhidric poate conține, ca impurități, vapori de brom și apă.
Note[modificare | modificare sursă]
Bibliografie[modificare | modificare sursă]
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză)
- Raluca Ripan, Ion Ceteanu, Manual de lucrări practice de chimie anorganică-Metaloizi, Editura Didactică și Pedagogică, București, 1961
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p. 16
Resurse[modificare | modificare sursă]
| |||||||||||||

