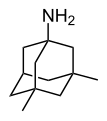
Adamantan
| Adamantan | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 281-23-2 |
| ChEMBL | CHEMBL1230831 |
| PubChem CID | 9238 |
| Formulă chimică | C₁₀H₁₆[1] |
| Masă molară | 136,125 u.a.m.[1] |
| Punct de topire | 267 °C[2] |
| Indice de refracție(nD) | 1,568[3] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Adamantanul[4] este un compus organic cu formula chimică C
10H
16, fiind cel mai simplu cicloalcan din clasa diamantoidelor. Aranjamentul spațial al atomilor de carbon în molecula acestuia este similar cu cel din cristalele de diamant, astfel că denumirea compusului provine din greacă adamantinos („diamantin”).[5]
Compusul a fost izolat din petrol în anul 1933, iar de atunci au fost sintetizați mulți derivați importanți, precum medicamente, materiale polimerice și lubrifianți termostabili.
Petrolul este singura sursă naturală de adamanatan, iar procentul în care se regăsește variază între 0,0001% și 0,03%, depinzând de sursa acestuia.[6][7]
Obținere și istoric
[modificare | modificare sursă]
În 1924, H. Decker a sugerat existența adamantanului, pe care l-a denumit decaterpenă.[8]
Prima încercare de sinteză a fost realizată în anul 1924 de către chimistul german Hans Meerwein și a presupus reacția dintre formaldehidă și malonat de dietil în prezența piperidinei. S-a obținut în schimb 1,3,5,7-tetracarbometoxibiciclo[3.3.1]nonan-2,6-diona (ulterior denumit esterul Meerwein), care a fost utilizată mai târziu în sinteza adamantanului și a derivaților săi.[9] D. Bottger a încercat obținerea adamantanului din esterul Meerwein, dar a obținut triciclo-[3.3.1.13,7] în schimb.[10]
Alți chimiști au încercat sintetizarea adamantanului utilizând floroglucinol și derivați de ciclohexanonă, dar nu au reușit.[11]
Adamantanul a fost sintetizat pentru prima dată de către Vladimir Prelog în anul 1941 din esterul Meerwein.[12][13] Procesul de obținere era în cinci etape și avea un randament de doar 0,16%, și se mai utilizează pentru obținerea unor derivați de adamantan.[11]

Metoda lui Prelog a fost îmbunătățită în 1956, prin creșterea randamentului etapei de decarboxilare, mai exact prin adiția unor reacții Heinsdecker (11%) și Hoffman (24%).[14][15] O metodă mai simplă a fost pusă la punct în 1957 de către Paul von Ragué Schleyer: diciclopentadiena a fost hidrogenată în prezența unui catalizator (de exemplu, dioxid de platină) și convertită în adamantan cu un acid Lewis (de exemplu, clorură de aluminiu). Metoda a crescut randamentul la 30-40% și a oferit o sursă bună de adamantan.[16][17] Randamentul a fost crescut ulterior la 60%[18] și chiar 98%:

Proprietăți chimice
[modificare | modificare sursă]Cation al adamantanului
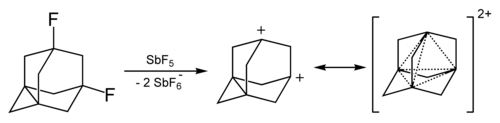
[modificare | modificare sursă]Cationul adamantanului se poate obține în urma reacției dintre 1-fluoro-adamantan și SbF5 și prezintă o stabilitate crescută în comparație cu alți carbocationi, chiar și terțiari.[19][20]
Dicationul 1,3-didehidroadamantanului a fost obținut în soluții de superacizi. Și acesta prezintă o stabilitate ridicată datorită unui fenomen de aromaticitate tridimensională[21] sau homoaromaticitate.[22]
Reacții chimice
[modificare | modificare sursă]Reacția cu acid sulfuric
[modificare | modificare sursă]Majoritatea reacțiilor chimice date de adamantan au loc prin intermediul atomilor de carbon 3-coordinați, atomii 2-coordinații fiind mult mai puțin reactivi. Prin reacția cu acid sulfuric concentrat produc adamantanona:[23]

Gruparea carbonilică din adamantanonă permite unele reacții suplimentare, obținându-se derivați precum 2-adamantancarbonitril[24] și 2-metil-adamantan.[25]
Bromurare
[modificare | modificare sursă]Adamantanul reacționează cu o varietate de agenți de bromurare, inclusiv cu bromul molecular. Compoziția și raportul produșilor de reacție depinde de condițiile de reacție și de prezența și natura catalizatorilor:[6]
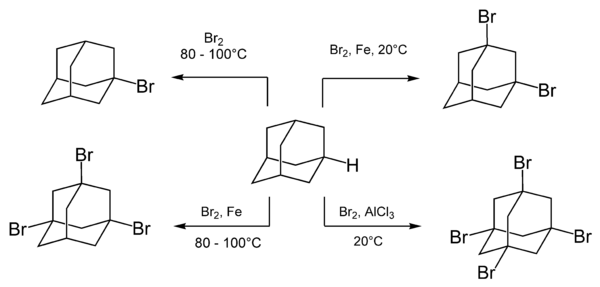
Prin fierbere cu brom rezultă adamantanul monobromosubstituit, 1-bromadamantanul. Substituția multiplă cu brom se face în prezența unui acid Lewis pe post de catalizator.[26]
Fluorurare
[modificare | modificare sursă]Primele reacții de fluorurare a adamantanului au fost realizate utilizând 1-hidroxiadamantan[27] și 1-aminoadamantan. Ulterior s-a realizat și fluorurarea directă a adamantanului.[28] În toate cazurile, reacțiile au avut loc prin intermediul cationului adamantanului, care a reacționat apoi cu agenții de fluorurare nucleofili. S-a raportat și fluorurarea cu fluor gazos.[29]
Carboxilare
[modificare | modificare sursă]Carboxilarea adamantanului a fost raportată în anul 1960, utilizând acid formic ca agent de carboxilare și tetraclorură de carbon ca solvent:[30]

terț-butanolul (t-BuOH) și acidul sulfuric au scopul de a genera cationul, care este apoi carboxilat sub acțiunea monoxidului de carbon generat in situ în urma reacției dintre acidul formic și sulfuric.[11] Fracția de derivat carboxilic este de 55-60%.[31]
Hidroxilare
[modificare | modificare sursă]Cel mai simplu alcool al adamantanului este 1-hidroxiadamantanul, care se obține în urma reacției de hidroliză a 1-bromadamantanului în soluție apoasă de acetonă. Se mai poate produce și prin reacția de ozonizare a adamantanului:[32]

Alte reacții
[modificare | modificare sursă]Adamantanul reacționează și cu benzenul în prezența unui acid Lewis, dând o reacție Friedel-Crafts.[33] Adamantanii aromatici substituiți pot fi obținuți plecând de la 1-hidroxiadamantan; reacția cu anisol merge în condiții normale și nu necesită catalizator.[26]
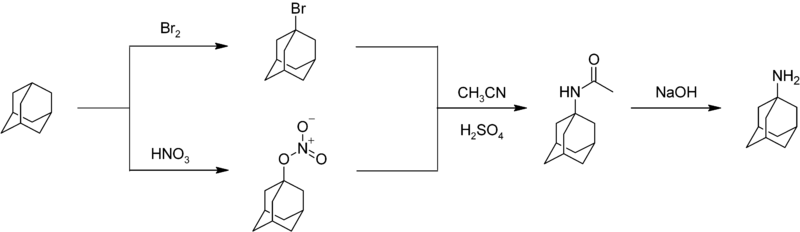
Nitrarea adamantanului este greu de realizat și are randamente reduse.[34] Un medicament, amantadina, se poate obține prin reacția adamantanului cu brom sau acid azotic, obținându-se bromoderivatul sau nitroesterul în poziția 1. Reacția celor doi cu acetonitril conduce la formarea unei acetamide, care este hidrolizată la 1-adamantilamină:[35]
Derivați
[modificare | modificare sursă]Medicamente
[modificare | modificare sursă]Unii derivații adamanatanului sunt utilizați ca medicamente; primul utilizat, amantadina, este un antiviral[36] și un agent antiparkinsonian.[37][38] Alți derivați cu uz terapeutic includ: adapalen, adapromină, bromantan, carmantadină, clodantan, dopamantină, memantină, rimantadină, saxagliptină, tromantadină și vildagliptină. Polimerii adamantanului au fost patentați ca agenți antiretrovirali utilizați împotriva HIV.[39]
Note
[modificare | modificare sursă]- ^ a b c „Adamantan”, ADAMANTANE (în engleză), PubChem, accesat în
- ^ Jean-Claude Bradley Open Melting Point Dataset
- ^ http://books.google.com/books?id=8RA2AAAAIAAJ&dq=isbn:502001382X&hl=ru Lipsește sau este vid:
|title=(ajutor) - ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. . p. 169. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The retained names adamantane and cubane are used in general nomenclature and as preferred IUPAC names.
- ^ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006, p. 6 ISBN: 0-444-52239-5.
- ^ a b „Synthesis of adamantane” (în rusă). Accesat în . Special practical problem for the students of IV year. Department of Petroleum Chemistry and Organic Catalysis MSU.
- ^ Bagriy EI (). „Methods for hydrocarbon adamantane series”. Adamantane: Synthesis, properties, application. Moscow: Nauka. pp. 58–123. ISBN 5-02-001382-X.
- ^ Decker H. (). „Versammlung deutscher Naturforscher und Ärzte. Innsbruck, 21–27 September 1924”. Angew. Chem. 37 (41): 795. doi:10.1002/ange.19240374102.
- ^ Radcliffe, Marc D.; Gutierrez, Alberto; Blount, John F.; Mislow, Kurt (). „Structure of Meerwein's ester and of its benzene inclusion compound” (PDF). Journal of the American Chemical Society. 106 (3): 682–687. doi:10.1021/ja00315a037. Arhivat din original (PDF) la . Accesat în .
- ^ S. Coffey, S. Rodd (ed.) Chemistry of Carbon Compounds. Vol 2. Part C. Elsevier Publishing Co.: New York. 1969
- ^ a b c Fort, Raymond C. Jr.; Schleyers, Paul Von R. (). „Adamantane: Consequences of Diamondoid Structure”. Chem. Rev. 64 (3): 277–300. doi:10.1021/cr60229a004.
- ^ Prelog V, Seiwerth R (). „Über die Synthese des Adamantans”. Berichte. 74 (10): 1644–1648. doi:10.1002/cber.19410741004.
- ^ Prelog V, Seiwerth R (). „Über eine neue, ergiebigere Darstellung des Adamantans”. Berichte. 74 (11): 1769–1772. doi:10.1002/cber.19410741109.
- ^ Stetter, H., Bander, O., and Neumann, W., Ber., 89, 1922 (1956).
- ^ McKervey, M (). „Synthetic approaches to large diamondoid hydrocarbons”. Tetrahedron. 36 (8): 971–992. doi:10.1016/0040-4020(80)80050-0.
- ^ Schleyer, P. von R. (). „A Simple Preparation of Adamantane”. J. Am. Chem. Soc. 79 (12): 3292. doi:10.1021/ja01569a086.
- ^ Schleyer, P. von R.; Donaldson, M. M.; Nicholas, R. D.; Cupas, C. (), „Adamantane”, Org. Synth.; Collective Volume, 5, p. 16
- ^ Mansoori, G. Ali (). Molecular building blocks for nanotechnology: from diamondoids to nanoscale materials and applications. Springer. pp. 48–55. ISBN 978-0-387-39937-9.
- ^ Schleyer P. R.; Fort R. C.; Watts W. E. (). „Stable Carbonium Ions. VIII. The 1-Adamantyl Cation”. J. Am. Chem. Soc. 86 (19): 4195–4197. doi:10.1021/ja01073a058.
- ^ Olah, George A.; Prakash, G. K. Surya; Shih, Joseph G.; Krishnamurthy, V. V.; Mateescu, Gheorge D.; Liang, Gao; Sipos, Gyorgy; Buss, Volker; Gund, Tamara M.; Schleyer, Paul v. R. (). „Bridgehead adamantyl, diamantyl, and related cations and dications”. J. Am. Chem. Soc. 107 (9): 2764–2772. doi:10.1021/ja00295a032.
- ^ Smith, W.; Bochkov A.; Caple, R. (). Organic Synthesis. Science and art. M.: World. p. 573. ISBN 5-03-003380-7.
- ^ Bremer, Matthias; von Ragué Schleyer, Paul; Schötz, Karl; Kausch, Michael; Schindler, Michael (). „Four-Center Two-Electron Bonding in a Tetrahedral Topology. Experimental Realization of Three-Dimensional Homoaromaticity in the 1,3-Dehydro-5,7-adamantanediyl Dication”. Angewandte Chemie International Edition in English. 26 (8): 761–763. doi:10.1002/anie.198707611.
- ^ Geluk, H. W. and Keizer, V. G. "Adamantanone" Organic Syntheses, Coll. Vol. 6, p. 48 (1988); Vol. 53, p. 8 (1973) doi:10.15227/orgsyn.053.0008.
- ^ 2-Adamantanecarbonitrile Arhivat în , la Wayback Machine. Organic Syntheses, Coll. Vol. 6, p. 41 (1988); Vol. 57, p. 8 (1977).
- ^ Schleyer P. R.; Nicholas R. D. (). „The Preparation and Reactivity of 2-Substituted Derivatives of Adamantane”. J. Am. Chem. Soc. 83 (1): 182–187. doi:10.1021/ja01462a036.
- ^ a b Nesmeyanov, A. N. (). Basic organic chemistry (în rusă). p. 664.
- ^ Olah, George A.; Welch, John T.; Vankar, Yashwant D.; Nojima, Mosatomo; Kerekes, Istvan; Olah, Judith A. (). „Pyridinium poly (hydrogen fluoride): a convenient reagent for organic fluorination reactions”. Journal of Organic Chemistry. 44 (22): 3872–3881. doi:10.1021/jo01336a027.
- ^ Olah, George A.; Shih, Joseph G.; Singh, Brij P.; Gupta, B. G. B. (). „Ionic fluorination of adamantane, diamantane, and triphenylmethane with nitrosyl tetrafluoroborate/pyridine polyhydrogen fluoride (PPHF)”. Journal of Organic Chemistry. 48 (19): 3356–3358. doi:10.1021/jo00167a050.
- ^ Rozen, Shlomo.; Gal, Chava (). „Direct synthesis of fluoro-bicyclic compounds with fluorine”. Journal of Organic Chemistry. 53 (12): 2803–2807. doi:10.1021/jo00247a026.
- ^ Koch, H.; Haaf, W. (). „Direkte Synthese der Adamantan-carbonsäure-(1)”. Angewandte Chemie. 72 (17): 628. doi:10.1002/ange.19600721710.
- ^ 1-Adamantanecarboxylic acid Organic Syntheses, Coll. Vol. 5, p. 20 (1973); Vol. 44, p. 1 (1964).
- ^ Zvi Cohen, Haim Varkony, Ehud Keinan, and Yehuda Mazur Tertiary alcohols from hydrocarbons by ozonation on silica gel: 1-adamantanol Organic Syntheses, Coll. Vol. 6, p. 43 (1988); Vol. 59, p. 176 (1979)
- ^ Chalais, Stephane; Corn lis, Andr; Gerstmans, Andr; Ko?odziejski, Wac?aw; Laszlo, Pierre; Mathy, Arthur; M tra, Pierre (). „Direct clay-catalyzed Friedel-Crafts arylation and chlorination of the hydrocarbon adamantane”. Helvetica Chimica Acta. 68 (5): 1196–1203. doi:10.1002/hlca.19850680516.
- ^ Smith, George W.; Williams, Harry D. (). „Some Reactions of Adamantane and Adamantane Derivatives”. J. Org. Chem. 26 (7): 2207–2212. doi:10.1021/jo01351a011.
- ^ Moiseev, I. K.; Doroshenko, R. I.; Ivanova, V. I. (). „Synthesis of amantadine via the nitrate of 1-adamantanol”. Pharmaceutical Chemistry Journal. 10 (4): 450–451. doi:10.1007/BF00757832.
- ^ Maugh, T. (). „Panel urges wide use of antiviral drug”. Science. 206 (4422): 1058–60. Bibcode:1979Sci...206.1058M. doi:10.1126/science.386515. PMID 386515.
- ^ Sonnberg, Lynn (). The Complete Pill Guide: Everything You Need to Know about Generic and Brand-Name Prescription Drugs. Barnes & Noble Publishing. p. 87. ISBN 0-7607-4208-1.
- ^ Blanpied TA, Clarke RJ, Johnson JW (). „Amantadine inhibits NMDA receptors by accelerating channel closure during channel block”. Journal of Neuroscience. 25 (13): 3312–22. doi:10.1523/JNEUROSCI.4262-04.2005. PMC 6724906
 . PMID 15800186.
. PMID 15800186.
- ^ Boukrinskaia, A. G.; et al. „Polymeric Adamantane Analogues” (U.S. Patent 5,880,154). Accesat în .