Cancer pulmonar
| Calitatea informațiilor sau a exprimării din acest articol sau secțiune trebuie îmbunătățită. Consultați manualul de stil și îndrumarul, apoi dați o mână de ajutor. Acest articol a fost etichetat în august 2014 |
| Acest articol are nevoie de atenția unui expert în domeniu. Recrutați unul sau, dacă sunteți în măsură, ajutați chiar dumneavoastră la îmbunătățirea articolului! |
| Cancer pulmonar | |
 Tumoare pulmonară (marcată cu săgeată) vizibilă la radiografia toracică | |
| Specialitate | oncologie pneumologie |
|---|---|
| Simptome | Durere toracică[1] tuse[1] hemoptizie[1] epuizare[*][1] slăbire[1] anorexie[*][1] dispnee[1] wheeze[*][1] |
| Cauze | tobacco smoking[*] azbestoză[2] passive smoking[*] radon poluarea aerului Fumat |
| Metodă de diagnostic | radiografie tomografie computerizată[*] bronchoscopy[*] biopsie |
| Clasificare și resurse externe | |
| ICD-9 | 162 |
| ICD-10 | C33-C34 |
| ICD-11 | |
| ICD-9-CM | 162.3[3] 162.5[3] 162.8[3] 162.4[3] |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405radio/406 |
| NCI | Cancer pulmonar |
| Patient UK | Cancer pulmonar |
| MeSH ID | D002283 |
| Modifică date / text | |
Cancerul pulmonar reprezintă o afecțiune malignă caracterizată printr-o multiplicare necontrolată a celulelor epiteliale ale țesutului pulmonar, la nivelul unui plămân sau al ambilor plămâni, la nivelul bronhilor sau al alveolelor pulmonare.
Netratată, această multiplicare poate evolua cu dezvoltarea unei mase tumorale (neoplazie) cu formarea propriei rețele de vase de sânge și limfatice, și poate disemina pe cale hematogenă sau limfatică în țesuturile din apropiere (regionale: la nivelul ganglionilor limfatici) sau al altor organe din corp, la distanță, proces denumit metastazare. Majoritatea tipurilor de cancer care pornesc din plămân sunt carcinoamele derivate din celulele epiteliale. Principalele tipuri de cancer pulmonar sunt carcinomul cu celule mici (cancerul bronho-pulmonar microcelular sau CBPM), supranumit și cancer cu celule „în bob de ovăz”, și carcinomul pulmonar fără celule mici (cancerul bronho-pulmonar non-microcelular sau CBPNM). Cele mai frecvente simptome sunt tusea (inclusiv tusea cu sânge), pierderea în greutate și dificultățile de respirație (dispneea).[4]
Cel mai important factor de risc în apariția cancerului pulmonar este expunerea îndelungată la fumul de țigară,[5] 80–90 % din cazurile de cancer pulmonar fiind diagnosticate la persoanele fumătoare.[4] Restul de 10–15 % sunt diagnosticate la persoane nefumătoare,[6] aceste cazuri fiind adesea atribuite unei combinații dintre factori genetici,[7] gaz radioactiv radon,[7] azbest,[8] și poluarea aerului[7], inclusiv fumatul pasiv.[9][10] Cancerul pulmonar se poate depista în urma unei radiografii toracice și a unei tomografii computerizate (tomografie CT). Diagnosticul este confirmat cu ajutorul unei biopsii[11], realizată, de obicei, printr-o bronhoscopie sau biopsie ghidată CT. Tratamentul și rezultatele pe termen lung depind de tipul de cancer, de stadiu (gradul de diseminare), precum și de starea de sănătate generală a persoanei (prezența sau absența comorbidităților).
Tratamentele standard includ chirurgia, chimioterapia, radioterapia și imunoterapia. CBPNM este uneori tratat chirurgical, în timp ce CBPM răspunde, de obicei, mai bine la chimioterapie și radioterapie.[12] Per ansamblu, 15 % dintre persoanele din Statele Unite diagnosticate cu cancer pulmonar supraviețuiesc o perioadă de cinci ani de la data diagnosticării.[13] La nivel global, cancerul pulmonar este cea mai răspândită cauză a deceselor provocate de cancer la femei și bărbați, fiind responsabil de 1,38 milioane de decese anual, conform datelor din anul 2008.[14]
Semne și simptome[modificare | modificare sursă]
Semnele și simptomele care pot sugera prezența cancerului pulmonar includ:[4]
- simptome respiratorii: tuse, tuse cu sânge, respirație șuierătoare sau dificultăți de respirație
- manifestări sistemice: scădere în greutate, febră, hipocratism la unghiile de la mâini, sau oboseală
- simptome cauzate de compresia locală: dureri în piept, dureri ale oaselor, obstrucționarea venei cave superioare, dificultăți de înghițire
În funcție de tipul de neoplazie, este posibil ca așa-numitul fenomen paraneoplazic să atragă inițial atenția asupra bolii.[15] În cazul cancerului pulmonar, aceste fenomene pot include sindromul miastenic Lambert–Eaton (slăbiciune musculară cauzată de o autoanticorpi), hipercalcemie, sau de sindromul de secreție inadecvată de hormon antidiuretic (SIADH). Tumorile situate în vârful plămânului, cunoscute drept tumori Pancoast, pot invada partea locală a sistemului nervos simpatic, ducând astfel la apariția sindromului Horner (caracterizat prin căderea pleoapei și micșorarea pupilei pe partea respectivă), precum și la afectarea plexului brahial.[4]
Majoritatea simptomelor cancerului pulmonar (apetit scăzut, scăderea în greutate, febră, oboseală) nu sunt specifice.[11] În cele mai multe dintre cazuri, cancerul este deja răspândit în organism în momentul în care se manifestă simptomele și se solicită îngrijire medicală. Zonele frecvente de diseminare sunt creierul, oasele, glandele suprarenale, plămânul contralateral, ficatul, pericardul și rinichii.[16] Aproximativ 10 % dintre persoanele cu cancer pulmonar nu prezintă niciun simptom în momentul diagnosticării; aceste tipuri de cancere sunt descoperite întâmplător în timpul unei radiografii toracice de rutină.[13]
Factori de risc[modificare | modificare sursă]
Cancerul se dezvoltă ca urmare a afectării genetice a ADN-ului. Aceasta afectează funcțiile normale ale celulei, inclusiv proliferarea celulară, moartea programată a celulelor (apoptoză )și repararea ADN-ului. Pe măsură ce afecțiunile se acumulează, riscul de cancer crește.[17]
Fumatul[modificare | modificare sursă]

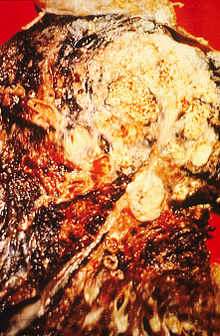
Fumatul, în special al țigărilor, este, de departe, principalul factor care contribuie la cancerul pulmonar.[18] Fumul de țigară conține peste 60 de substanțe cancerige necunoscute,[19] inclusiv radioizotopi din lanțul de dezintegrare a radonului, nitrozamină și benzpiren. De asemenea, nicotina pare să slăbească sistemul imunitar, reducând răspunsul acestuia la masele canceroase din țesutul expus.[20] La nivelul țărilor dezvoltate, 90 % din decesele provocate de cancerul pulmonar la bărbați în 2000 au fost atribuite fumatului (70 % în cazul femeilor).[21] Fumatul provoacă 80-90 % dintre cazurile de cancer pulmonar.[4]
Fumatul pasiv – inhalarea fumului de țigară produs de fumători activi – reprezintă o cauză a cancerului pulmonar la nefumători. Fumător pasiv poate fi considerată orice persoană care locuiește sau lucrează împreună cu un fumător. Studiile din SUA,[22][23] Europa,[24] Regatul Unit[25] și Australia[26] au demonstrat cu consecvență prezența unui risc semnificativ crescut în rândul persoanelor expuse la fumatul pasiv.[27] Persoanele care locuiesc cu un fumător activ prezintă un risc cu 20–30 % mai mare, în timp ce persoanele care lucrează într-un mediu în care se fumează prezintă un risc cu 16–19 % mai mare.[28] Investigațiile efectuate în cazul fumatului secundar sugerează că acesta este mai periculos decât fumatul direct.[29] Fumatul pasiv este responsabil de aproximativ 3 400 dintre decesele provocate de cancerul pulmonar în fiecare an în SUA.[23]
Radonul[modificare | modificare sursă]
Radonul este un gaz radioactiv incolor și inodor, produs de descompunerea radiului, care, la rândul său, este un produs de dezintegrare al uraniului, aflat în scoarța terestră. Produșii de dezintegrare radioactivi ionizează materialul genetic, provocând mutații care uneori pot deveni canceroase. După fumat, radonul este a doua cauză frecventă responsabilă de cancerul pulmonar în SUA.[23] Riscul crește cu 8–16 % la fiecare creștere de 100 Bq/m³ a concentrației de radon.[30] Nivelurile de gaz de radon variază în funcție de localitate și de compoziția solului și a terenului. De exemplu, în regiuni precum Cornwall din Regatul Unit (care are granit în substrat), gazul de radon este o problemă importantă, clădirile trebuind să fie aerisite mecanic cu ventilatoare pentru a reduce concentrațiile de radon. Agenția pentru protecția mediului din SUA (EPA) estimează că una din 15 case din SUA are niveluri de radon peste limita recomandată de 4 picocurie pe litru (pCi/l) (148 Bq/m³).[31]
Azbestul[modificare | modificare sursă]
Azbestul poate provoca o varietate de boli pulmonare, inclusiv cancer pulmonar. Tabagismul și azbestul au un efect sinergetic asupra formării cancerului pulmonar.[8] Azbestul poate, de asemenea, cauza cancerul pleurei, denumit mezoteliom (care este diferit de cancerul pulmonar).[32]
Poluarea aerului[modificare | modificare sursă]
Poluarea aerului are un efect redus asupra creșterii riscului de cancer pulmonar.[7] particulele în suspensie (PM2,5) fine și aerosolii de sulf, care pot fi eliberați în gazele de eșapament, sunt asociați cu un risc ușor crescut.[7][33] În ceea ce privește dioxidul de azot, se observă o creștere incrementală de 10 părți la miliard a riscului de cancer pulmonar cu 14 %.[34] Se estimează că poluarea aerului atmosferic este responsabilă de 1-2 % din numărul de cancere pulmonare.[7]
Probele empirice confirmă o creștere a riscului de cancer pulmonar provocat de poluarea aerului din interior asociată cu arderea lemnului, mangalului, tizicului sau resturilor vegetale, pentru gătit și încălzire.[35] Femeile care sunt expuse fumului de cărbune din interior prezintă un risc de două ori mai ridicat, iar un număr de produse derivate din arderea biomasei sunt cunoscute sau suspectate a fi cancerigene.[36] Acest risc afectează aproximativ 2,4 miliarde de persoane la nivel mondial,[35] fiind considerat responsabil de 1,5 % din decesele provocate de cancerul pulmonar.[36]
Genetică[modificare | modificare sursă]
Se estimează că 8 până la 14 % din cancerul pulmonar se datorează unor factori moșteniți.[37] La rudele persoanelor cu cancer pulmonar, riscul crește de 2,4 ori, lucru care se datorează probabil combinării genelor.[38]
Alți factori de risc[modificare | modificare sursă]
S-a stabilit o legătură între o serie de alte substanțe, profesii și expuneri la mediu și cancerul pulmonar. Agenția Internațională de Cercetare în Domeniul Cancerului (IARC) precizează că există „probe suficiente” pentru a indica efectul carcinogen al următoarelor substanțe asupra plămânului:[39]
- Unele metale (producția de aluminiu, cadmiul și compușii din cadmiu, compuși ai cromului hexavalent, beriliul și compușii din beriliu, procesul de turnare a fierului și oțelului, compușii din nichel, arsenul și compușii anorganici ai arsenului, extragerea subterană a hematitului)
- Unele produse de combustie [combustie incompletă, cărbuni (emisii interioare din arderea cărbunelui în locuințe), gazificarea cărbunelui, gudron de huilă] producția de cocs, funingine, gaze de eșapament ale motoarelor diesel)
- Radiații ionizante (radiații X, radon-222 și produșii săi de descompunere, radiații gamma, plutoniu)
- Unele gaze toxice [eter metil (de uz tehnic), bis(clormetil) eter, iperită, MOPP (amestec de vincristină-prednison-mustargen-procarbazină), gaze din vopseluri]
- Producția de cauciuc și cristalele prafului de siliciu
Patogeneză[modificare | modificare sursă]
Similar majorității celorlalte tipuri de cancer, cancerul pulmonar este inițiat de activarea oncogenelor sau inactivarea genelor supresoare de tumori.[40] Se consideră că oncogenele îi fac pe oameni mai sensibili la dezvoltarea unei forme de cancer. Se crede că proto-oncogenele se transformă în oncogene în momentul în care sunt expuse unor anumiți agenți carcinogeni.[41] Mutațiile produse la nivelul proto-oncogenei K-ras sunt responsabile de 10-30 % din adenocarcinoamele pulmonare.[42][43] Receptorul pentru factorul de creștere epidermică (EGFR) reglează proliferarea celulară, apoptoza, angiogeneza și invazia tumorală.[42] Mutațiile și amplificarea receptorului EGFR sunt comune în cazul cancerelor pulmonare fără celule mici și stau la baza tratamentului cu inhibitori EGFR. Proto-oncogena Her2/neu este afectată mai puțin frecvent.[42] Modificările cromozomiale pot conduce la pierderea heterozigoției. Acest lucru poate provoca inactivarea genelor supresoare de tumori. Modificarea cromozomilor 3p, 5q, 13q și 17p este foarte frecventă în cazul carcinoamelor pulmonare cu celule mici. Gena supresoare de tumori p53, localizată pe cromozomul 17p, este afectată în 60-75 % din cazuri.[44] Printre alte gene care sunt în general afectate de mutații sau amplificări se numără c-MET, NKX2-1,LKB1, PIK3CA, și BRAF.[42]
Diagnostic[modificare | modificare sursă]

Efectuarea unei radiografii toracice reprezintă unul dintre primii pași necesari pentru a investiga dacă o persoană prezintă simptome care pot sugera prezența cancerului pulmonar. Această radiografie poate arăta o masă evidentă, o extindere a mediastinului (sugerează răspândirea în nodulii limfatici), atelectazie (colabare), consolidare (pneumonie) sau revărsat pleural.[5] Imagistica prin computer tomograf este de obicei folosită pentru a oferi mai multe informații cu privire la tipul și gradul de extindere al bolii. Bronhoscopia sau biopsia ghidată CT este adesea folosită pentru a preleva mostre din tumoare pentru histopatologie.[13]
Cancerul pulmonar se prezintă, de cele mai multe ori, ca un nodul pulmonar solitar în cadrul unei radiografii toracice. Cu toate acestea, diagnosticul diferențial este extins. Multe alte boli pot să prezinte aceleași simptome, inclusiv tuberculoza, infecțiile fungice, cancerul metastatic sau pneumonia organizată. Printre cauzele mai puțin comune ale nodulului pulmonar solitar se numără hamartomul, chisturile bronhogenice, adenoamele, malformația arterio-venoasă, sechestrarea pulmonară, nodulii reumatoizi, granulomatoza Wegener sau limfomul.[45] Cancerul pulmonar poate fi, de asemenea, descoperit incidental, sub forma unui nodul pulmonar solitar la nivelul unei radiografii toracice sau tomografii computerizate realizate din alte motive.[46] Diagnosticul definitiv de cancer pulmonar are la bază examinarea histologică a țesutului suspectat în context clinic și radiologic.[4]
Clasificare[modificare | modificare sursă]
| Tip histologic | Incidență la 100 000 de persoane pe an |
|---|---|
| Toate tipurile | 66.9 |
| Adenocarcinoame | 22.1 |
| Carcinoame cu celule scuamoase | 14.4 |
| Carcinoame cu celule mici | 9.8 |
Cancerele pulmonare sunt clasificate în funcție de tipul histopatologic.[11] Această clasificare este importantă pentru a alege modul de gestionare și pentru a anticipa evoluția bolii. Majoritatea cancerelor pulmonare sunt carcinoame– tumori cu caracter malign care rezultă din celulele epiteliale. Carcinoamele pulmonare sunt clasificate în funcție de dimensiune și de identificarea la microscop a celulelor maligne de către histopatolog. Cele două clase principale sunt carcinoamele fără celule mici (non-microcelulare) și cele cu celule mici (microcelulare).[47]
Cancerul bronho-pulmonar non-microcelular[modificare | modificare sursă]

Cele trei subtipuri principale ale cancerului bronho-pulmonar non-microcelular sunt adenocarcinoamele, carcinoamele pulmonare cu celule scuamoase și carcinoamele pulmonare cu celule mari.[4]
Aproximativ 40 % dintre cancerele pulmonare sunt adenocarcinoame, care de obicei apar în țesutul pulmonar periferic.[11] Majoritatea cazurilor de adenocarcinom sunt asociate cu fumatul; cu toate acestea, în rândul persoanelor care au fumat mai puțin de 100 de țigarete în viața lor („nefumători”),[4] adenocarcinoamele sunt cea mai comună formă de cancer pulmonar.[48] Un subtip de adenocarcinom, respectiv carcinomul bronhoalveolareste mai comun în rândul nefumătoarelor și poate avea o supraviețuire pe termen lung mai bună.[49]
Carcinoamele cu celule scuamoase reprezintă aproximativ 30 % dintre cancerele pulmonare. De obicei, acestea apar în apropierea căilor respiratorii principale. O cavitate seacă și moartea celulară asociată sunt identificate în mod comun în centrul tumorii.[11] Aproximativ 9 % dintre cancerele pulmonare sunt carcinoame cu celule mari sau macrocelulare. Acestea sunt denumite astfel deoarece celulele canceroase sunt mari, cu citoplasmă în exces, nucleu mare și nucleoli vizibili.[11]
Cancerul bronho-pulmonar microcelular[modificare | modificare sursă]

În cazul unui cancer bronho-pulmonar microcelular (CBPM), celulele conțin granule neurosecretoare dense (veziculecare conțin hormoni neuroendocrini), ceea ce îi conferă acestei tumori o asociere cu sindromul endocrin/paraneoplazic.[50] Majoritatea cazurilor apar în căile respiratorii mai mari (bronhiile primare și secundare]).[13] Aceste cancere se dezvoltă rapid și se extind la începutul bolii. 60-70 % dintre cazuri prezintă metastaze. Acest tip de cancer pulmonar este puternic asociat cu fumatul.[4]
Altele[modificare | modificare sursă]
Se recunosc patru subtipuri histologice principale, deși o parte dintre cancere pot conține o combinație de subtipuri diferite.[47] Subtipurile rare includ tumori glandulare, tumori carcinoide, precum și carcinoamele nediferențiate.[4]
Metastaza[modificare | modificare sursă]
| Tip histologic | Imunocolorare |
|---|---|
| Carcinoame cu celule scuamoase | CK5/6 pozitiv CK7 negativ |
| Adenocarcinoame | CK7 pozitiv TTF-1 pozitiv |
| Carcinoame cu celule mari | TTF-1 negativ |
| Carcinoame cu celule mici | TTF-1 pozitiv CD56 pozitiv Cromogranină pozitiv Sinaptofizină pozitiv |
Plămânul este un loc comun de răspândire a tumorilor aflate în alte părți ale corpului. Cancerele secundare sunt clasificate în funcție de locul de origine; de exemplu, cancerul la sân care s-a răspândit la plămân se numește cancer de sân metastatic. De cele mai multe ori, metastazele se prezintă sub o formă rotundă în cadrul radiografiei toracice.[51]
Cancerele pulmonare primare prezintă metastaze la nivelul creierului, oaselor, ficatului și glandelor suprarenale.[11] Imunocolorarea biopsiei este adesea utilă în stabilirea sursei.[52]
Stadializare[modificare | modificare sursă]
Stadializarea cancerului pulmonar reprezintă o evaluare a gradului de răspândire a cancerului de la sursă, fiind unul dintre factorii care afectează prognosticul și tratamentul posibil al cancerului pulmonar.[4]
În evaluarea inițială a stadializării cancerului pulmonar fără celule mici (CBPNM) se folosește clasificarea TNM. Aceasta are la bază dimensiunea tumoarei, implicarea nodulului limfatic, metastaza distantă. După aceasta, în funcție de descriptorii TNM, este stabilit un grup care variază de la cancerul ocult, la stadiile 0, IA (unu-A), IB, IIA, IIB, IIIA, IIIB și IV (patru). Acest grup de stadii determină alegerea tratamentului și estimarea prognosticului.[53] Carcinoamele pulmonare cu celule mici (CBPM) au fost clasificate în mod tradițional în „stadii limitate” (limitate la jumătate din torace și încadrabile într-un câmp radioterapeutic tolerabil unic) sau în „stadii avansate” (boală mai extinsă).[4] Cu toate acestea, clasificarea TNM și gruparea sunt utile în procesul de estimare a prognosticului.[53]
Atât în cazul CBPNM, cât și în cazul CBPM, cele două tipuri generale de evaluare sunt stadializarea clinică și stadializarea chirurgicală. Stadializarea clinică se realizează înainte de intervenția chirurgicală definitivă. Aceasta are la bază rezultatele studiilor de imagistică (precum tomografiile computerizate și PET scan) și rezultatele biopsiei. Stadializarea chirurgicală este evaluată fie în timpul operației, fie după aceasta, în funcție de rezultatele combinate și constatările clinice, inclusiv prin prelevarea de probe chirurgicale din ganglionii limfatici toracici.[11]
Profilaxie[modificare | modificare sursă]
Profilaxia este metoda cea mai eficientă din punctul de vedere al costurilor în ceea ce privește reducerea evoluției cancerului pulmonar. În timp ce în majoritatea țărilor au fost identificați și interziși agenții carcinogeni industriali și domestici, tabagismul este în continuare foarte răspândit. Eliminarea tabagismului reprezintă obiectivul principal pentru profilaxia cancerului pulmonar, încetarea fumatului fiind un instrument important de profilaxie în acest proces.[54]
Intervențiile de politică menite să reducă fumatul pasiv în zonele publice, precum restaurantele și locurile de muncă, au devenit tot mai comune în multe țări din Europa de Vest.[55] Bhutanul a interzis în totalitate fumatul începând cu 2005[56] , în timp ce India a introdus interzicerea fumatului în public în luna octombrie 2008.[57] Organizația Mondială a Sănătății a solicitat guvernelor să interzică total reclamele la tutun, pentru a-i împiedica pe tineri să se apuce de fumat. Guvernele au estimat că aceste interdicții au redus consumul de tutun cu 16 % în locurile în care au fost puse în aplicare.[58]
Utilizarea îndelungată a suplimentelor de vitamina A,[59][60] vitamina C,[59] vitamina D[61] sau vitamina E[59] nu reduce riscul producerii cancerului pulmonar. Unele studii sugerează că persoanele a căror alimentație include mai multe legume și fructe prezintă un risc mai mic de a dezvolta această boală,[23][62] dar acest lucru se datorează probabil variabilelor. Studiile mai riguroase nu au demonstrat nicio asociere clară.[62]
Screening[modificare | modificare sursă]
Screeningul înseamnă utilizarea testelor medicale pentru a detecta boala la persoanele asimptomatice. Dintre testele posibile de screening pentru cancerul pulmonar fac parte citologia sputei, radiografia toracică (CXR) și tomografia computerizată (CT). Programele de screening care folosesc CXR sau citologia nu au demonstrat niciun beneficiu.[63] Realizarea screeningului anual cu tomografii CT cu doze mici la persoanele cu risc ridicat (de exemplu la persoanele din categoria de vârstă 55-79 de ani care au fumat mai mult de 30 depachete an sau la cele care au avut în trecut cancer pulmonar) poate reduce riscul mortalității provocate de cancerul pulmonar cu o cantitate absolută de 0,3 % (cantitate relativă de 20 %).[64][65] Cu toate acestea, există o rată ridicată a tomografiilor fals pozitive care pot conduce la efectuarea unor proceduri invazive inutile, precum și la costuri financiare semnificative.[66] Pentru fiecare tomografie pozitivă reală, există 19 tomografii fals pozitive.[67] Expunerea la radiații reprezintă un alt potențial efect dăunător al screeningului.[68]
Management[modificare | modificare sursă]
Tratamentul cancerului pulmonar depinde de tipul de celule specifice ale cancerului, de gradul de răspândire, precum și de statusul de performanță al pacientului. Tratamentele frecvente includ îngrijirea paliativă,[69] chirurgia, chimioterapia și radioterapia.[4]
Chirurgia[modificare | modificare sursă]

Dacă investigațiile confirmă prezența CBPNM, stadiul cancerului este evaluat pentru a se stabili dacă boala este localizată și tratabilă chirurgical sau dacă s-a răspândit prea mult, astfel că nu mai poate fi vindecată chirurgical. Tomografia computerizată și tomografia cu emisie de pozitroni sunt folosite pentru a stabili acest lucru.[4] Dacă este bănuită implicarea ganglionilor limfatici mediastinali, mediastinoscopia poate fi folosită pentru a preleva mostre din aceștia și pentru a contribui la stadializare.[70] Analizele de sângelui și testarea funcției pulmonare sunt folosite pentru a evalua dacă starea persoanei este suficient de bună pentru a putea fi supusă unei intervenții chirurgicale.[13] Dacă testele de evaluare a funcției pulmonare prezintă o rezervă respiratorie scăzută, este posibil ca intervenția chirurgicală să nu fie recomandată.[4]
În majoritatea cazurilor de CBPNM în stadii incipiente, îndepărtarea unui lob al plămânului (lobectomie) este tratamentul chirurgical preferat. În cazul persoanelor care nu pot fi supuse unei lobectomii complete, se poate realiza o excizie sublobară mai mică (rezecție în unghi). Cu toate acestea, rezecția în unghi are un risc mai mare de recidică a cancerului decât lobectomia.[71] Brahiterapia cu iod radioactiv, realizată la capetele exciziei în unghi, ar putea reduce riscul recidivei.[72] În cazuri rare, se realizează îndepărtarea unui plămân întreg (pneumonectomie).[71] Chirurgia toracoscopică video asistată și lobectomia VATS folosesc o abordare minim invazivă în ceea ce privește chirurgia cancerului pulmonar.[73] Lobectomia VATS este la fel de eficientă ca lobectomia deschisă tradițională, implicând mai puține tulburări postoperatorii.[74]
În ceea ce privește CBPM, chimioterapia și/sau radioterapia sunt metodele standard folosite.[75] Cu toate acestea, rolul chirurgiei în cadrul CBPM este reanalizat în prezent. Chirurgia ar putea îmbunătăți rezultatele dacă este combinată cu chimioterapia și radioterapia în stadiile incipiente ale CBPM.[76]
Radioterapia[modificare | modificare sursă]
Radioterapia este adesea administrată împreună cu chimioterapia, putând fi utilizată în scop curativ la pacienții cu CBPNM care nu sunt eligibili pentru operație. Această formă de radioterapie de intensitate ridicată se numește radioterapie radicală.[77] O versiune rafinată a acestei tehnici este radioterapia accelerată hiperfracționată continuă (CHART), în cazul căreia se administrează o doză ridicată de radioterapie într-o perioadă scurtă de timp.[78] În general, radioterapia toracică postoperatorie nu ar trebui folosită după un episod chirurgical cu scop curativ pentru CBPNM.[79] Unele persoane la care este implicat ganglionul limfatic mediastinal N2 ar putea beneficia de radioterapie postoperatorie.[80]
În ceea ce privește cazurile de CBPM care ar putea fi tratate, radioterapia toracică este adesea recomandată în plus față de chimioterapie.[11]
În cazul în care cancerul blochează o secțiune scurtă a bronhiei, brahiterapia (radioterapia localizată) poate fi administrată în mod direct în interiorul căii respiratorii pentru a deschide calea.[81] În comparație cu radioterapia cu fascicul extern, brahiterapia permite o reducere a duratei tratamentului și a expunerii la radiații a personalului medical.[82]
Iradierea profilactică a craniului (PCI) este un tip de radioterapie craniană, folosită pentru a reduce riscul metastazării. Iradierea profilactică a craniului este cea mai utilă în cazul CBPM. În cazul bolii în stadiu limitat, PCI crește rata de supraviețuire cu 3 ani, de la 15 % la 20 %; în cazul bolii avansate, rata de supraviețuire pe un an crește de la 13 % la 27 %.[83]
Progresele recente în efectuarea tratamentelor țintite și imagistică au contribuit la dezvoltarea radiației stereotactice în tratarea cancerului pulmonar în stadii incipiente. În această formă de radioterapie, dozele mari sunt administrate într-un număr mic de sesiuni, cu ajutorul tehnicilor de targeting stereotactice. Utilizarea acestora vizează în principal pacienții care nu pot fi supuși unei intervenții chirurgicale din cauza comorbidităților.[84]
Atât pentru pacienții cu CBPNM, cât și pentru cei cu CBPM, iradierea toracelui cu doze mai mici poate fi folosită pentru a controla simptomele (radioterapie paliativă).[85]
Chimioterapie[modificare | modificare sursă]
Schema chimioterapeutică depinde de tipul de tumoare.[11] Cancerul bronho-pulmonar microcelular (CBPM), chiar și în stadiu incipient, se tratează în principal prin chimioterapie și radioterapie.[86] În cazul CBPM, cisplatina și etopozidul sunt cele mai comune medicamente administrate.[87] De asemenea, se folosesc combinații cu carboplatină, gemcitabină, paclitaxel, vinorelbină, topotecan și irinotecan.[88][89] În cazul cencerelor bronho-pulmonare non-microcelulare (CBPNM) în stadiu avansat, chimioterapia îmbunătățește rata de supraviețuire și este folosită ca tratament de primă linie, cu condiția ca starea pacientului să fie suficient de bună pentru a permite aplicarea tratamentului.[90] În general, se administrează două medicamente, dintre care unul este de cele mai multe ori bazat pe platină (cisplatină sau carboplatină). Alte medicamente folosite în mod comun sunt gemcitabina, paclitaxel, docetaxel,[91][92] pemetrexed,[93] etopozidă sau vinorelbină.[92]
Chimioterapia adjuvantă se referă la utilizarea chimioterapiei după chirurgia aparent curativă pentru a îmbunătăți rezultatele. În ceea ce privește CBPNM, probele sunt prelevate din apropierea ganglionilor limfatici în timpul intervenției chirurgicale pentru a asista stadializarea. Dacă se confirmă stadiul II sau III de boală, chimioterapia adjuvantă îmbunătățește rata de supraviețuire cu 5 % la cinci ani.[94][95] Combinația de vinorelbină și cisplatină este mai eficace decât schemele terapeutice mai vechi.[95] La persoanele cu cancer în stadiu IB, chimioterapia adjuvantă este controversată, deoarece studiile clinice nu au demonstrat în mod clar un beneficiu de supraviețuire.[96][97] Studiile privind chimioterapia preoperativă (chimioterapia neoadjuvantă) efectuate la cazurile de CBPNM rezecabile nu au fost concludente.[98]
Îngrijirea paliativă[modificare | modificare sursă]
La persoanele a căror boală este în fază terminală, ar putea fi adecvată îngrijirea paliativă sau gestionarea bolii într-un azil de profil.[13] Aceste abordări permit discutarea opțiunilor de tratament și oferă posibilitatea de a ajunge la decizii bine cântărite,[99][100] putându-se evita îngrijirea inutilă și scumpă la sfârșitul vieții.[100]
În tratarea CBPNM, chimioterapia poate fi combinată cu îngrijirea paliativă. În ceea ce privește cazurile mai grave, chimioterapia adecvată îmbunătățește rata de supraviețuire medie în comparație cu îngrijirea suportivă, precum și calitatea vieții.[101] Dacă este însoțită de exerciții fizice adecvate, menținerea chimioterapiei pe durata tratamentului paliativ al cancerului pulmonar oferă 1,5 până la 3 luni de prelungire a supraviețuirii, ameliorarea simptomelor, precum și o îmbunătățire a calității vieții, observându-se rezultate mai bune în cazul utilizării medicamentelor moderne.[102][103] Grupul de colaborare pentru meta-analize CBPNM (NSCLC Meta-Analyses Collaborative Group) recomandă luarea în considerare a chimioterapiei în cazurile de CBPNM avansat, dacă pacientul dorește și poate tolera tratamentul.[90][104]
Prognostic[modificare | modificare sursă]
| Stadiu clinic | Supraviețuire de cinci ani (%) | |
|---|---|---|
| Carcinom pulmonar fără celule mici | Carcinom pulmonar cu celule mici | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Prognosticul este în general nefavorabil. Dintre toate persoanele cu cancer pulmonar, 15 % supraviețuiesc o perioadă de cinci ani de la data diagnosticării.[5] În momentul diagnosticării, stadiul bolii este adeseori avansat. În momentul în care se prezintă la medic, 30-40 % dintre pacienții cu CBPNM sunt în stadiul IV, iar 60 % dintre pacienții cu CBPM sunt în stadiul V.[11]
Factorii de prognostic în ceea ce privește CBPNM includ prezența sau absența simptomelor pulmonare, dimensiunea tumorii, tipul de celulă (histologie), gradul de răspândire (stadiul), metastazarea la mai mulți ganglioni limfatici și invazia vasculară. În cazul persoanelor a căror boală nu poate fi operată, efectele sunt mai nefavorabile la pacienții cu status de performanță redus și scădere ponderală mai mare de 10 %.[105] Factorii de prognostic la cancerul pulmonar cu celule mici includ performanța, sexul, stadiul bolii, precum și implicarea sistemului nervos central sau a ficatului în momentul punerii diagnosticului.[106]
În ceea ce privește CBPNM, cel mai bun prognostic este obținut prin extirparea chirurgicală completă a bolii în stadiul IA, cu o rată de supraviețuire pe cinci ani de până la 70 %.[107] În ceea ce privește CBPM, rata de supraviețuire totală pe cinci ani este de aproximativ 5 %.[4] Persoanele cu CBPM în stadiu avansat au o rată de supraviețuire pe cinci mai mică de 1 %. Rata de supraviețuire medie pentru boala în stadiu limitat este de 20 de luni, având o rată de supraviețuire pe cinci ani de 20 %.[5]
Conform datelor furnizate de Institutul Național pentru Cancer, vârsta mediană la data diagnosticării cancerului pulmonar în Statele Unite este de 70 de ani,[108] iar vârsta mediană la data decesului este de 72 de ani.[109] În SUA, persoanele cu asigurare medicală au o probabilitate mai mare de a înregistra rezultate mai bune.[110]
Epidemiologie[modificare | modificare sursă]

no data ≤ 5 5-10 10-15 15-20 20-25 25-30 | 30-35 35-40 40-45 45-50 50-55 ≥ 55 |
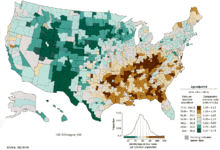
La nivel mondial, cancerul pulmonar este cel mai comun tip de cancer, atât în ceea ce privește incidența, cât și mortalitatea. În 2008, au fost diagnosticate 1,61 milioane de cazuri noi, precum și 1,38 milioane de decese provocate de cancerul pulmonar. Cele mai ridicate rate s-au înregistrat în Europa și America de Nord.[14] Segmentul de populație cu probabilitatea cea mai ridicată de a dezvolta cancer pulmonar este reprezentat de persoanele cu vârsta de peste 50 de ani, cu antecedente de fumat. În raport cu rata mortalității la bărbați, care a început să scadă în urmă cu peste 20 de ani, ratele mortalității cauzate de cancerul pulmonar la femei au crescut în ultimele decenii, recent înregistrându-se o stabilizare a tendinței.[112] În SUA, riscul pe viață de a dezvolta cancer pulmonar este de 8 % la bărbați și de 6 % la femei.[4]
La fiecare 3-4 milioane de țigarete fumate, se înregistrează un deces provocat de cancerul pulmonar.[4][113] Influența „giganților tutunului" joacă un rol semnificativ în cultura fumatului.[114] Tinerii nefumători care văd reclamele la tutun au o probabilitate mai mare să se apuce de fumat.[115] Rolul fumatului pasiv este recunoscut din ce în ce mai mult ca factor de risc al cancerului pulmonar,[27] conducând la scăderea expunerii nedorite a nefumătorilor la fumul de tutun al altor fumători, prin intervenții politice.[116] Emisiile de la automobile, fabrici și centrale electrice prezintă, de asemenea, riscuri potențiale.[7]
Europa de Est înregistrează cea mai ridicată rată a mortalității în rândul bărbaților, în timp ce Europa de nord și SUA înregistrează cea mai ridicată rată a mortalității în rândul femeilor. În Statele Unite, se înregistrează o incidență mai mare la bărbații și femeile de culoare.[117] Incidența cancerului pulmonar este în prezent mai scăzută în țările în curs de dezvoltare.[118] Având în vedere incidența crescută a fumatului în țările în curs de dezvoltare, este de așteptat ca aceastasă crească în următorii ani, în special în China[119] și India.[120]
Începând cu anii ‘60, ratele adenocarcinomului pulmonar au început să crească în raport cu alte tipuri de cancer pulmonar. Acest lucru se datorează în parte introducerii țigaretelor cu filtru. Utilizarea filtrelor îndepărtează particulele mai mari din fumul de tutun, reducând astfel depunerea acestora pe căile respiratorii principale. Cu toate acestea, fumătorul trebuie să inhaleze mai puternic pentru a primi aceeași cantitate de nicotină, ceea ce duce la creșterea depunerii de particule în căile respiratorii mici, loc în care tinde să apară adenocarcinomul.[121] Incidența adenocarcinomului pulmonar continuă să crească.[122]
Istorie[modificare | modificare sursă]
Cancerul pulmonar avea frecvență redusă înainte de apariția fumatului de țigarete, nefiind recunoscut ca boală distinctă până în 1761.[123] Diferitele aspecte ale cancerului pulmonar au fost descrise ulterior, în 1810.[124] Tumorile pulmonare maligne au reprezentat doar 1 % dintre toate cancerele observate la autopsie în 1878, dar au crescut la 10-15 % la începutul anilor 1900.[125] Rapoartele din literatura medicală au înregistrat doar 374 de cazuri la nivel mondial în 1912,[126] dar o revizuire a autopsiilor a remarcat faptul că incidența cancerului pulmonar crescuse de la 0,3 % în 1852 la 5,66 % în 1952.[127] În Germania, în 1929, medicul Fritz Lickint a recunoscut legătura dintre fumat și cancerul pulmonar,[125] ceea ce a condus la o campanie antifumat agresivă.[128] Studiul doctorilor britanici, publicat în anii ‘50, a fost prima probă epidemiologică solidă a legăturii dintre cancerul pulmonar și fumat.[129] Prin urmare, în 1964, chirurgul general al Statelor Unite le-a recomandat fumătorilor să se oprească din fumat.[130]
Legătura cu gazul radon a fost recunoscută pentru prima dată în rândul minerilor din Munții Metaliferi din apropierea Schneeberg, Saxonia. Argintul se exploatează aici din 1470, iar aceste mine sunt bogate în uraniu, radiu și radon.[131] Minerii prezentau tulburări pulmonare în număr neobișnuit de mare, recunoscute în cele din urmă drept cancer pulmonar în jurul anului 1870.[132] În pofida acestei descoperiri, mineritul a continuat până în anii ‘50 ai secolului următor, din cauza cererii de uraniu venite din partea URSS.[131] Radonul a fost confirmat drept o cauză a cancerului pulmonar în anii ‘60.[133]
Prima pneumonectomie reușită pentru cancerul pulmonar a fost realizată în 1933.[134] Radioterapia paliativă a început să fie folosită în anii ‘40.[135] Radioterapia radicală, inițial folosită în anii ‘50, a fost o încercare de a utiliza pe scară mai largă dozele de radiații la pacienții cu cancer pulmonar în stadiu incipient, dar care nu pot fi supuși unei intervenții chirurgicale.[136] În 1997, radioterapia accelerată hiperfracționată continuă a fost considerată o îmbunătățire față de radioterapia radicală convențională.[137] În ceea ce privește carcinomul pulmonar cu celule mici, încercările inițiale din anii ‘60 de extirpare chirurgicală [138] și radioterapia radicală[139] au eșuat. În anii ‘70, au fost elaborate cu succes scheme chimioterapeutice.[140]
Referințe[modificare | modificare sursă]
- ^ a b c d e f g h PubMed
- ^ http://www.asbestos.com/asbestosis/ Lipsește sau este vid:
|title=(ajutor) - ^ a b c d Disease Ontology, accesat în
- ^ a b c d e f g h i j k l m n o p q r s Horn, L (). „Chapter 89”. În Longo, DL; Kasper, DL; Jameson, JL; Fauci, AS; Hauser, SL; Loscalzo, J. Harrison's Principles of Internal Medicine (ed. 18th). McGraw-Hill. ISBN 0-07-174889-X.
- ^ a b c d „Lung Carcinoma: Tumors of the Lungs”. Merck Manual Professional Edition, Online edition. Accesat în .
- ^ Thun, MJ (). „Lung cancer occurrence in never-smokers: an analysis of 13 cohorts and 22 cancer registry studies”. PLoS Medicine. 5 (9): e185. doi:10.1371/journal.pmed.0050185. PMC 2531137
 . PMID 18788891.
. PMID 18788891.
- ^ a b c d e f g h Alberg AJ, Samet JM (). „Chapter 46”. Murray & Nadel's Textbook of Respiratory Medicine (ed. 5th). Saunders Elsevier. ISBN 978-1-4160-4710-0.
- ^ a b O'Reilly, KM (). „Asbestos-related lung disease”. American Family Physician. 75 (5): 683–688. PMID 17375514. Arhivat din original la . Accesat în .
- ^ Carmona, RH (). „The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General”. U.S. Department of Health and Human Services.
Secondhand smoke exposure causes disease and premature death in children and adults who do not smoke.
- ^ „Tobacco Smoke and Involuntary Smoking” (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. WHO International Agency for Research on Cancer. 83. .
There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) causes lung cancer in humans. ... Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).
- ^ a b c d e f g h i j k Lu, C (). „78: Cancer of the Lung”. Holland-Frei Cancer Medicine (ed. 8th). People's Medical Publishing House. ISBN 9781607950141.
- ^ Chapman, S (). „Chapter 31”. Oxford Handbook of Respiratory Medicine (ed. 2nd). Oxford University Press. ISBN 9-780199-545162.
- ^ a b c d e f Collins, LG (). „Lung cancer: diagnosis and management”. American Family Physician. American Academy of Family Physicians. 75 (1): 56–63. PMID 17225705. Arhivat din original la . Accesat în .
- ^ a b Ferlay, J (decembrie 2010). „Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008”. International Journal of Cancer. 127 (12): 2893–2917. doi:10.1002/ijc.25516. PMID 21351269.
- ^ Honnorat, J (). „Paraneoplastic neurological syndromes”. Orphanet Journal of Rare Diseases. BioMed Central. 2 (1): 22. doi:10.1186/1750-1172-2-22. PMC 1868710
 . PMID 17480225.
. PMID 17480225.
- ^ Greene, Frederick L. (). AJCC cancer staging manual. Berlin: Springer-Verlag. ISBN 0-387-95271-3.
- ^ Brown, KM (). „8”. Holland-Frei Cancer Medicine (ed. 8th). People's Medical Publishing House USA. ISBN 978-1607950141.
- ^ Biesalski, HK (). „European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel”. CA Cancer J Clin. Smoking is the major risk factor, accounting for about 90% of lung cancer incidence. 48 (3): 167–176; discussion 164–166. doi:10.3322/canjclin.48.3.167. PMID 9594919.
- ^ Hecht, S (). „Tobacco carcinogens, their biomarkers and tobacco-induced cancer”. Nature Reviews Cancer. Nature Publishing Group. 3 (10): 733–744. doi:10.1038/nrc1190. PMID 14570033.
- ^ Sopori, M (). „Effects of cigarette smoke on the immune system”. Nature Reviews Immunology. 2 (5): 372–7. doi:10.1038/nri803. PMID 12033743.
- ^ Peto, R (). Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics. Oxford University Press. ISBN 0-19-262535-7.
- ^ California Environmental Protection Agency (). „Health effects of exposure to environmental tobacco smoke. California Environmental Protection Agency”. Tobacco Control. 6 (4): 346–353. doi:10.1136/tc.6.4.346. PMC 1759599
 . PMID 9583639.
. PMID 9583639.
* CDC (). „State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000”. Morbidity and Mortality Weekly Report. Atlanta, Georgia: CDC. 50 (49): 1101–1106. PMID 11794619. Mai multe valori specificate pentru|author1=și|last=(ajutor) - ^ a b c d Alberg, AJ (). „Epidemiology of lung cancer”. Chest. American College of Chest Physicians. 132 (S3): 29S–55S. doi:10.1378/chest.07-1347. PMID 17873159. Arhivat din original la . Accesat în .
- ^ Jaakkola, MS (). „Impact of smoke-free workplace legislation on exposures and health: possibilities for prevention”. European Respiratory Journal. 28 (2): 397–408. doi:10.1183/09031936.06.00001306. PMID 16880370.
- ^ Parkin, DM (). „Tobacco—attributable cancer burden in the UK in 2010”. British Journal of Cancer. 105 (Suppl. 2): S6–S13. doi:10.1038/bjc.2011.475. PMC 3252064
 . PMID 22158323.
. PMID 22158323.
- ^ National Health and Medical Research Council (aprilie 1994). „The health effects and regulation of passive smoking”. Australian Government Publishing Service. Arhivat din original la . Accesat în .
- ^ a b Taylor, R (). „Meta-analysis of studies of passive smoking and lung cancer: effects of study type and continent”. International Journal of Epidemiology. 36 (5): 1048–1059. doi:10.1093/ije/dym158. PMID 17690135.
- ^ „Frequently asked questions about second hand smoke”. World Health Organization. Accesat în .
- ^ Schick, S (). „Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke”. Tobacco Control. 14 (6): 396–404. doi:10.1136/tc.2005.011288. PMC 1748121
 . PMID 16319363.
. PMID 16319363.
- ^ Schmid K, Kuwert T, Drexler H (). „Radon in Indoor Spaces: An Underestimated Risk Factor for Lung Cancer in Environmental Medicine”. Dtsch Arztebl Int. 107 (11): 181–6. doi:10.3238/arztebl.2010.0181. PMC 2853156
 . PMID 20386676.
. PMID 20386676.
- ^ EPA (). „Radiation information: radon”. EPA. Accesat în .
- ^ Davies, RJO (). „18.19.3”. Oxford Textbook Medicine (ed. 5th). OUP Oxford. ISBN 978-0199204854.
- ^ Chen, H (). „A systematic review of the relation between long-term exposure to ambient air pollution and chronic diseases”. Reviews on Environmental Health. 23 (4): 243–297. PMID 19235364.
- ^ Clapp, RW (). „Environmental and Occupational Causes of Cancer New Evidence, 2005–2007”. Reviews on Environmental Health. 23 (1): 1–37. PMC 2791455
 . PMID 18557596.
. PMID 18557596.
- ^ a b Lim, WY (2012 Jan). „Biomass fuels and lung cancer”. Respirology (Carlton, Vic.). 17 (1): 20–31. PMID 22008241. Verificați datele pentru:
|date=(ajutor) - ^ a b Sood, A (2012 Dec). „Indoor fuel exposure and the lung in both developing and developed countries: an update”. Clinics in chest medicine. 33 (4): 649–65. PMID 23153607. Verificați datele pentru:
|date=(ajutor) - ^ Dudley, Joel (). Exploring Personal Genomics. Oxford University Press. p. 25. ISBN 9780199644483.
- ^ Kern JA, McLennan G (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. p. 1802. ISBN 0-07-145739-9.
- ^ Cogliano, VJ (2011 Dec 21). „Preventable exposures associated with human cancers” (PDF). Journal of the National Cancer Institute. 103 (24): 1827–39. PMID 22158127. Arhivat din original (PDF) la 2012-09-20. Accesat în 2014-01-02. Verificați datele pentru:
|date=(ajutor) - ^ Fong, KM (). „Lung cancer • 9: Molecular biology of lung cancer: clinical implications”. Thorax. BMJ Publishing Group Ltd. 58 (10): 892–900. doi:10.1136/thorax.58.10.892. PMC 1746489
 . PMID 14514947.
. PMID 14514947.
- ^ Salgia, R (). „Molecular abnormalities in lung cancer”. Journal of Clinical Oncology. 16 (3): 1207–1217. PMID 9508209.
- ^ a b c d Herbst, RS (). „Lung cancer”. New England Journal of Medicine. 359 (13): 1367–1380. doi:10.1056/NEJMra0802714. PMID 18815398. Arhivat din original la . Accesat în .
- ^ Aviel-Ronen, S (). „K-ras mutations in non-small-cell lung carcinoma: a review”. Clinical Lung Cancer. Cancer Information Group. 8 (1): 30–38. doi:10.3816/CLC.2006.n.030. PMID 16870043.
- ^ Devereux, TR (). „Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors”. Chest. American College of Chest Physicians. 109 (Suppl 3): 14S–19S. doi:10.1378/chest.109.3_Supplement.14S. PMID 8598134.
- ^ Miller, WT (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. p. 486. ISBN 0-07-145739-9.
- ^ Kaiser, LR (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. pp. 1815–1816. ISBN 0-07-145739-9.
- ^ a b Maitra, A (). Robbins Basic Pathology (ed. 8th). Saunders Elsevier. pp. 528–529. ISBN 978-1-4160-2973-1.
- ^ Subramanian, J (). „Lung cancer in never smokers: a review”. Journal of Clinical Oncology. American Society of Clinical Oncology. 25 (5): 561–570. doi:10.1200/JCO.2006.06.8015. PMID 17290066.
- ^ Raz, DJ (). „Bronchioloalveolar carcinoma: a review”. Clinical Lung Cancer. 7 (5): 313–322. doi:10.3816/CLC.2006.n.012. PMID 16640802.
- ^ Rosti, G (). „Small cell lung cancer”. Annals of Oncology. 17 (Suppl. 2): 5–10. doi:10.1093/annonc/mdj910. PMID 16608983.
- ^ Seo, JB (). „Atypical pulmonary metastases: spectrum of radiologic findings”. Radiographics. 21 (2): 403–417. PMID 11259704.
- ^ Tan D, Zander DS (). „Immunohistochemistry for Assessment of Pulmonary and Pleural Neoplasms: A Review and Update”. Int J Clin Exp Pathol. 1 (1): 19–31. PMC 2480532
 . PMID 18784820.
. PMID 18784820.
- ^ a b c Rami-Porta, R (). „The revised TNM staging system for lung cancer” (PDF). Annals of Thoracic and Cardiovascular Surgery. 15 (1): 4–9. PMID 19262443.
- ^ Goodman, GE (). „Lung cancer. 1: prevention of lung cancer” (PDF). Thorax. 57 (11): 994–999. PMC 1746232
 . PMID 12403886.
. PMID 12403886.
- ^ McNabola, A (). „The control of environmental tobacco smoke: a policy review”. International Journal of Environmental Research and Public Health. 6 (2): 741–758. doi:10.3390/ijerph6020741. PMC 2672352
 . PMID 19440413.
. PMID 19440413.
- ^ Pandey, G (). „Bhutan's smokers face public ban”. BBC. Accesat în .
- ^ Pandey, G (). „Indian ban on smoking in public”. BBC. Accesat în .
- ^ „UN health agency calls for total ban on tobacco advertising to protect young” (Press release). United Nations News service. .
- ^ a b c Fabricius, P (). „Diet and lung cancer”. Monaldi Archives for Chest Disease. 59 (3): 207–211. PMID 15065316.
- ^ Fritz, H (). „Vitamin A and Retinoid Derivatives for Lung Cancer: A Systematic Review and Meta Analysis”. PLoS ONE. 6 (6): e21107. doi:10.1371/journal.pone.0021107. PMC 3124481
 . PMID 21738614.
. PMID 21738614.
- ^ Herr, C (). „The role of vitamin D in pulmonary disease: COPD, asthma, infection, and cancer”. Respiratory Research. 12 (1): 31. doi:10.1186/1465-9921-12-31. PMC 3071319
 . PMID 21418564.
. PMID 21418564.
- ^ a b Key, TJ (). „Fruit and vegetables and cancer risk”. British Journal of Cancer. 104 (1): 6–11. doi:10.1038/sj.bjc.6606032. PMC 3039795
 . PMID 21119663.
. PMID 21119663.
- ^ Manser, RL (). „Screening for lung cancer”. Cochrane Database of Systematic Reviews (1): CD001991. doi:10.1002/14651858.CD001991.pub2. PMID 14973979.
- ^ Jaklitsch, MT (). „The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups”. Journal of Thoracic and Cardiovascular Surgery. 144 (1): 33–38. doi:10.1016/j.jtcvs.2012.05.060. PMID 22710039.
- ^ Bach, PB (). „Benefits and harms of CT screening for lung cancer: a systematic review”. JAMA: the Journal of the American Medical Association. 307 (22): 2418–2429. doi:10.1001/jama.2012.5521. PMID 22610500.
- ^ Boiselle, PM (2013 Mar 20). „Computed tomography screening for lung cancer”. JAMA : the journal of the American Medical Association. 309 (11): 1163–70. PMID 23512063. Verificați datele pentru:
|date=(ajutor) - ^ Bach PB, Mirkin JN, Oliver TK; et al. (). „Benefits and harms of CT screening for lung cancer: a systematic review”. JAMA. 307 (22): 2418–29. doi:10.1001/jama.2012.5521. PMID 22610500.
- ^ Aberle, DR (2013 Mar 10). „Computed tomography screening for lung cancer: has it finally arrived? Implications of the national lung screening trial”. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 31 (8): 1002–8. PMID 23401434. Verificați datele pentru:
|date=(ajutor) - ^ Ferrell, B (). „Palliative care in lung cancer”. Surgical Clinics of North America. 91 (2): 403–417. doi:10.1016/j.suc.2010.12.003. PMID 21419260.
- ^ Kaiser LR (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. pp. 1853–1854. ISBN 0-07-145739-9.
- ^ a b Kaiser LR (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. pp. 1855–1856. ISBN 0-07-145739-9.
- ^ Odell, DD (). „Sublobar resection with brachytherapy mesh for stage I non-small cell lung cancer”. Seminars in Thoracic and Cardiovascular Surgery. 22 (1): 32–37. doi:10.1053/j.semtcvs.2010.04.003. PMID 20813314.
- ^ Alam, N (). „Video-assisted thoracic surgery (VATS) lobectomy: the evidence base”. Journal of the Society of Laparoendoscopic Surgeons. 11 (3): 368–374. PMC 3015831
 . PMID 17931521.
. PMID 17931521.
- ^ Rueth, NM (). „Is VATS lobectomy better: perioperatively, biologically and oncologically?”. Annals of Thoracic Surgery. 89 (6): S2107–S2111. doi:10.1016/j.athoracsur.2010.03.020. PMID 20493991.
- ^ Simon GR, Turrisi A (). „Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)”. Chest. 132 (3 Suppl): 324S–339S. doi:10.1378/chest.07-1385. PMID 17873178.
- ^ Goldstein, SD (). „Role of surgery in small cell lung cancer”. Surgical Oncology Clinics of North America. 20 (4): 769–777. doi:10.1016/j.soc.2011.08.001. PMID 21986271.
- ^ Arriagada, R (). Oxford Textbook of Oncology (ed. 2nd). Oxford University Press. p. 2094. ISBN 0-19-262926-3.
- ^ Hatton, MQ (). „Continuous hyperfractionated accelerated radiotherapy (CHART) and non-conventionally fractionated radiotherapy in the treatment of non-small cell lung cancer: a review and consideration of future directions”. Clinical Oncology (Royal College of Radiologists). 22 (5): 356–364. doi:10.1016/j.clon.2010.03.010. PMID 20399629.
- ^ PORT Meta-analysis Trialists Group (). Rydzewska, Larysa, ed. „Postoperative radiotherapy for non-small cell lung cancer”. Cochrane Database of Systematic Reviews (2): CD002142. doi:10.1002/14651858.CD002142.pub2. PMID 15846628.
- ^ Le Péchoux, C (). „Role of postoperative radiotherapy in resected non-small cell lung cancer: a reassessment based on new data”. Oncologist. 16 (5): 672–681. doi:10.1634/theoncologist.2010-0150. PMC 3228187
 . PMID 21378080.
. PMID 21378080.
- ^ Cardona, AF (). „Palliative endobronchial brachytherapy for non-small cell lung cancer”. Cochrane Database of Systematic Reviews (2): CD004284. doi:10.1002/14651858.CD004284.pub2. PMID 18425900.
- ^ Ikushima, H (). „Radiation therapy: state of the art and the future”. Journal of Medical Investigation. 57 (1–2): 1–11. PMID 20299738.[nefuncțională]
- ^ Paumier, A (). „Prophylactic cranial irradiation in lung cancer”. Cancer Treatment Reviews. 37 (4): 261–265. doi:10.1016/j.ctrv.2010.08.009. PMID 20934256.
- ^ Girard, N (). „Stereotactic radiotherapy for non-small cell lung cancer: From concept to clinical reality. 2011 update”. Cancer Radiothérapie. 15 (6–7): 522–526. doi:10.1016/j.canrad.2011.07.241. PMID 21889901.
- ^ Fairchild, A (). „Palliative thoracic radiotherapy for lung cancer: a systematic review”. Journal of Clinical Oncology. 26 (24): 4001–4011. doi:10.1200/JCO.2007.15.3312. PMID 18711191.
- ^ Hann CL, Rudin CM (). „Management of small-cell lung cancer: incremental changes but hope for the future”. Oncology (Williston Park). 22 (13): 1486–92. PMID 19133604.
- ^ Murray, N (). „A review of first-line treatment for small-cell lung cancer”. Journal of Thoracic Oncology. 1 (3): 270–278. PMID 17409868.
- ^ Azim, HA (). „Treatment options for relapsed small-cell lung cancer”. Anticancer drugs. 18 (3): 255–261. doi:10.1097/CAD.0b013e328011a547. PMID 17264756.
- ^ MacCallum, C (). „Second-line treatment of small-cell lung cancer”. Current Oncology Reports. 8 (4): 258–264. doi:10.1007/s11912-006-0030-8. PMID 17254525.
- ^ a b NSCLC Meta-Analyses Collaborative Group (). „Chemotherapy in Addition to Supportive Care Improves Survival in Advanced Non–Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 16 Randomized Controlled Trials”. J. Clin. Oncol. 26 (28): 4617–25. doi:10.1200/JCO.2008.17.7162. PMC 2653127
 . PMID 18678835.
. PMID 18678835.
- ^ Mehra R, Treat J (). Fishman's Pulmonary Diseases and Disorders (ed. 4th). McGraw-Hill. p. 1876. ISBN 0-07-145739-9.
- ^ a b Clegg, A (). „Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review”. Thorax. BMJ Publishing Group. 57 (1): 20–28. doi:10.1136/thorax.57.1.20. PMC 1746188
 . PMID 11809985.
. PMID 11809985.
- ^ Fuld AD, Dragnev KH, Rigas JR (). „Pemetrexed in advanced non-small-cell lung cancer”. Expert Opin Pharmacother. 11 (8): 1387–402. doi:10.1517/14656566.2010.482560. PMID 20446853.
- ^ Carbone, DP (). „Adjuvant therapy in non-small cell lung cancer: future treatment prospects and paradigms”. Clinical Lung Cancer. 12 (5): 261–271. doi:10.1016/j.cllc.2011.06.002. PMID 21831720.
- ^ a b Le Chevalier, T (). „Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?”. Annals of Oncology. 21 (Suppl. 7): vii196–198. doi:10.1093/annonc/mdq376. PMID 20943614.
- ^ Horn, L (). „The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer”. Journal of Thoracic Oncology. 2 (5): 377–383. doi:10.1097/01.JTO.0000268669.64625.bb. PMID 17473651.
- ^ Wakelee, HA (). „Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial”. Clinical Lung Cancer. Cancer Information Group. 8 (1): 18–21. doi:10.3816/CLC.2006.n.028. PMID 16870041.
- ^ BMJ (). Clinical evidence concise : the international resource of the best available evidence for effective health care. London: BMJ Publishing Group. pp. 486–488. ISBN 1-905545-00-2. ISSN 1475-9225.
- ^ Kelley AS, Meier DE (). „Palliative care—a shifting paradigm”. New England Journal of Medicine. 363 (8): 781–2. doi:10.1056/NEJMe1004139. PMID 20818881.
- ^ a b Prince-Paul M (). „When hospice is the best option: an opportunity to redefine goals”. Oncology (Williston Park, N.Y.). 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ^ Souquet PJ, Chauvin F, Boissel JP, Bernard JP (). „Meta-analysis of randomised trials of systemic chemotherapy versus supportive treatment in non-resectable non-small cell lung cancer”. Lung Cancer. 12 Suppl 1: S147–54. doi:10.1016/0169-5002(95)00430-9. PMID 7551923.
- ^ Sörenson S, Glimelius B, Nygren P (). „A systematic overview of chemotherapy effects in non-small cell lung cancer”. Acta Oncol. 40 (2–3): 327–39. PMID 11441939.
- ^ Clegg A, Scott DA, Sidhu M, Hewitson P, Waugh N (). „A rapid and systematic review of the clinical effectiveness and cost-effectiveness of paclitaxel, docetaxel, gemcitabine and vinorelbine in non-small-cell lung cancer”. Health Technol Assess. 5 (32): 1–195. PMID 12065068.
- ^ Non-Small Cell Lung Cancer Collaborative Group (2010). „Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer”. Cochrane Database of Systematic Reviews (5): CD007309 (2nd rev.). doi:. PMID 20464750.
- ^ „Non-Small Cell Lung Cancer Treatment”. PDQ for Health Professionals. National Cancer Institute. Accesat în .
- ^ „Small Cell Lung Cancer Treatment”. PDQ for Health Professionals. National Cancer Institute. . Accesat în .
- ^ Spiro, SG (). „18.19.1”. Oxford Textbook Medicine (ed. 5th). OUP Oxford. ISBN 978-0199204854.
- ^ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Diagnosis 2002-2003
- ^ SEER data (SEER.cancer.gov)Median Age of Cancer Patients at Death 2002-2006
- ^ Slatore, CG (noiembrie 2010). „An official American Thoracic Society systematic review: insurance status and disparities in lung cancer practices and outcomes”. American Journal of Respiratory and Critical Care Medicine. 182 (9): 1195–1205. doi:10.1164/rccm.2009-038ST. PMID 21041563.
- ^ „WHO Disease and injury country estimates”. World Health Organization. . Accesat în .
- ^ Jemal A, Tiwari RC, Murray T; et al. (). „Cancer statistics, 2004”. CA: a Cancer Journal for Clinicians. 54 (1): 8–29. doi:10.3322/canjclin.54.1.8. PMID 14974761.
- ^ Proctor, RN (). „The history of the discovery of the cigarette-lung cancer link: evidentiary traditions, corporate denial, global toll”. Tobacco Control. 21 (2): 87–91. doi:10.1136/tobaccocontrol-2011-050338. PMID 22345227.
- ^ Lum, KL (). „Signed, sealed and delivered: "big tobacco" in Hollywood, 1927–1951”. Tobacco Control. 17 (5): 313–323. doi:10.1136/tc.2008.025445. PMC 2602591
 . PMID 18818225.
. PMID 18818225.
- ^ Lovato, C (octombrie 2011). „Impact of tobacco advertising and promotion on increasing adolescent smoking behaviours”. Cochrane Database of Systematic Reviews (10): CD003439. doi:10.1002/14651858.CD003439.pub2. PMID 21975739.
- ^ Kemp, FB (). „Smoke free policies in Europe. An overview”. Pneumologia. 58 (3): 155–158. PMID 19817310.
- ^ National Cancer Institute; SEER stat fact sheets: Lung and Bronchus. Surveillance Epidemiology and End Results. 2010 [1]
- ^ „Gender in lung cancer and smoking research” (PDF). World Health Organization. . Accesat în .
- ^ Zhang, J (noiembrie 2011). „Tobacco smoking in China: prevalence, disease burden, challenges and future strategies”. Respirology. 16 (8): 1165–1172. doi:10.1111/j.1440-1843.2011.02062.x. PMID 21910781.
- ^ Behera, D (). „Lung cancer in India” (PDF). Indian Journal of Chest Diseases and Allied Sciences. 46 (4): 269–281. PMID 15515828. Arhivat din original (PDF) la . Accesat în .
- ^ Charloux, A (). „The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adenocarcinoma”. International Journal of Epidemiology. 26 (1): 14–23. doi:10.1093/ije/26.1.14. PMID 9126499.
- ^ Kadara, H (). „Pulmonary adenocarcinoma: a renewed entity in 2011”. Respirology. 17 (1): 50–65. doi:10.1111/j.1440-1843.2011.02095.x. PMID 22040022.
- ^ Morgagni, Giovanni Battista (). De sedibus et causis morborum per anatomen indagatis. OL 24830495M.
- ^ Bayle, Gaspard-Laurent (). Recherches sur la phthisie pulmonaire (în French). Paris. OL 15355651W.
- ^ a b Witschi, H (). „A short history of lung cancer”. Toxicological Sciences. 64 (1): 4–6. doi:10.1093/toxsci/64.1.4. PMID 11606795.
- ^ Adler, I (). Primary Malignant Growths of the Lungs and Bronchi. New York: Longmans, Green, and Company. OCLC 14783544. OL 24396062M., cited in Spiro SG, Silvestri GA (). „One hundred years of lung cancer”. American Journal of Respiratory and Critical Care Medicine. 172 (5): 523–529. doi:10.1164/rccm.200504-531OE. PMID 15961694.
- ^ Grannis, FW. „History of cigarette smoking and lung cancer”. smokinglungs.com. Arhivat din originalul de la . Accesat în .
- ^ Proctor, R (). The Nazi War on Cancer. Princeton University Press. pp. 173–246. ISBN 0-691-00196-0.
- ^ Doll, R (). „Lung Cancer and Other Causes of Death in Relation to Smoking”. British Medical Journal. 2 (5001): 1071–1081. doi:10.1136/bmj.2.5001.1071. PMC 2035864
 . PMID 13364389.
. PMID 13364389.
- ^ US Department of Health Education and Welfare (). „Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service” (PDF). Washington, DC: US Government Printing Office.
- ^ a b Greaves, M (). Cancer: the Evolutionary Legacy. Oxford University Press. pp. 196–197. ISBN 0-19-262835-6.
- ^ Greenberg, M (). „Lung cancer in the Schneeberg mines: a reappraisal of the data reported by Harting and Hesse in 1879”. Annals of Occupational Hygiene. 37 (1): 5–14. PMID 8460878.
- ^ Samet, JM (). „Radiation and cancer risk: a continuing challenge for epidemiologists”. Environmental Health. 10 (Suppl. 1): S4. doi:10.1186/1476-069X-10-S1-S4. PMC 3073196
 . PMID 21489214.
. PMID 21489214.
- ^ Horn, L (). „Evarts A. Graham and the first pneumonectomy for lung cancer”. Journal of Clinical Oncology. 26 (19): 3268–3275. doi:10.1200/JCO.2008.16.8260. PMID 18591561. Arhivat din original la . Accesat în .
- ^ Edwards, AT (). „Carcinoma of the Bronchus”. Thorax. 1 (1): 1–25. doi:10.1136/thx.1.1.1. PMC 1018207
 . PMID 20986395.
. PMID 20986395.
- ^ Kabela, M (). „Erfahrungen mit der radikalen Röntgenbestrahlung des Bronchienkrebses” [Experience with radical irradiation of bronchial cancer]. Ceskoslovenská Onkológia (în German). 3 (2): 109–115. PMID 13383622.
- ^ Saunders, M (). „Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial”. Lancet. Elsevier. 350 (9072): 161–165. doi:10.1016/S0140-6736(97)06305-8. PMID 9250182.
- ^ Lennox, SC (). „Results of resection for oat-cell carcinoma of the lung”. Lancet. Elsevier. 2 (7575): 925–927. doi:10.1016/S0140-6736(68)91163-X. PMID 4176258.
- ^ Miller, AB (). „Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus”. Lancet. Elsevier. 2 (7619): 501–505. doi:10.1016/S0140-6736(69)90212-8. PMID 4184834.
- ^ Cohen, M (). „Intensive chemotherapy of small cell bronchogenic carcinoma”. Cancer Treatment Reports. 61 (3): 349–354. PMID 194691.
Legături externe[modificare | modificare sursă]
 Materiale media legate de cancer pulmonar la Wikimedia Commons
Materiale media legate de cancer pulmonar la Wikimedia Commons- Detailed guide: Lung cancer - small cell Arhivat în , la Wayback Machine. American Cancer Society
- Detailed guide: Lung cancer - non-small cell Arhivat în , la Wayback Machine. American Cancer Society
- 1957 Film on link between smoking and lung cancer Arhivat în , la Wayback Machine. Early video on smoking and lung cancer
- Lung cancer tutorial Arhivat în , la Wayback Machine. ChestRadiology.net
- Cancer pulmonar pe Curlie
- LungCancer.org — free resources and support services
- Lung cancer National Cancer Institute
- Tobacco smoke and involuntary smoking, summary of data reported and evaluation (2004) IARC
- Lung Cancer Articles & Information Stop smoking articles & information at National Institutes of Health
- Medical Encyclopedia WebMD: Lung Cancer Health Center
- Medical Encyclopedia MayoClinic: Lung cancer
- Clinically reviewed lung cancer information for patients, from Cancer Research UK
- Cancerul-bombă: evoluează exploziv și omoară pe capete, 19 decembrie 2011, Dan Istratie, Evenimentul zilei
- Cancerul pulmonar, despre cancerul pulmonar'
- Radioterapie VMAT Arhivat în , la Wayback Machine., "Clinica Amethyst Radiotherapy"
