Acid percloric
| Acid percloric | |
 Model 3D | |
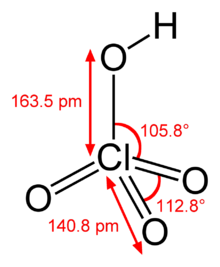 Structura moleculară | |
| Denumiri | |
|---|---|
| Alte denumiri | - |
| Identificare | |
| Număr CAS | 7601-90-3 |
| PubChem CID | 24247 |
| Informații generale | |
| Formulă chimică | HClO4 |
| Aspect | lichid colorat |
| Masă molară | 100.46 g/mol |
| Proprietăți | |
| Densitate | 1.67 g/cm3 |
| Starea de agregare | lichid |
| Punct de topire | -112 °C (anhidru) |
| Punct de fierbere | 203°C |
| Solubilitate | miscibil în apă |
| Anion | Hidrogen |
| Cation | Perclorat |
| Duritate (Scara Mohs) | - |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul percloric (HClO4) este cel mai stabil dintre oxoacizii clorului și, totodată, cel mai tare și mai acid dintre acizii oxigenați. El se poate obține în stare liberă din sărurile lui, prin tratare cu H2SO4, apoi distilare sub presiune redusă.
În stare anhidră se prepară prin distilarea în vid a acidului percloric concentrat, în prezența unui agent deshidratant, cum este percloratul de magneziu.
Proprietăți fizice[modificare | modificare sursă]
Acidul percloric este un lichid incolor care fumegă în prezența aerului[2] și este solubil în apă.
Formează un azeotrop la compoziția de 72 % cu punct de fierbere 2030C[3].
Proprietăți chimice[modificare | modificare sursă]
Este un acid tare, cel mai tare acid oxigenat. Prin încălzire se descompune, iar în prezența substanțelor organice explodează puternic.
La răcire se obțin cristale monohidrate[4].
Anhidrida acidului percloric este heptoxid de diclor – Cl2O7. Acesta are două legături covalente simple și trei legături covalent coordinative.
Sărurile acidului percloric – perclorații – sunt cei mai stabili compuși oxigenați ai clorului. Se prepară prin oxidare anodică a cloraților în soluție apoasă sau prin încălzirea cloraților la temperaturi de peste 400°C:
Toți perclorații (cu excepția celor de cesiu CsClO4, rubidiu RbClO4, potasiu KClO4 și amoniu NH4ClO4) sunt solubili.
Utilizări[modificare | modificare sursă]
Acidul percloric diluat e folosit ca reactiv analitic pentru precipitarea ionului de potasiu[5] datorită solubilității foarte reduse a percloratului de potasiu în apă (0,75g per 100g de apă la 00C[6])
Note[modificare | modificare sursă]
Bibliografie[modificare | modificare sursă]
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p. 22
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză)
- Raluca Ripan, I. Ceteanu, Manual de lucrări practice de chimie anorganică - vol I Metaloizi, Editura de stat didactică și pedagogică, București, 1961
| |||||||||||||

