Acid cianhidric
| Acid cianhidric | |
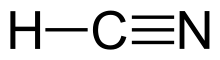 | |
 | |
 | |
| Denumiri | |
|---|---|
| Nume IUPAC | Formonitril (substitutiv) Hidridonitridocarbon (aditiv) |
| Alte denumiri | Acid prusic Cianură de hidrogen Zyklon B |
| Identificare | |
| Număr CAS | 74-90-8 |
| ChEMBL | CHEMBL183419 |
| PubChem CID | 768 |
| Informații generale | |
| Formulă chimică | HCN |
| Aspect | miros de migdale amare |
| Masă molară | 27,03 g/mol |
| Proprietăți | |
| Densitate | 0,69 g/cm3 |
| Starea de agregare | lichidă |
| Punct de topire | −13 °C |
| Punct de fierbere | 26 °C |
| Solubilitate | nu disociază complet în apă deoarece este un acid slab |
| Presiune de vapori | 0,816 bar (20 °C) |
| Indice de refracție(nD) | 1,2675 |
| Vâscozitate | dinamică 0,201 poiseuille |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul cianhidric (sau cianura de hidrogen) este un compus chimic cu formula HCN. Este un lichid incolor, gălbui, inflamabil, cu o solubilitate bună în apă, cu un miros neplăcut de migdale amare, extrem de toxic.[2] Mirosul asemănător cu cel de migdale se explică prin faptul că semințele de migdale conțin o glicozidă cianogenă, care sub acțiunea enzimei hidroxilnitrilază se descompune în glucoză și acid cianhidric. Este produs în cantități mari, deoarece este un compus destul de important din punct de vedere industrial, fiind folosit ca și precursor pentru mulți compuși chimici (de la polimeri la medicamente).
Obținere[modificare | modificare sursă]
Acidul cianhidric poate fi obținut plecând de la multe combinații ale hidrogenului, ale carbonului și ale azotului (în special amoniac). În prezent, este sintetizat în cantități industriale prin diverse procedee, și este și obținut ca și produs rezidual în procesul de fabricare al acrilonitrilului.[2] În anul 2006, au fost produse numai în Statele Unite minimum 225 de milioane de kg.[3]
Cel mai important procedeu de obținere este oxidarea Andrusov, în care metanul și amoniacul reacționează în prezență de oxigen, la aproximativ 1200 °C și pe un catalizator de platină:[4]
- 2 CH4 + 2 NH3 + 3 O2 → 2 HCN + 6 H2O
Energia necesară pentru desfășurarea reacției este furnizată prin oxidarea parțială a metanului și amoniacului.
O altă metodă, de o importanță mai scăzută, este procedeul Degussa, în care se folosesc aceeași reactanți (metan și amoniac), dar reacția are loc în atmosferă lipsită de oxigen, iar energia trebuie transferată indirect prin peretele reactorului:[5]
- CH4 + NH3 → HCN + 3H2
Proprietăți[modificare | modificare sursă]
Proprietăți chimice[modificare | modificare sursă]
În combinație cu potasiul formează sarea cianură de potasiu, care este utilizată la obținerea aurului.
Răspândire[modificare | modificare sursă]
Acidul cianhidric se poate extrage din fructele care au endocarp, precum cireșele, merele, caisele și migdalele amare, din care se extrage uleiul de migdale. Multe dintre aceste endocarpuri conțin cantități mici de cianhidrine, precum mandelonitril sau amigdalină, care pot elibera HCN.[6][7]
Toxicitate[modificare | modificare sursă]
Acidul cianhidric este un gaz extrem de toxic. A fost folosit în timpul Germaniei naziste în lagărele de exterminare sub denumirea comercială de Zyklon B[8]. Acidul cianhidric este trecut în lista armelor chimice (gaz de luptă)[9];
Vezi și[modificare | modificare sursă]
Referințe[modificare | modificare sursă]
- ^ „Acid cianhidric”, hydrogen cyanide (în engleză), PubChem, accesat în
- ^ a b Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M. (), „Cyano Compounds, Inorganic”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a08_159.pub2
- ^ [1] Arhivat în , la Wayback Machine.. EPA. Accesat 2013-01-31. Cifra calculată în kg din livre
- ^ Andrussow, L. (). „The catalytic oxydation of ammonia-methane-mixtures to hydrogen cyanide”. Angewandte Chemie. 48 (37): 593–595. doi:10.1002/ange.19350483702.
- ^ Endter, F. (). „Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff”. Chemie Ingenieur Technik. 30 (5): 305–310. doi:10.1002/cite.330300506.
- ^ Vetter, J. (). „Plant cyanogenic glycosides”. Toxicon. 38 (1): 11–36. doi:10.1016/S0041-0101(99)00128-2. PMID 10669009.
- ^ Jones, D. A. (). „Why are so many food plants cyanogenic?”. Phytochemistry. 47 (2): 155–162. doi:10.1016/S0031-9422(97)00425-1. PMID 9431670.
- ^ Dwork, Deborah (). Auschwitz, 1270 to the present. Norton. p. 219. ISBN 0393039331. Mai multe valori specificate pentru
|pages=și|page=(ajutor) - ^ „Hydrogen Cyanide”. Organisation for the Prohibition of Chemical Weapons. Accesat în .
| ||||||||||||||
