Tetrahidrofuran
| Tetrahidrofuran | |
 | |
 | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 109-99-9 |
| ChEMBL | CHEMBL276521 |
| PubChem CID | 8028 |
| Informații generale | |
| Formulă chimică | (CH2)4O |
| Masă molară | 72 u.a.m.[2] |
| Proprietăți | |
| Densitate | 1 g/cm³[3] |
| Punct de topire | −163 Fahrenheit[3] |
| Punct de fierbere | 151 de Fahrenheiti[3] |
| Presiune de vapori | 132 mm Hg[3] |
| Viscozitate | dinamică 0 poiseuille |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Tetrahidrofuranul (notat de obicei THF și denumit și oxolan)[4] este un compus heterociclic cu formula (CH2)4O. Este un lichid incolor, miscibil în apă cu viscozitate scăzută la temperatură și presiune standard. Compusul este heterociclic și un solvent folositor. Este utilizat ca precursor pentru polimeri.[5] Mirosul său este asemănător cu cel al eterului dietilic, dar este un anestezic mai puțin potențial ca acesta.
Obținere[modificare | modificare sursă]
Aproximativ 200.000 de tone de THF sunt produse anual.[6] Cea mai utilizată metodă de sinteză la nivel industrial implică o reacție de deshidratare catalizată în mediu acid a 1,4-butandiolului, metodă similară cu cea utilizată pentru sinteza eterului dietilic din etanol. Diolul se obține în urma reacției de condensare dintre acetilenă și formaldehidă, printr-un intermediar diol cu legătură triplă (2-butin-1,4-diol), urmată de hidrogenare:[5]

THF mai poate fi sintetizat în urma hidrogenării catalitice a furanului (analogul său nesaturat).[7][8] Această metodă permite transformarea anumitor pentoze la THF prin intermediul furfuralului, care poate fi decarbonilat la furan,[9] deși această metodă este destul de rar folosită.
Proprietăți chimice[modificare | modificare sursă]
Polimerizare[modificare | modificare sursă]
În prezența acizilor tari, THF suferă o reacție de polimerizare cu formarea unui polimer liniar, denumit poli(tetrametileneter) glicol (PTMEG), cunoscut și ca politetrametilen oxid (PTMO):
- n C4H8O → −(CH2CH2CH2CH2O)n−
Acest polimer este majoritar utilizat pentru obținerea fibrelor elastomere de poliuretan (de exemplu, Spandex).[10]
Ca solvent[modificare | modificare sursă]
La nivel de laborator, THF este un solvent destul de frecvent utilizat, când nu intervine miscibilitatea sa cu apa. Prezintă un caracter bazic mai pronunțat în comparație cu eterul dietilic,[11] formând complecși cu ionii de Li+, Mg2+ și cu boranii. Este un solvent popular pentru reacția de hidroborare și pentru compușii organometalici, precum compușii organolitici sau reactivii Grignard.[12]
Alte proprietăți[modificare | modificare sursă]

THF este o bază Lewis slabă, formând diverși complecși cu halogenurile metalelor tranziționale. Complecșii tipici prezintă o stoechiometrie de tipul MCl3(THF)3.[14] Acești compuși sunt utilizați pe post de reactivi.
În prezența unui catalizator acid solid, THF formează cu hidrogenul sulfurat formând tetrahidrotiofen (tiolan).[15]
Prin contactul cu aerul, THF formează un peroxid organic exploziv, denumit 2-hidroperoxitetrahidrofuran:
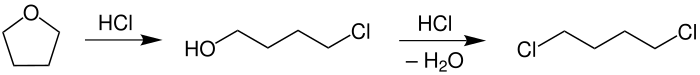
Când este încălzit în prezența acidului clorhidric, THF este ușor deciclizat cu formarea de 4-clorobutanol și apoi de 1,4-diclorobutan:
Note[modificare | modificare sursă]
- ^ „Tetrahidrofuran”, TETRAHYDROFURAN (în engleză), PubChem, accesat în
- ^ „Tetrahidrofuran”, TETRAHYDROFURAN (în engleză), PubChem, accesat în
- ^ a b c d http://www.cdc.gov/niosh/npg/npgd0602.html Lipsește sau este vid:
|title=(ajutor) - ^ „New IUPAC Organic Nomenclature - Chemical Information BULLETIN” (PDF).
- ^ a b Müller, Herbert (), „Tetrahydrofuran”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a26_221
- ^ Karas, Lawrence; Piel, W. J. (). „Ethers”. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson (). Organic Chemistry (ed. 2nd). Allyn and Bacon. p. 569.
- ^ Starr, Donald; Hixon, R. M. (), „Tetrahydrofuran”, Org. Synth.; Collective Volume, 2, p. 566
- ^ Hoydonckx, H. E.; Rhijn, W. M. Van; Rhijn, W. Van; Vos, D. E. De; Jacobs, P. A. (), „Furfural and Derivatives”, Ullmann's Encyclopedia of Industrial Chemistry (în engleză), American Cancer Society, doi:10.1002/14356007.a12_119.pub2, ISBN 978-3-527-30673-2
- ^ Pruckmayr, Gerfried; Dreyfuss, P.; Dreyfuss, M. P. (). „Polyethers, Tetrahydrofuran and Oxetane Polymers”. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons.
- ^ Lucht, B. L.; Collum, D. B. (). „Lithium Hexamethyldisilazide: A View of Lithium Ion Solvation through a Glass-Bottom Boat”. Accounts of Chemical Research. 32 (12): 1035–1042. doi:10.1021/ar960300e.
- ^ Elschenbroich, C.; Salzer, A. (). Organometallics: A Concise Introduction (ed. 2nd). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ^ F.A.Cotton, S.A.Duraj, G.L.Powell, W.J.Roth (). „Comparative Structural Studies of the First Row Early Transition Metal(III) Chloride Tetrahydrofuran Solvates”. Inorg. Chim. Acta. 113: 81. doi:10.1016/S0020-1693(00)86863-2.
- ^ Manzer, L. E. "Tetrahydrofuran Complexes of Selected Early Transition Metals," Inorganic Synthesis. 21, 135–140, (1982).
- ^ Swanston, Jonathan (), „Thiophene”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a26_793.pub2


