Electroliza apei
| Acest articol nu a fost verificat de alți editori. Sunteți invitat să participați la corecturi sau să faceți propuneri pentru reorganizarea paginii și îmbunătățirea conținutului în conformitate cu politica oficială și îndrumările proiectului Wikipedia. |
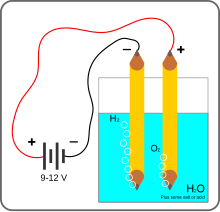

Electroliza apei reprezintă descompunerea apei în gazele oxigen și hidrogen ca urmare a trecerii unui curent electric prin apă. Reacția standard are un potențial de -1.23 V, ceea ce înseamnă că în mod ideal necesită o diferență de potențial electric de 1,23 de volți pentru a putea descompune apa.
Această tehnică poate fi folosită pentru producerea de hidrogen molecular (combustibil) și oxigen; în prezent însă, cele mai multe metode industriale produc hidrogen din gaze naturale.
Istoric[modificare | modificare sursă]
Jan Rudolph Deiman și Adriaan Paets van Troostwijk au folosit în 1789, o mașină electrostatică pentru a crea electricitate ce a fost aplicată pe electrozi de aur într-o butelie de Leyda cu apă.[1] În 1800 Alessandro Volta a inventat pila voltaică și câteva săptămâni mai târziu, William Nicholson și Anthony Carlisle au folosit-o pentru electroliza apei. Când Zénobe Gramme a inventat mașina Gram în 1869, electroliza apei a devenit o metodă ieftină pentru producția de hidrogen. O metodă de sinteză industrială a hidrogenului si oxigenului prin electroliză a fost dezvoltată de către Dmitri Lachinov în 1888.[2]
Principiul[modificare | modificare sursă]
O sursă de energie electrică de curent continuu este conectată la doi electrozi, sau două plăci (de obicei realizate dintr-un metal inert, cum ar fi de platină, oțel inoxidabil sau iridiu), care sunt plasate în apă. Hidrogenul va apărea la catod (caz în care electronii intră în apă), iar oxigenul va apărea la anod.[3] Presupunând o eficiență faradaică ideală, cantitatea de hidrogen generată este de două ori cantitatea de oxigen, și ambele sunt proporționale cu sarcină electrică totală condusă de soluție.[4] Cu toate acestea, în multe celule apar reacții secundar concurente, rezultând diferite produse și o eficiență mai redusă decât eficiența faradaică ideală.
Electroliza apei pure necesită un exces de energie sub formă de suprapotential pentru a depăși diverse bariere de activare. Fără excesul de energie electroliza apei pure se produce foarte încet sau deloc. Acest lucru este în parte datorită fenomenului limitat de auto-ionizare a apei. Apa pură are o conductivitate electrică de aproximativ o milionime din cea a apei de mare. Multe celule electrolitice pot, de asemenea, să nu aibă lipsa electrocatalizatoare. Eficiența electrolizei este crescută prin adăugarea unui electrolit (cum ar fi o sare, un acid sau o bază) și prin utilizarea de electrocatalizatoarelor.
În prezent, proces electrolitic este rar folosit în aplicații industriale deoarece hidrogenul poate fi produs mai accesibil din combustibili fosili.[5]
Ecuații[modificare | modificare sursă]

În apă pură la catodul încărcat negativ are loc o reacție de reducere, electronii (e−) de la catod fiind dați la cationii de hidrogen pentru a forma hidrogen. Jumătatea reacției, echilibrată cu acid, este:
La anodul încărcat pozitiv, are loc o reacție de oxidare, ce generează oxigen și oferă electroni anodui pentru a finaliza circuitul:
- Oxidare la anod: 2H2O(l) → O2(g) + 4 H+(aq) + 4e−
Aceeași jumătăți de reacții pot fi de asemenea, echilibrate cu bazele enumerate mai jos. Nu toate jumătățile de reacții trebuie să fie echilibrate cu acid sau cu baze. Multe o fac, cum este cea de oxidare sau reducere a apei prezentată aici. Pentru a adăuga jumătăți de reacții, ambele părți trebuie să fie echilibrate cu un acid sau cu o bază. Reacțiile echilibrate cu acid predomină în soluții acide (pH scăzut), în timp ce reacțiile echilibrate cu baze predomină în soluțiile bazice (pH ridicat).
| Catod (reducere): | 2 H2O(l) + 2e− | → | H2(g) + 2 OH−(aq) |
| Anod (oxidare): | 4 OH−(aq) | → | O2(g) + 2 H2O(l) + 4 e− |
Combinarea fiecărei jumătăți de reacție, dă aceiași descompunere generală a apei în oxigen și hidrogen:
- Reacția generală: 2 H2O(l) → 2 H2(g) + O2(g)
Numărul de molecule de hidrogen produse este astfel dublul numărului de molecule de oxigen. Presupunând egalitatea de temperatură și presiune pentru ambele gaze, hidrogenul produs are prin urmare, de două ori volumul de oxigenului produs. Numărul de electroni împins prin apă este de două ori numărul de molecule de hidrogen generate și de patru ori numărul de molecule de oxigen generate.
Termodinamica[modificare | modificare sursă]
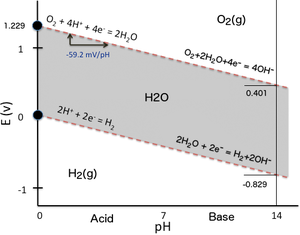
Descompunerea apei pure în hidrogen și oxigen la temperatură și presiune standard nu este favorabilă în termeni de termodinamică.
| Anod (oxidare): | 2 H2O(l) | → | O2(g) + 4 H+(aq) + 4e− | Eo = +1.23 V[6] |
| Catod (reducere): | 2 H+(aq) + 2e− | → | H2(g) | Eo = 0,00 V |
Astfel, potențialul standard al unei celule de electroliză a apei (Eocelulă = Eocatod − Eoanod) este de -1.23V la 25°C, la pH 0 ([H+] = 1.0 M). La 25°C, cu pH-ul 7 ([H+] = 1.0×10−7 M), potențialul este neschimbat conform ecuației lui Nernst. Potențialul termodinamic al unei celule standard poate fi obținut din calcularea energiei libere a stării standard, pentru a găsi ΔG° și apoi se folosește ecuația: ΔG°= -nFE°(unde E° este potențialul celulei). În practică, atunci când o celulă electrochimică este "condusă" spre finalizare prin aplicarea unui potențial rezonabil, aceasta este controlată cinetic. Prin urmare, energia de activare, mobilitatea ionică (difuzie) și concentrația, rezistenta firului, rezistența suprafeței, inclusiv formarea de bule (ca cauzează o zona de blocaja electrodului) și entropia, necesită aplicarea unui potențial mai mare pentru a putea depăși acești factori. Valoarea cu care trebuie mărit potențialul este numit suprapotențial.
Alegerea electrolitului[modificare | modificare sursă]

Dacă procesele descrise mai sus au loc în apă pură, H+cu cationii vor fi consumați/reduți la catod și anionii OH− vor fi consumați/oxidați la anod. Acest lucru poate fi verificat prin adăugarea unui indicator de pH în apă: apa de lângă catod este bazică în timp ce apa din apropierea anodului este acidă. Ionii negativi de hidroxid care se apropie de anod cea mai mare parte se combină cu ionii pozitivi de hidroniu (H3O+) pentru a forma apă. Ionii pozitivi hidroniu care se apropie de catod, în cea mai mare parte se combină cu ionii negativi de hidroxid pentru a forma apă. Relativ puțini ioni de hidroniu/hidroxid ajung la catod/anod. Acest lucru poate provoca o concentrare a suprapotențialului la ambii electrozi.
Apa pură este un foarte bun izolator, deoarece are un nivel scăzut al autoionizării, Kw = 1.0×10-14 la temperatura camerei, și astfel, apa pură conduce curent slab, 0.055 µS·cm-1.[7] Până când nu se aplică un potențial foarte mare, care să determine o creștere a autoionizării apei, electroliza apei pure are loc foarte încet fiind limitată de conductivitatea generală a acesteia.
Dacă se adaugă un electrolit solubil în apă, conductivitatea apei crește considerabil. Electrolitul se disociază în cationi și anioni; anionii se grăbesc spre anod și neutralizează acumularea încărcăturii pozitive H+ de acolo; în mod similar, cationii se grăbesc spre catod și neutralizează acumularea încărcăturii negative OH− de acolo. Aceasta permite circulația continuă a energiei electrice.[8]
Trebuie avut grijă la alegerea electrolitului, deoarece un anion din electrolit este în competiție cu ionii de hidroxid pentru a da un electron. Un anion din electrolit cu un potențial standard al electrodului mai mic decât al hidroxidului va fi oxidat în loc de hidroxid, și nici oxigen nu va fi produs. Un cation cu un potențial standard al electrodului mai mare decât al ionului de hidrogen va fi redus în schimb, și nu va fi produs hidrogen de loc.
Următorii cationi au potențialul de electrod mai mic decât H+ și sunt prin urmare, adecvați pentru utilizare ca și cationi în electrolit: Li+, Rb+, K+, Cs+, Ba2+, Sr2+, Ca2+, Na+, Mg2+. Sodiul și litiul sunt utilizate frecvent, deoarece ei formează săruri ieftine și solubile.
În cazul în care un acid este folosit ca electrolit, cationul este H+, și nu există nici un concurent pentru H+ creat prin disocierea apei. Cei mai frecvent utilizat anion este sulfatul (SO2−
4), deoarece este foarte dificil să oxideze, cu potențialului standard de oxidare al acestui ion față de ionul de peroxidisulfat fiind -2.05 volți.
Acizii puternici cum este acidul sulfuric (H2SO4), și bazele puternice cum sunt hidroxidul de potasiu (KOH) și hidroxidul de sodiu (NaOH) sunt utilizate frecvent ca electroliți din cauza puternicei lor capacități conductoare.
Un electrolit din polimer solid poate fi de asemenea utilizat, cum ar fi Nafion și atunci când este aplicat cu ajutorul unui catalizator special pe fiecare parte a membranei, poate împărți eficient molecula de apă chiar și cu 1,5 Volți. Există de asemenea, o serie de alte sisteme de electrolit solid care au fost testate și dezvoltate cu un număr de sisteme de electroliza acum disponibile în comerț, care folosesc electroliți solizi.[9]
Tehnici[modificare | modificare sursă]
Demonstrație fundamentală[modificare | modificare sursă]
Două sârme, care vin de la bornele unei baterii, sunt plasate într-o ceașcă de apă cu o cantitate de electrolit pentru a stabili conductivitate în soluție. Folosind NaCl (sare de masă) într-o soluție de electrolit rezultă gaz de clor mai degrabă decât de oxigen din cauza unei jumătăți de reacție concurentă. Cu electrozii și electroliții corecți, cum ar fi bicarbonatul de sodiu (bicarbonat de sodiu), hidrogenul și oxigenul vor fi colectați la electrozii încărcați opus. Oxigenul se va colecta de la electrodul încărcat pozitiv (anod) și hidrogenul se va colecta de la electrodul încărcat negativ (catod). Rețineți că hidrogenul este încărcat pozitiv în H2O moleculă, astfel încât va ajunge la electrodul negativ. (Și vice-versa pentru oxigen.)
Rețineți că într-o soluție apoasă de apă cu ioni de clorură, electroliza va duce fie la OH− dacă concentrația de Cl− este scăzută, fie la gazul de clor, acesta fiind preferential evacuat în cazul în care concentrația de Cl− este mai mare decât 25% din masa soluției.

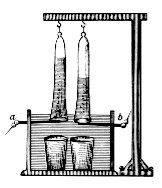
Voltametrul Hofmann[modificare | modificare sursă]
Voltametrul Hofmann este adesea folosit ca o mică celulă electrolitică. El este compus din trei cilindrii alăturați în poziție verticală. Cilindrul din mijloc este deschis la partea de sus pentru a permite adăugarea de apă și electrol. Un electrod de platină este plasat în partea de jos a fiecăruia din cei doi cilindrui laterali, conectați la bornele pozitive și negative ale unei surse de energie electrică. Atunci când curentul circulă prin voltametrul Hofmann, la anod (pozitiv) se formează oxigen iar la catod (negativ) se formează hidrogen. Fiecare gaz dizlocă apa și este colectat în partea de sus a celor două tuburi exterioare, de unde poate fi extras cu un robinet.
Industrială[modificare | modificare sursă]
Multe celule de electroliză industrială sunt foarte asemănătoare cu voltamentru Hofmann, cu plăci de platină complexe sau cu faguri ca și electrozi. În general, singura dată când hidrogenul este produs intenționat prin electroliză, este pentru utilizare în aplicații specifice, cum este cazul lămpilor cu oxihidrogen sau când este necesar hidrogen sau oxigen de înaltă puritate. Marea majoritate a hidrogenului este produs din hidrocarburi și ca urmare conține urme de monoxid de carbon , printre alte impurități. Monoxidul de carbon ca și impuritate, poate fi dăunător pentru diverse sisteme, inclusiv pentru multe celule de combustibil.
De înaltă presiune[modificare | modificare sursă]
Electroliza de înaltă presiune este electroliza apei cu hidrogenul comprimat la ieșire în jurul valorii de 120-200 Bar (1740-2900 psi).[10] Prin presurizarea hidrogenului în electrolizor, nevoie unui compresor de hidrogen extern este eliminată; consumul mediu de energie pentru compresia internă fiind de aproximativ 3%.[11]
De înaltă temperatură[modificare | modificare sursă]
Electroliza de înaltă temperatură (de asemenea HTE sau electroliza aburului) este o metodă investigată în prezent pentru electroliza apei, folosind un motor termic. Electroliza de temperatură ridicată electroliza poate fi de preferat în locul electrolizei tradiționale la temperatura camerei, deoarece o parte din energie este furnizată sub formă de căldură, care este mai ieftină decât energia electrică, și pentru că reacția de electroliză este mult mai eficientă la temperaturi mai ridicate.[12][13]
Nichel/fier[modificare | modificare sursă]
În 2014, cercetătorii au anunțat un sistem de electroliză realizat din materiale ieftine și abundente, nichel și fier, mai degrabă decât din catalizatori realizați din metale prețioase, precum platina sau iridiu. Structura nichel-metal/nichel-oxid este mult mai activă decât metalul de nichel pur sau decât oxidul de nichel pur. Acest catalizator reduce semnificativ tensiunea necesară.[14][15] De asemenea, bateriile nichel–fier sunt investigate pentru utilizare ca și baterii combinate și pentru producerea hidrogenului prin electroliză. Aceste "batolizoare" ar putea fi încărcate și descărcate ca și bateriile convenționale, și ar produce hidrogen atunci când sunt complet încărcate.[16]
Aplicații[modificare | modificare sursă]
Aproximativ cinci la sută din gazul hidrogen produs în întreaga lume este creat prin electroliză. Majoritatea din acest hidrogen produs prin electroliză, este un produs secundar în producția de clor și sodă caustică. Acesta este un prim exemplu de o reacție secundară concurentă.
- 2NaCl + 2H2O → Cl2 + H2 + 2NaOH
La electroliza cu sare, amestecul de apă/clorură de sodiu, reprezintă doar jumătate din electroliza apei, deoarece ionii de clor sunt oxidați în clor, mai degrabă decât apa să fie oxidată în oxigen. Din punct de vedere termodinamic, acest lucru nu ar fi de așteptat, deoarece potențialul de oxidare al ionului de clor este mai mic decât cel al apei, dar rata de reacție a clorului este mult mai mare decât cea a apei, făcându-l să predomine. Hidrogenul produs din acest proces este ars (conversia înapoi la apă) și utilizat pentru producția de produse chimice de specialitate, sau pentru diverse alte aplicații la scară mică.
Electroliza apei este de asemenea utilizată pentru a genera oxigen pentru Stația Spațială Internațională.[17][18]
Hidrogenul poate fi folosit apoi într-o celulă de combustibil ca o metodă de stocare a energiei și a apei.[19]
Eficiența[modificare | modificare sursă]
Producția industrială[modificare | modificare sursă]
Eficiența generatoarelor de hidrogen moderne este dată de energia consumată per volumul standard de hidrogen (MJ/m3), în condiții de temperatură și presiune standard a H2. Cu cât este mai mică energia utilizată de un generator, cu atât mai mare va fi eficiența acestuia; un electrolizor cu eficiență de 100% ar consuma 39,4 kilowați-oră per kilogram (142 MJ/Kg) de hidrogen,[20] 12,749 de jouli per litru (12,75 MJ/m3). Electroliza practică (folosind un electrolizor rotativ la o presiune de 15 bari) poate consuma 50 kilowați-oră per kilogram (180 MJ/Kg), și alți 15 kilowați oră (54 MJ) dacă hidrogenul este comprimat pentru utilizarea în mașini pe hidrogen.[21]
Furnizorii de electrolizoare oferă eficiența pe baza entalpiei. Pentru a evalua eficiența susținută a unui electrolizor, este important să se stabilească cum a fost aceasta definită de către furnizor (de exemplu, care este valoarea entalpiei, ce densitate de curent are, etc.).
Există două tehnologii disponibile pe piață, electrolizoare alcaline și cu membrană schimbătoare de protoni (PEM). Electrolizoarele alcaline sunt mai ieftine în termeni de investiție (în general ele folosesc catalizatori de nichel), dar mai puțin eficiente; electrolizoarele PEM în schimb, sunt mai scumpe (în general folosesc catalizatori din categoria metalelor scumpe), dar sunt mai eficiente și pot funcționa la densități de curent mai mare, și, prin urmare, poate fi, eventual, mai ieftin dacă producția de hidrogen este suficient de mare.
Electroliza convențională alcalină are o eficiență de aproximativ 70%.[22] Contabilizarea utilizării acceptate a căldurii mai mari (pentru că ineficiența datorată căldurii poate fi redirecționată înapoi în sistem pentru a produce aburul necesar catalizatorului), eficiența medie pentru electroliza PEM este în jur de 80%.[23] Acest lucru este de așteptat să crească la valori între 82-86%[24] până în 2030. Eficiența teoretică pentru electrolizoarele PEM este prezisă a fi de până la 94%.[25]

Suprapotențial[modificare | modificare sursă]
Electrolizoarele de apă reale necesită tensiuni mai mari de reacție pentru a funcționa. Ceea ce depășește 1.23 V[26] este numit suprapotențial sau supratensiune, și reprezintă orice fel de pierdere și orice nu este deal în procesul electrochimic.
Pentru o celulă bine concepută cel mai mare suprapotențial îl reprezintă suprapotențialul de reacție necesar pentru oxidarea a patru electroni ai apei în oxigen la anod; electrocataliza poate facilita această reacție, iar aliajele de platină, reprezintă ultima generație pentru această oxidare. Dezvoltarea unei electrocatalize ieftine și eficiente pentru această reacție va reprezenta un mare avans, și este un subiect de cercetare actual; există mai multe abordări, printre ele o soluție veche de 30 de ani, reteta pentru sulfura de molibden,[27] punctele cuantice de grafen,[28] nanotuburi de carbon, structura perovskit,[29] și nichel/nichel-oxid.[30][31] Cea mai simplă reacție pentru a produce hidrogen la catod, cea de doi electroni, poate fi electrocatalizată cu aproape nici un suprapotențial folosind platina, sau în teorie, enzima de hidrogenază. Dacă sunt folosite alte materiale, mai puțin eficiente, pentru catod (de exemplu grafitul), va apărea un suprapotențial mare.
Termodinamica[modificare | modificare sursă]
Electroliza apei în condiții standard necesită în teorie minim 237 kJ de energie electrică, pentru a disocia fiecare mol de apă, care este standardul energiei libere Gibbs pentru apă. De asemenea, necesită energie pentru a depăși modificarea entropică a reacției. Prin urmare, procesul nu poate continua mai jos 286 kJ pe mol dacă nu se adaugă căldură/de energie externă.
Deoarece fiecare mol de apă necesită doi moli de electroni, și având în vedere că constanta Faraday F reprezintă sarcina unui mol de electroni (96485 C/mol), rezultă că tensiunea minimă necesară pentru electroliză este de aproximativ 1,23 V.[32] Dacă electroliza se efectuează la temperaturi ridicate, această tensiune se reduce. Acest lucru permite practic electrolizorului să funcționeze la mai mult de 100% eficiență electrică. În sistemele electrochimice acest lucru înseamnă că trebuie să fie furnizată căldură în reactor pentru a susține reacția. În acest fel energia termică poate fi folosită ca parte din necesarul de energie al electrolizei.[33] În mod similar tensiunea necesară poate fi redusă (sub 1V) dacă diferiți combustibili (cum ar fi carbonul, alcoolul, biomasa) se află în reacție cu apa (electrolizorul pa bază de PEM la temperatură scăzută) sau cu ionii de oxigen (electrolizor la temperatură ridicată ce funcționează pe bază de electrolit solid). Acest lucru face ca parte din energia combustibilului să fie folosită pentru a "ajuta" procesul de electroliză și poate reduce costul total al producerii hidrogenului.[34]
Cu toate acestea, datorită entropiei (și a altor pierderi), sunt necesare tensiuni de peste 1,48V pentru declanșarea reacției la densități practice ale curentului (tensiune termoneutră).
În caz electrolizei apei, energia liberă Gibbs reprezintă lucrul minim necesar pentru declanșarea și întreținerea reacției, iar entalpia reacției reprezintă cantitatea de energie (atât sub formă de locul de lucru cât și de căldură) care trebuie să fie furnizată, astfel încât produsul reacției să fie la aceeași temperatură cu cel al reactantului (de exemplu, temperatura standard pentru valorile date mai sus). Potențial, un electrolizor funcționând la 1,48V va avea o eficiență de 100%.[necesită citare]
Vezi și[modificare | modificare sursă]
Referințe[modificare | modificare sursă]
- ^ Levie, R. de (octombrie 1999). „The electrolysis of water”. Journal of Electroanalytical Chemistry. 476 (1): 92–93. doi:10.1016/S0022-0728(99)00365-4. Accesat în .
- ^ Lachinov Dmitry Aleksandrovich Arhivat în , la Wayback Machine. at Great Cyrill and Methodius Encyclopedia ru
- ^ Zumdahl, Steven S.; Zumdahl, Susan A. (). Chemistry (ed. 9th). Cengage Learning. p. 866. ISBN 978-1-13-361109-7.
- ^ Carmo, M; Fritz D; Mergel J; Stolten D (). „A comprehensive review on PEM water electrolysis”. Journal of Hydrogen Energy. 38 (12): 4901–4934. doi:10.1016/j.ijhydene.2013.01.151.
- ^ „Hydrogen Basics — Production”. Florida Solar Energy Center. . Accesat în .
- ^ standard electrode potential (data page)
- ^ Light, Truman S.; Licht, Stuart; Bevilacqua, Anthony C.; Morash, Kenneth R. (). „The Fundamental Conductivity and Resistivity of Water”. Electrochemical and Solid-State Letters (în engleză). 8 (1): E16–E19. doi:10.1149/1.1836121. ISSN 1099-0062.
- ^ Pauling, Linus (1970) General Chemistry, Section 15-2. San Francisco.
- ^ Badwal, SPS; Giddey S; Munnings C (). „Hydrogen production via solid electrolytic routes”. WIRES Energy and Environment. 2 (5): 473–487. doi:10.1002/wene.50. Arhivat din original la . Accesat în .
- ^ 2001-High pressure electrolysis – The key technology for efficient H.2[nefuncțională]
- ^ Ghosh, P.C; Emonts, B; Janßen, H; Mergel, J; Stolten, D (). „Ten years of operational experience with a hydrogen-based renewable energy supply system” (PDF). Solar Energy. 75 (6): 469–478. Bibcode:2003SoEn...75..469G. doi:10.1016/j.solener.2003.09.006. Arhivat din original în .CS1 maint: Unfit url (link)
- ^ „High temperature electrolysis using SOEC”. Hi2h2. Accesat în .
- ^ „WELTEMP-Water electrolysis at elevated temperatures”. Weltemp.eu. . Arhivat din original la . Accesat în .
- ^ „A low-cost water splitter that runs on an ordinary AAA battery”. KurzweilAI. .
- ^ Gong, Ming; Zhou, Wu; Tsai, Mon-Che; Zhou, Jigang; Guan, Mingyun; Lin, Meng-Chang; Zhang, Bo; Hu, Yongfeng; Wang, Di-Yan; Yang, Jiang; Pennycook, Stephen J.; Hwang, Bing-Joe; Dai, Hongjie (). „Nanoscale nickel oxide/nickel heterostructures for active hydrogen evolution electrocatalysis”. Nature Communications. 5: 4695. Bibcode:2014NatCo...5E4695G. doi:10.1038/ncomms5695. PMID 25146255.
- ^ F. M. Mulder et al: Efficient electricity storage with the battolyser, an integrated Ni-Fe-battery and electrolyser. Energy and Environmental Science. 10, 3, 756-764, 2017, doi:10.1039/C6EE02923J
- ^ „Making Space Safer with Electrolysis”. ASME. Accesat în .
- ^ „Breathing Easy on the Space Station”. NASA Science. Arhivat din original la . Accesat în .
- ^ „Solar Hydrogen Fuel Cell Water Heater (Educational Stand)”. Scribd.
- ^ Luca Bertuccioli; et al. (). „Development of water electrolysis in the European Union” (PDF). Client Fuel Cells and Hydrogen Joint Undertaking. Arhivat din original (PDF) la . Accesat în .
- ^ Stensvold, Tore (26 January 2016). «Coca-Cola-oppskrift» kan gjøre hydrogen til nytt norsk industrieventyr. Teknisk Ukeblad, .
- ^ Stolten, Detlef (). Hydrogen Science and Engineering: Materials, Processes, Systems and Technology. John Wiley & Sons. p. 898. ISBN 9783527674299. Accesat în .
- ^ „ITM - Hydrogen Refuelling Infrastructure - February 2017” (PDF). www.level-network.com. Arhivat din original (PDF) la . Accesat în .
- ^ „Cost reduction and performance increase of PEM electrolysers” (PDF). www.fch.europa.eu. Fuel Cells and Hydrogen Joint Undertaking. Accesat în .
- ^ Bjørnar Kruse; Sondre Grinna; Cato Buch (). „Hydrogen—Status and Possibilities” (PDF). The Bellona Foundation. p. 20. Arhivat din original în .CS1 maint: Unfit url (link)
- ^ 1.23 V is the standard potential; in non-standard conditions it may be different, in particular it decreases with temperature.
- ^ Kibsgaard, Jakob; Jaramillo, Thomas F.; Besenbacher, Flemming (). „Building an appropriate active-site motif into a hydrogen-evolution catalyst with thiomolybdate [Mo3S13]2− clusters”. Nature Chemistry. 6 (3): 248–253. Bibcode:2014NatCh...6..248K. doi:10.1038/nchem.1853. PMID 24557141.
- ^ Fei, Huilong; Ye, Ruquan; Ye, Gonglan; Gong, Yongji; Peng, Zhiwei; Fan, Xiujun; Samuel, Errol L. G.; Ajayan, Pulickel M.; Tour, James M. (). „Boron- and Nitrogen-Doped Graphene Quantum Dots/Graphene Hybrid Nanoplatelets as Efficient Electrocatalysts for Oxygen Reduction”. ACS Nano. 8 (10): 141001091116007. doi:10.1021/nn504637y.
- ^ Luo, J.; Im, J.-H.; Mayer, M. T.; Schreier, M.; Nazeeruddin, M. K.; Park, N.-G.; Tilley, S. D.; Fan, H. J.; Gratzel, M. (). „Water photolysis at 12.3% efficiency via perovskite photovoltaics and Earth-abundant catalysts”. Science. 345 (6204): 1593–1596. Bibcode:2014Sci...345.1593L. doi:10.1126/science.1258307. PMID 25258076.
- ^ Shwartz, Mark (). „Stanford scientists develop water splitter that runs on ordinary AAA battery”. News.stanford.edu. Accesat în .
- ^ „Scientists develop a water splitter that runs on an ordinary AAA battery”. Technology.org. . Accesat în .
- ^ Hyman D. Gesser (). Applied Chemistry. Springer. pp. 16–. ISBN 978-0-306-46700-4. Accesat în .
- ^ Badwal, Sukhvinder P.S.; Giddey, Sarbjit; Munnings, Christopher (septembrie 2013). „Hydrogen production via solid electrolytic routes”. Wiley Interdisciplinary Reviews: Energy and Environment. 2 (5): 473–487. doi:10.1002/wene.50.
- ^ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (). „Emerging electrochemical energy conversion and storage technologies (open access)”. Frontiers in Chemistry. 2. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133
 . PMID 25309898.
. PMID 25309898.
Legături externe[modificare | modificare sursă]
- „Electrolysis of Water”. Experiments on Electrochemistry. Arhivat din original la . Accesat în .
- „Electrolysis of Water”. Do Chem 044. Arhivat din original la . Accesat în .
- EERE 2008 – 100 kgH2/Trade Study Arhivat în , la Wayback Machine.
- NREL 2006 – Electrolysis, technical report
- Foto(electro)liza apei, p38
