Scleroză multiplă
| Scleroză multiplă | |
 Demielinizare datorată SM. Țesutul colorat CD68 arată câteva macrofage în zona leziunii, la scara originală de 1:100 | |
| Specialitate | neurologie |
|---|---|
| Simptome | chronic neuropathic pain[*][1] |
| Metodă de diagnostic | imagistică prin rezonanță magnetică tomografie cu emisie de pozitroni[*] lumbar puncture[*] |
| Clasificare și resurse externe | |
| ICD-9 | 340 |
| ICD-10 | G35 |
| ICD-11 | |
| ICD-9-CM | 340[2][3] |
| OMIM | 126200 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine | neuro/228 oph/179 emerg/321 pmr/82radio/461 |
| Patient UK | Scleroză multiplă |
| MeSH ID | D009103 |
| GeneReviews | * Overview |
| Modifică date / text | |
Scleroza multiplă (MS), numită și scleroză în plăci, scleroză diseminată sau encefalomielită diseminată, este o boală inflamatorie în care tecile izolatoare ale celulelor nervoase din creier și măduva spinării sunt deteriorate. Această deteriorare afectează capacitatea sistemului nervos de a comunica, producând o plajă largă de semne și simptome,[4][5] incluzând handicapuri fizice, mentale[5] și uneori probleme psihice.[6] MS ia diferite forme, noi simptome apărând fie în atacuri sporadice (forme de recădere) sau agravându-se cu trecerea timpului (forme progresive).[7] Între episoade, simptomele pot dispărea complet; totuși, adesea rezultă probleme neurologice permanente, în special în stadii mai avansate ale bolii.[7]
În timp ce cauza bolii nu este clară, se crede că mecanismul ei ar fi fie o boală autoimună, fie un defect al celulelor care produc mielină.[8] Printre cauzele propuse se numără factori genetici și de mediu, cum ar fi infecțiile.[5][9] SM este de obicei diagnosticată pe baza prezenței semnelor și simptomelor și a rezultatelor testelor medicale corespunzătoare.
Nu se cunoaște nici un tratament pentru scleroza multiplă. Diversele terapii urmăresc să îmbunătățească funcțiile după fiecare episod și să prevină noi episoade.[5] Medicamentele folosite pentru a trata SM, deși au o eficacitate destul de mică, pot avea efecte adverse și pot fi greu tolerate. Numeroase persoane urmează tratamente alternative, în pofida lipsei de dovezi privind eficacitatea acestora. Rezultatul pe termen lung este dificil de prognosticat; rezultatele bune se întâlnesc mai adesea la femei, la cei care dobândesc boala din tinerețe, la pacienții cu recăderi și la cei care au avut la început doar puține episoade.[10] Speranța de viață este cu 5-10 ani mai mică decât la populația care nu suferă de această boală.[4]
Conform datelor din 2008, între 2 și 2,5 milioane de oameni erau afectați la nivel mondial, incidența variind puternic în diferite regiuni ale globului și în funcție de populație.[11] Boala debutează de obicei între vârstele de 20 și 50 ani, fiind de două ori mai des întâlnită la femei decât la bărbați.[12] Numele de scleroză multiplă se referă la cicatricile (sclerele —mai cunoscute sub numele de plăci sau leziuni) aflate în special în substanța albă a creierului și măduvei spinării.[13] SM a fost descrisă pentru prima oară în 1868 de Jean-Martin Charcot.[13] Un număr de tratamente noi și metode de diagnostic sunt în curs de dezvoltare.
Semne și simptome[modificare | modificare sursă]

O persoană cu SM poate avea aproape orice fel de simptom sau semn neurologic, problemele sistemului nervos autonomic, cele vizuale, motorii și senzoriale fiind cele mai frecvente.[4] Simptomele specifice sunt determinate prin locația leziunilor din cadrul sistemului nervos și pot include pierderi ale sensibilității sau modificări ale senzațiilor cum ar fi înțepături, furnicături sau amorțeli, slăbiciune musculară, reflexe foarte pronunțate, spasme musculare sau dificultăți de mișcare; dificultăți de coordonare și echilibru (ataxie); probleme în vorbire sau de înghițire, probleme vizuale (nistagmus, nevropatie optică sau vedere dublă), oboseală, dureri acute sau cronice și afectarea vezicii urinare și a intestinelor, etc.[4] De asemenea, sunt frecvente dificultățile cognitive și problemele emoționale cum ar fi depresia sau dispoziția instabilă.[4] Fenomenul lui Uhthoff, o înrăutățire a simptomelor datorată expunerii la temperaturi mai ridicate, și semnul lui Lhermitte, o senzație de curentare de-a lungul spatelui, produsă de înclinarea gâtului, sunt deosebit de caracteristice pentru SM.[4] Măsura principală pentru debilitarea produsă și pentru severitatea bolii este Scala Extinsă a Stării de Incapacitate (EDSS); alte metode de evaluare, cum ar fi indicatorii funcționali compuși ai sclerozei multiple sau Multiple Sclerosis Functional Composite, sunt din ce în ce mai des folosite în cercetare.[14][15][16]
Boala debutează în 85% din cazuri ca un sindrom clinic izolat de-a lungul câtorva zile, 45% din cazuri având probleme motorii sau senzoriale, 20% având nevropatie optică, iar 10% având simptome legate de disfuncțiile trunchiului encefalic, în timp ce restul de 25% au mai mult de una din dificultățile enumerate mai sus.[17] Evoluția simptomelor urmează inițial două tipare generale, fie ca episoade de înrăutățire bruscă, durând cel puțin câteva zile până la câteva luni (numite recidive, exacerbări, accese, atacuri sau recăderi) urmate de îmbunătățire (85% din cazuri) sau o înrăutățire treptată lipsită de perioade de recuperare (10-15% din cazuri).[12] O combinație a acestor două tipare este de asemenea posibilă[7] sau se poate întâmpla ca pacienții să pornească cu un traiect de recidivă și remisie care se transformă mai târziu forma progresivă.[12] Recidivele sunt de obicei imprevizibile, apărând fără semne de avertizare.[4] Rareori se produc mai mult de două recăderi pe an.[4] Unele recăderi sunt totuși precedate de factori declanșatori obișnuiți și apar mai des primăvara și vara.[18] În mod asemănător, infecțiile virale, cum ar fi răceala comună, gripa și gastroenterita sporesc riscul acestor recăderi.[4] De asemenea, stresul poate produce astfel de atacuri.[19] Sarcina scade riscul de recădere; totuși, în primele luni de la sarcină riscul crește.[4] Pe ansamblu, sarcina nu pare să influențeze incapacitatea pe termen lung.[4] Despre mai multe evenimente s-a dovedit că nu afectează riscul de recădere, acestea fiind vaccinările, lactația,[4] traumele fizice[20] și fenomenul Uhthoff.[18]
Cauze[modificare | modificare sursă]
Cauza SM este necunoscută; totuși, se crede că este rezultatul unei combinații de factori de mediu, cum ar fi agenții infecțioși, și factori genetici.[4] Teoriile încearcă să combine datele pentru a forma o explicație probabilă, dar nicio astfel de explicație nu s-a impus. Deși există un număr de factori de mediu care produc riscul de boală și deși unii dintre ei pot fi parțial modificați, este nevoie de cercetări suplimentare pentru a determina dacă eliminarea lor ar putea preveni SM.[21]
Geografie[modificare | modificare sursă]
SM este mai întâlnită la oamenii care trăiesc mai departe de ecuator, deși există și excepții.[4][22] Aceste excepții includ grupuri etnice la care riscul este mic deși sunt departe de ecuator, cum ar fi sami, amerindienii, huteriții canadieni, maorii din Noua Zeelandă,[23] și inuiții canadieni,[12] la fel cum există grupuri cu risc mare dar care trăiesc aproape de ecuator, cum ar fi sarzii,[12] palestinienii si parsii.[23] Cauza acestei distribuții geografice nu este clară.[12] În timp ce gradientul nord-sud de apariție a bolii este în scădere,[22] în anul 2010 el era încă prezent.[12]
SM este mai întâlnită în regiunile cu populații nord-europene[4] iar variația geografică poate reflecta pur și simplu distribuția globală a acestei populații cu risc înalt.[12] Expunerea scăzută la lumina Soarelui, ceea ce are ca rezultat producția scăzută de viamina D a fost de asemenea propusă drept explicație.[24][25] O legătură între anotimpul nașterii și MS ar susține această idee, în emisfera nordică existând mai puțini pacienți născuți în noiembrie decât în luna mai.[26] Factorii de mediu pot juca un rol de-a lungul copilăriei; unele studii au constatat că oamenii care se mută într-altă regiune a lumii înainte de a împlini 15 ani prezintă riscul de SM corespunzător acelei regiuni. Dacă imigrarea are loc după vârsta de 15 ani, persoanele respective păstrează riscul de SM corespunzător țării de origine.[4][21] Există unele dovezi că efectul imigrării ar putea influența și persoanele cu vârsta de peste 15 ani (în momentul imigrării).[4]
Genetică[modificare | modificare sursă]

SM nu este considerată boală ereditară; totuși, s-a demonstrat că un număr de variații genetice sporesc riscul de SM.[27] Probabilitatea este mai mare la rudele unei persoane afectate, cu un risc mai mare la cei la care legătura de rudenie este mai puternică.[5] La gemenii univitelini, ambii sunt afectați în 30% din cazuri, în timp ce la gemenii diferiți acest procentaj este în jur de 5%, iar la frați/surori care nu sunt gemeni este de 2,5%, cu un procentaj și mai scăzut la cei care sunt doar pe jumătate frați sau surori.[4][5][28] Dacă ambii părinți sunt afectați, riscul la copii este de 10 ori mai mare decât în general.[12] SM este de asemenea mai întâlnită la unele grupuri etnice decât la altele.[29]
Genele specifice care au fost corelate cu MS includ diferențe ale sistemului antigenului leucocitar uman (human leucocyte antigen, HLA) — un grup de gene de pe cromozomul 6 care servește drept complex major de histocompatibilitate (MHC).[4] Că schimbările din regiunea HLA sunt asociate cu riscul de SM se știe de treizeci de ani;[30] mai mult, s-a constatat că aceeași regiune este responsabilă de apariția unor alte boli autoimune, cum ar fi diabet de tipul I și lupus eritematos sistemic.[30] Cele mai solide rezultate se referă la asocierea dintre scleroza multiplă și alelele MHC DR15 și DQ6.[4] S-a constatat că alți loci au un efect protector, cum ar fi HLA-C554 și HLA-DRB1*11.[4] Pe ansamblu, se estimează că modificările HLA sunt responsabile pentru 20-60% din predispoziția genetică pentru SM.[30] Prin metodele genetice moderne (studii de asociere la nivelul întregului genom) s-au descoperit cel puțin douăsprezece alte gene în afară de locusul HLA care cresc ușor probabilitatea de apariție a MS.[30]
Agenți infecțioși[modificare | modificare sursă]
Numeroși microbi au fost propuși ca factori declanșatori ai SM, însă niciunul nu a fost confirmat.[5] Mutarea la o vârstă mică dintr-o anumită zonă a globului în alta modifică riscul de apariție a SM la persoana respectivă.[9] O posibilă explicație este faptul că un anumit tip de infecție, produsă de un microb răspândit, mai degrabă decât de unul rar, este asociată cu această afecțiune.[9] Printre mecanismele propuse se numără ipoteza igienei și ipoteza prevalenței. Conform ipotezei igienei, expunerea la vârste mici la anumiți agenți infecțioși are un rol protector, boala fiind reacția la contactul la vârste mai mari cu respectivii agenți.[4] Ipoteza prevalenței presupune că boala este provocată de un agent infecțios mai frecvent în regiunile unde SM este mai frecventă, unde, în majoritatea cazurilor, produce o infecție permanentă asimptomatică. Demielinizarea apare doar în câteva cazuri, puține la număr, și după mulți ani.[9][31] Ipoteza igienei a beneficiat de mai multă susținere decât ipoteza prevalenței.[9]
În favoarea unei cauze virale există următoarele dovezi: prezența unor benzi oligoclonale în creierul și în lichidul cefalorahidian al majorității persoanelor cu SM, asocierea mai multor viruși cu demielinizarea la om encefalomielită, și apariția demielinizării la animale în urma unor infecții virale.[32] Virușii din categoria virusului herpetic uman sunt un potențial candidat. Persoanele care nu au suferit niciodată de o infecție cu virusul Epstein-Barr sunt expuse unui risc redus de a contracta SM, în timp ce persoanele infectate ca adulți tineri sunt expuse unui risc mai mare decât persoanele expuse la vârste mai mici.[4][9] Deși unii consideră că acest fapt contrazice ipoteza igienei, de vreme ce persoanele neinfectate au crescut probabil într-un mediu mai igienic,[9] alții consideră că nu există nicio contradicție, deoarece boala este declanșată de un prim contact cu virusul respectiv la o vârstă mai înaintată.[4] Printre alte boli posibil asociate se numără rujeola, oreionul și rubeola.[4]
Altele[modificare | modificare sursă]
S-a demonstrat că fumatul constituie un factor de risc independent pentru SM.[24] Stresul poate fi un factor de risc, deși dovezile în acest sens sunt neconcludente.[21] A fost evaluată asocierea cu expunerea și toxinele — în principal solvenți — de la locul de muncă, însă nu s-au obținut concluzii clare.[21] S-au studiat vaccinurile ca posibile cauze; totuși, majoritatea studiilor nu au relevat nicio asociere.[21] Au fost examinați și alți factori de risc posibili, de exemplu alimentația și aportul de hormoni; cu toate acestea, dovezile asocierii dintre acestea și boală sunt „rare și neconvingătoare”.[24] Guta apare mai rar decât ar fi de așteptat, și s-a constatat că persoanele cu SM au valori mai mici ale acidului uric. Aceste fapte au generat teoria conform căreia acidul uric are un rol protector, deși semnificația exactă a acidului uric rămâne necunoscută.[33]
Fiziopatologie[modificare | modificare sursă]
Cele trei caracteristici principale ale SM sunt apariția leziunilor (numite și plăci) în sistemul nervos central, inflamația și distrugerea tecii de mielină a neuronilor. Aceste caracteristici interacționează într-un mod complex și încă neînțeles pe deplin, producând distrugerea țesutului nervos, și prin urmare semnele și simptomele bolii.[4] În plus, se crede că SM este o afecțiune imuno-mediată care apare din cauza interacțiunii dintre caracteristicile genetice ale persoanei și factori de mediu încă neidentificați.[5] Se crede că deteriorarea este produsă în parte de faptul că propriul sistem imunitar al pacientului atacă sistemul nervos al acestuia.[4]
Leziuni[modificare | modificare sursă]

Denumirea de scleroză multiplă se referă la cicatricele (sclerele, mai bine cunoscute sub denumirea de plăci sau leziuni) care se formează în sistemul nervos. Aceste leziuni afectează cel mai frecvent substanța albă din nervul optic, trunchiul cerebral, nucleii bazali și măduva spinării, sau porțiunile de substanță albă aflate lângă ventriculii laterali.[4] Celulele din substanța albă au funcția de a transmite semnalele dintre porțiunile de substanță cenușie, unde se realizează procesarea, și restul corpului. Sistemul nervos periferic este rareori implicat.[5]
Specific, SM implică pierderea de oligodendrocite, celulele care creează și mențin un strat adipos — numit teacă de mielină — care ajută neuronii să transmită semnale electrice (potențiale de acțiune).[4] Consecința este subțierea sau dispariția completă a mielinei și, pe măsură ce boala progresează, distrugerea axonilor neuronali. În absența mielinei, neuronul nu mai poate transmite semnalele electrice.[5] Un proces de reparație, numit remielinizare, are loc în fazele incipiente ale bolii, însă oligodendrocitele nu pot să reconstituie integral teaca de mielină a celulei.[34] Crizele repetate duc la remielinizări din ce în ce mai deficitare, până când în jurul axonilor afectați se formează o placă asemănătoare unei cicatrice.[34] Aceste cicatrice sunt originea simptomelor; testele efectuate cu imagistică prin rezonanță magnetică (RMN) arată că în timpul unei crize se formează frecvent mai mult de zece noi plăci.[4] Acest fapt ar putea sugera că există un număr de leziuni până la care creierul se poate repara fără a produce consecințe vizibile.[4] Un alt proces implicat în apariția leziunilor este creșterea numărului de astrocite la valori anormale, din cauza distrugerii neuronilor învecinați.[4] Au fost descrise mai multe tipare ale leziunilor.[35]
Inflamație[modificare | modificare sursă]
În afară de demielinizare, celălalt semn al bolii este inflamația. În concordanță cu explicația imunologică, procesul inflamator este provocat de limfocitele T, un tip de limfocite care joacă un rol important în apărarea organismului.[5] Limfocitele T pătrund în creier prin breșele din bariera hematoencefalică. Celulele T recunosc mielina drept un corp străin și o atacă, fapt care explică de ce aceste celule se numesc și „limfocite autoreactive”.[4]
Atacul asupra mielinei declanșează procese inflamatoare care atrag acțiunea altor celule ale sistemului imunitar și eliberarea unor factori solubili cum sunt citokinele și anticorpii. Distrugerea progresivă a barierei hematoencefalice provoacă la rândul ei alte efecte nocive, cum ar fi edemațierea, activarea macrofagelor, activarea suplimentară a citokinelor și a altor proteine distructive.[5] Există cel puțin trei moduri în care inflamația poate reduce transmiterea informațiilor între neuroni.[4] Factorii solubili eliberați pot bloca neurotransmisia neuronilor intacți. Acești factori pot determina sau agrava distrugerea mielinei, sau pot duce la distrugerea completă a axonului.[4]
Bariera hematoencefalică face parte din sistemul de capilare care împiedică pătrunderea limfocitelor T în sistemul nervos central. Bariera poate deveni permeabilă pentru aceste tipuri de celule în urma infecției provocate de viruși sau bacterii. După ce bariera se reface, de obicei după eliminarea infecției, limfocitele T pot rămâne captive în creier.[5]
Diagnostic[modificare | modificare sursă]

De obicei, diagnosticul de scleroză multiplă se bazează pe semnele și simptomele acuzate, în combinație cu investigații realizate prin imagistică medicală și analize de laborator.[17] Diagnosticul poate fi dificil de confirmat, în special în primele stadii, deoarece semnele și simptomele pot fi asemănătoare cu cele ale altor maladii.[4][36] Criteriile McDonald, care se concentrează pe dovezile clinice, paraclinice și radiologice ale leziunilor la diverse intervale și în diverse zone, reprezintă cea mai frecventă metodă de diagnosticare;[11] criteriile Schumacher și criteriile Poser prezintă mai degrabă o semnificație istorică.[37] Deși criteriile de mai sus permit stabilirea diagnosticului prin metode neinvazive, unele persoane susțin că unica dovadă incontestabilă este autopsia sau biopsia zonelor în care sunt detectate leziunile tipice produse de scleroza multiplă.[4][38][39]
Datele clinice pot fi suficiente pentru diagnosticarea SM dacă pacientul a prezentat în trecut episoade de simptomatologie neurologică specifică bolii.[38] La persoanele care se prezintă la medic după un singur episod, sunt necesare teste suplimentare pentru stabilirea diagnosticului. Cele mai frecvent utilizate metode de diagnostic sunt neuroimagistica, analiza lichidului cefalorahidian și potențialele evocate. Explorarea creierului și a măduvei spinale prin imagistică prin rezonanță magnetică poate indica zonele demielinizate (leziuni sau plăci). Se poate administra gadoliniu intravenos ca substanță de contrast pentru a evidenția plăcile active și pentru a demonstra, prin eliminare, existența unor leziuni anterioare neasociate cu simptomele prezentate în momentul evaluării.[38][40] Examinarea lichidului cefalorahidian prelevat prin puncție lombară poate oferi dovezi ale existenței unei inflamații cronice în sistemul nervos central. Lichidul cefalorahidian este examinat pentru a se decela benzi oligoclonale de IgG la electroforeză, acestea fiind markeri ai inflamației prezenți la 75–85% din persoanele afectate de SM.[38][41] Este posibil ca sistemul nervos afectat de SM să aibă un răspuns mai puțin activ la stimularea nervului optic și a nervilor senzitivi din cauza demielinizării acestor traiecte nervoase. Reacțiile creierului pot fi examinate vizual și prin potențialele evocate senzitive.[42]
Evoluție clinică[modificare | modificare sursă]
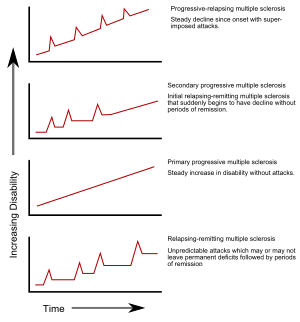
Au fost definite câteva subtipuri sau tipare de evoluție a sclerozei multiple. Aceste subtipuri se bazează pe evoluția anterioară a bolii, în încercarea de a anticipa cursul acesteia. Subtipurile sunt importante nu doar pentru stabilirea prognosticului, ci și în luarea deciziilor de tratament. În 1996, Societatea Națională de Scleroză Multiplă din Statele Unite a identificat patru forme clinice ale bolii:[7]
- recurent-remitentă,
- secundar progresivă,
- primar progresivă, și
- progresiv-recidivantă.
Forma recurent-remitentă se caracterizează prin atacuri recurente imprevizibile, urmate de luni sau ani de acalmie relativă (remisiune), fără semne clinice noi. Disfuncțiile care apar în timpul atacurilor pot dispărea sau pot genera probleme, situație valabilă în aproximativ 40% dintre cazuri, incidența fiind direct proporțională cu vechimea bolii.[4][17] Această evoluție a bolii este valabilă la 80% dintre pacienții cu SM.[4] Dacă disfuncțiile dispar după atacuri, boala este considerată SM benignă,[43] cu toate că, în timp, pacienții vor atinge un anumit grad de invaliditate.[4] Pe de altă parte, termenul scleroză multiplă malignă este folosit pentru a descrie pacienții cu SM care ating un grad ridicat de invaliditate într-o perioadă scurtă de timp.[44] Forma clinică recurent-remitentă debutează de regulă cu un sindrom clinic izolat (SCI). În cazul SCI, pacientul are un atac care indică un episod de demielinizare, dar care nu întrunește criteriile pentru stabilirea diagnosticului de scleroză multiplă.[4][45] 30-70% dintre pacienții cu SCI dezvoltă ulterior SM.[45]

SM secundar progresivă apare la aproximativ 65% dintre pacienții care au prezentat inițial forma recurent-remitentă a bolii și care au suferit o deteriorare neurologică progresivă între atacurile acute, fără perioade clare de remisiune.[4][7] Pot apărea totuși recidive ocazionale și remisiuni minore.[7] De regulă, perioada cuprinsă între debutul bolii și trecerea de la forma recurent-remitentă la forma secundar progresivă a bolii este de 19 ani.[46] Forma primar progresivă apare la 10–20% dintre pacienți, aceștia neprezentând niciun fel de remisiune după simptomele inițiale.[17][47] Acest subtip se caracterizează prin creșterea gradului de invaliditate chiar de la debutul bolii, fără niciun fel de remisiuni sau ameliorări ale stării de sănătate sau doar cu remisiuni și ameliorări ocazionale și nesemnificative.[7] Forma primar progresivă a bolii apare de regulă la o vârstă mai înaintată decât forma recurent-remitentă. Același lucru se întâmplă și în cazul formei secundar progresive care apare de regulă în jurul vârstei de 40 de ani.[4]
Scleroza multiplă progresiv-recidivantă apare la pacienții care, de la debutul bolii, prezintă o deteriorare neurologică constantă, însoțită de atacuri suprapuse. Această formă clinică este cel mai puțin frecventă.[7]
Au fost identificate și tipuri neobișnuite de SM; printre acestea se numără boala Devic, scleroza concentrică Balo, scleroza difuză Schilder și scleroza multiplă Marburg. Se discută încă dacă aceste boli reprezintă variante ale sclerozei multiple sau dacă sunt boli diferite.[48] Scleroza multiplă se manifestă diferit la copii, la care timpul necesar pentru a atinge nivelul progresiv al bolii este mai mare.[4] Cu toate acestea, copiii ajung la nivelul progresiv al SM la o vârstă medie mai mică decât ajung de regulă adulții.[4]
Abordare terapeutică[modificare | modificare sursă]
Deși în prezent nu se cunoaște niciun tratament etiologic pentru scleroza multiplă, există câteva terapii care și-au dovedit eficacitatea. Scopul principal al tratamentului constă în restabilirea funcțiilor după un atac, prevenirea altor atacuri și eliminarea formelor de invaliditate. Ca în cazul oricărui tratament medical, medicamentele folosite în abordarea terapeutică a sclerozei multiple au anumite efecte adverse. Există și pacienți care recurg la tratamente alternative, în ciuda faptului că nu există dovezi care să susțină eficiența acestora.
Atacuri acute[modificare | modificare sursă]
În timpul atacurilor simptomatice, tratamentul constă de regulă în administrarea intravenoasă de corticosteroizi, cum ar fi metilprednisolon,[4] corticosteroizii cu administrare orală prezentând aceeași eficiență și același nivel de siguranță.[49] Deși, de regulă, tratamentele cu corticosteroizi sunt eficiente pentru ameliorarea simptomelor pe termen scurt, acestea nu par să aibă un impact major în recuperarea pe termen lung.[50] Consecințele atacurilor grave, care nu răspund la corticosteroizi, ar putea fi tratate prin plasmafereză.[4]
Terapii de modificare a bolii[modificare | modificare sursă]
Scleroza multiplă recurent-remitentă[modificare | modificare sursă]
Autoritățile de reglementare au aprobat opt terapii de modificare a sclerozei multiple recurent-remitente (SMRR), care includ: interferon beta-1a, interferon beta-1b, glatiramer acetat, mitoxantronă, natalizumab, fingolimod,[51] teriflunomidă[52] și dimetil fumarat.[53] Rentabilitatea acestora la nivelul anului 2012 nu a fost stabilită.[54]
În cazul SMRR, eficiența acestor terapii în reducerea numărului atacurilor este una modestă.[51] Interferonul și glatiramer acetatul reprezintă tratamentul de elecție,[17] au efecte relativ similare și reduc recidivele cu aproximativ 30%.[55] Instituirea precoce a tratamentului de lungă durată influențează pozitiv evoluția bolii.[56][57] Natalizumabul reduce frecvența recidivelor mai mult decât medicamentele de elecție; cu toate acestea, din cauza efectelor sale adverse, natalizumabul rămâne un medicament de linia a doua, care se administrează doar pacienților care nu răspund la alte tratamente[17] sau care prezintă o formă gravă a bolii.[55] Mitoxantrona, a cărei utilizare este limitată din cauza efectelor sale secundare grave, reprezintă o opțiune de linia a treia pentru pacienții care nu răspund la alte medicamente.[17] Tratamentul sindromului clinic izolat (SCI) cu interferon reduce posibilitatea evoluției către SM.[4][58] Eficiența interferonului și a glatiramer acetatului la copii s-a dovedit comparabilă cu cea valabilă în cazul adulților.[59] Rolul anumitor medicamente mai noi, cum ar fi fingolimodul, teriflunomida și dimetil fumaratul nu era încă suficient de clar în 2011.[60]
Scleroza multiplă progresivă[modificare | modificare sursă]
Până în prezent, nu s-a putut dovedi că tratamentele existente pot schimba evoluția sclerozei multiple primar progresive,[17] iar în anul 2011 a fost aprobat un singur medicament, mitoxantrona, pentru scleroza multiplă secundar progresivă.[61] Datele provizorii referitoare la pacienții cărora li se administrează mitoxantronă indică o încetinire moderată a evoluției bolii și o scădere a frecvenței recidivelor în decurs de doi ani.[62][63]
Efecte adverse[modificare | modificare sursă]

Terapiile de modificare a bolii au și reacții adverse. Cea mai frecventă este iritarea locului de injectare a glatiramer acetatului și interferonului (până la 90% în cazul injecțiilor subcutanate și până la 33% în cazul injecțiilor intramusculare).[64] În timp, la locul injectării poate apărea o scobitură, ca urmare a distrugerii locale a țesutului gras, proces cunoscut sub numele de lipoatrofie.[64] Interferonul poate genera simptome similare gripei;[65] pacienții al căror tratament include glatiramer pot prezenta anumite reacții alergice după injectare, precum hiperemie facială, durere toracică, palpitații, dispnee și anxietate care, de regulă, nu durează mai mult de treizeci de minute.[66] Alte reacții adverse mai periculoase, dar mult mai puțin frecvente, includ: leziuni hepatice datorate interferonului,[67] disfuncție sistolică (12%), infertilitate, și leucemie mieloidă acută (0,8%) datorate mitoxantronei,[62][68] și leucoencefalopatie multifocală progresivă în cazul tratamentului cu natalizumab (incidența fiind de 1 la 600 dintre pacienții tratați).[17][69]
Fingolimodul poate cauza hipertensiune și bradicardie, edem macular, nivel ridicat al enzimelor hepatice sau scădere a numărului limfocitelor.[70] Datele provizorii demonstrează protecția pe termen scurt pe care o asigură teriflunomida, care include printre cele mai frecvente efecte secundare: cefaleea, starea de oboseală, starea de greață, căderea părului și dureri la nivelul membrelor.[51] Au fost raportate și cazuri de insuficiență renală și LMP, medicamentul fiind periculos pentru dezvoltarea fetală.[70] Cele mai frecvente efecte secundare ale dimetil fumaratului sunt hiperemia facială și tulburările gastrointestinale.[53][70] Deși dimetil fumaratul poate duce la o scădere a numărului de globule albe, nu s-au raportat cazuri de infecții oportuniste pe durata studiilor clinice.[71][72]
Simptome asociate[modificare | modificare sursă]
Atât medicația, cât și neuroreabilitarea s-au dovedit utile în ameliorarea simptomelor, deși niciuna dintre acestea nu schimbă evoluția bolii.[73] Anumite simptome, precum urinarea frecventă și spasticitatea, răspund bine la medicamente, în timp ce altele se ameliorează foarte puțin.[4] În ceea ce privește problemele neurologice, o abordare multidisciplinară este importantă pentru îmbunătățirea calității vieții; cu toate acestea, o echipă „de bază” este greu de stabilit întrucât, în timp, pot fi necesare diferite tipuri de servicii medicale.[4] Programele multidisciplinare de reabilitare cresc nivelul de activitate și implicare a pacienților cu SM, dar nu modifică gradul de invaliditate a acestora.[74] Există puține dovezi referitoare la eficacitatea generală a diferitelor discipline terapeutice,[75][75][76] deși s-a dovedit că anumite metode, precum exercițiile fizice[77][78] și psihoterapia, în special abordările cognitiv-comportamentale, sunt eficiente.[79]
Tratamente alternative[modificare | modificare sursă]
Peste 50% dintre pacienții cu SM apelează la medicina complementară și alternativă, deși procentajul variază în funcție de modul în care este definită medicina alternativă.[80] În cele mai multe dintre cazuri, dovezile privind eficiența acestor tratamente sunt puțin numeroase sau inexistente.[80][81] Deși datele provizorii curente indică faptul că vitamina D ar putea fi utilă, nu există suficiente dovezi pentru formularea unei concluzii certe.[82] Printre tratamentele fără beneficii dovedite la care recurg pacienții cu SM se numără și: suplimentele și regimurile alimentare,[80][83][84] tehnicile de relaxare, cum ar fi yoga,[80] medicina naturistă (inclusiv canabisul medicinal),[80][85] terapia cu oxigen hiperbaric,[86] autoinfestarea cu viermi paraziți, reflexologia și acupunctura.[80][87] Pacienții care recurg la acest tip de tratamente sunt mai frecvent femei, persoanele care suferă de SM de mai mult timp, au un grad de invaliditate mai crescut, și sunt nemulțumite de tratamentele convenționale.[80]
Prognostic[modificare | modificare sursă]

no data <13 13–16 16–19 19–22 22–25 25–28 | 28–31 31–34 34–37 37–40 40–43 >43 |
Evoluția preconizată a bolii depinde de subtipul acesteia; de sexul, vârsta și simptomele inițiale; și de gradul de invaliditate a persoanei în cauză.[10] Pacienții femei, subtipul recurent-remitent, nevrita optică sau simptomele senzoriale la debut, numărul redus de atacuri în primii ani de la instalarea bolii și, în special, debutul SM la o vârstă tânără sunt asociate cu o evoluție mai favorabilă.[10][88]
Speranța medie de viață este de 30 de ani de la debutul bolii, cu 5-10 ani mai scăzută decât în cazul persoanelor neafectate de boală.[4] Aproximativ 40% dintre persoanele cu SM ating vârsta de șaptezeci de ani.[88] Pe de altă parte însă, două treimi dintre decese se datorează consecințelor bolii.[4] Suicidul este destul de frecvent, în timp ce infecțiile și alte complicații sunt periculoase în special pentru pacienții cu un grad mai mare de invaliditate.[4] Deși majoritatea persoanelor afectate de boală își pierd capacitatea de a merge înainte de sfârșitul vieții, 90% dintre acestea se pot deplasa singure în primii 10 ani de la debutul bolii, iar 75% dintre acestea în primii 15 ani.[88][89]
După diagnosticul de SM, caracteristicile care prezic o evoluție mai proastă sunt sexul masculin, vârsta mai înaintată și o dizabilitate mai mare la momentul diagnosticului; sexul feminin este asociat cu o rată mai mare de recidivă.[90] Începând cu 2018, niciun biomarker nu poate prezice cu exactitate evoluția bolii la fiecare pacient.[91] Leziunile măduvei spinării, anomaliile la IRM și mai multă atrofie cerebrală sunt predictive pentru o evoluție mai proastă, deși atrofia cerebrală ca predictor al evoluției bolii este experimentală și nu este utilizată în practica clinică începând cu 2018.[90] Tratamentul precoce duce la un prognostic mai bun, dar o frecvență mai mare a recidivelor atunci când este tratată cu DMT-uri este asociată cu un prognostic mai slab.[91][92] Un studiu longitudinal al populației pe 60 de ani efectuat în Norvegia a constatat o speranță de viață cu 7 ani mai scurtă în SM în comparație cu populația generală și o creștere a supraviețuirii în SM în timpul perioadei de observație. Speranța de viață mediană pentru pacienții cu SMRR a fost de 77,8 ani și de 71,4 ani pentru SMPP, comparativ cu 81,8 ani pentru populația generală. Speranța de viață pentru bărbați a fost cu 5 ani mai mică decât pentru femei.[93]
Epidemiologie[modificare | modificare sursă]
În 2010, la nivel mondial, numărul persoanelor afectate de SM era de 2-2,5 milioane (aproximativ 30 per 100.000), numărul cazurilor variind foarte mult în funcție de zonă.[11][12] Se estimează că numărul deceselor cauzate de această boală în acel an a fost de 18.000.[94] În Africa, rata îmbolnăvirilor este mai mică de 0,5 per 100.000 de persoane, fiind de 2,8 per 100.000 de persoane în Asia de Sud-Est, 8,3 per 100.000 de persoane în cele două Americi, și de 80 per 100.000 de persoane în Europa.[11] Ratele înregistrate depășesc 200 per 100.000 de persoane în anumite populații de origine nord-europeană.[12] Anual, numărul cazurilor noi este de aproximativ 2,5 per 100.000 de persoane.[11]
Numărul îmbolnăvirilor de SM pare să crească, acest lucru putând fi însă explicat prin stabilirea mai corectă a diagnosticului.[12] Au fost efectuate numeroase studii privind categoriile de populație și contextul geografic,[31] care au condus la formularea mai multor teorii referitoare la cauzele acestei boli.[9][21][24]
Scleroza multiplă apare la persoanele adulte, după vârsta de douăzeci de ani sau după împlinirea vârstei de treizeci de ani, și mai puțin la copii sau după vârsta de 50 de ani.[11][12] Forma primar progresivă apare mai frecvent la persoanele care au împlinit cincizeci de ani.[47] Ca și în cazul altor afecțiuni autoimune, această boală apare mai frecvent la femei, tendința putând fi una ascendentă.[4][22] În 2008, la nivel global, boala era de două ori mai frecventă în cazul femeilor decât al bărbaților.[11] La copii, boala apare mai frecvent la fetițe decât la băieți,[4] în timp ce la persoanele de peste cincizeci de ani, boala apare în egală măsură și la femei și la bărbați.[47] In ceea ce ține de prognoza sclerozei multiple, aceasta depinde de tipul de evoluție, de starea de sănatate, dar și de genetic. 4/10 bolnavi de SM ajung și trec de 70 de ani, chiar dacă boala continuă să avanseze.[95]
Istoric[modificare | modificare sursă]
Descoperiri medicale[modificare | modificare sursă]

În 1868, neurologul francez Jean-Martin Charcot (1825–1893) a fost prima persoană care a considerat că scleroza multiplă este o boală de sine stătătoare.[96] Pe baza rapoartelor anterioare și a propriilor considerații clinice și patologice, Charcot a denumit boala scleroză în plăci. Cele trei semne de scleroză multiplă cunoscute în prezent ca triada Charcot sunt nistagmusul, tremorul de acțiune, și vorbirea sacadată (vorbire explozivă), deși acestea nu sunt specifice exclusiv pentru SM. Charcot a identificat totodată și apariția unor tulburări cognitive, și și-a descris pacienții ca având o „slăbire pronunțată a memoriei” și „dificultăți de percepție”.[13]
Înaintea lui Charcot, Robert Carswell (1793–1857), profesor britanic de patologie, și Jean Cruveilhier (1791–1873), profesor francez de anatomie patologică, au descris și ilustrat mai multe dintre manifestările clinice ale bolii, fără a o recunoaște însă ca pe o boală de sine stătătoare.[96] Mai clar, Carswell a descris leziunile descoperite ca „leziuni importante ale măduvei spinării, însoțite de atrofie".[4] Pe baza observațiilor la microscop, patologul elvețian Georg Eduard Rindfleisch (1836–1908) nota în 1863 că leziunile cauzate de inflamații erau distribuite în jurul vaselor de sânge.[97][98] În secolul al XX-lea, au fost formulate teorii referitoare la cauzele și patogeneza acestei boli, iar în 1990 au început să apară și tratamente eficiente.[4]
Cazuri istorice[modificare | modificare sursă]

Există mai multe relatări referitoare la persoane care au trăit înainte sau imediat după ce boala a fost descrisă de Charcot, și care au suferit probabil de scleroză multiplă.
O tânără numită Halldora, care a trăit în Islanda în jurul anului 1200, și-a pierdut brusc vederea și mobilitatea dar, în urma rugăciunilor, și-a revenit după șapte zile. Sfânta Lidwina din Schiedam (1380–1433), o călugăriță olandeză, poate fi considerată unul dintre primele cazuri certe ale bolii. De la vârsta de 16 ani și până la sfârșitul vieții sale, la vârsta de 53 de ani, ea a suferit de dureri intermitente, slăbiciune la nivelul membrelor inferioare și pierdere a vederii—simptome tipice ale sclerozei multiple.[99] Ambele cazuri au condus către ipoteza existenței unei „gene vikinge” responsabilă pentru răspândirea bolii.[100]
Este aproape sigur că Augustus Frederick d'Este (1794–1848), fiul Prințului Augustus Frederick, Duce de Sussex și al lui Lady Augusta Murray și nepot al regelui George al III-lea al Regatului Unit, a suferit de SM. D'Este a lăsat un jurnal detaliat în care descrie cei 22 de ani pe care i-a trăit cu această boală. Deși rămas necunoscut până în 1948, jurnalul începe în 1822 și se sfârșește în 1846. Simptomele lui D'Este au debutat cu o pierdere tranzitorie a vederii (amaurosis fugax), pe când acesta avea 28 de ani, după ce participase la înmormântarea unui prieten. Boala s-a manifestat prin slăbiciune la nivelul membrelor inferioare, scădere a sensibilității tactile, amorțeli, amețeli, tulburări urinare și disfuncție erectilă. În 1844, D'Este a început să folosească un scaun cu rotile. În ciuda bolii sale, el și-a păstrat o viziune optimistă asupra vieții.[101][102] O altă descriere timpurie a sclerozei multiple a fost oferită de diaristul britanic W. N. P. Barbellion, pseudonim al lui Bruce Frederick Cummings (1889–1919), care a ținut un jurnal detaliat al bolii de care suferea și al luptei sale cu aceasta.[102] Jurnalul său a fost publicat în 1919 sub titlul Jurnalul unui om dezamăgit.[103]
Cercetare[modificare | modificare sursă]
Medicație[modificare | modificare sursă]

Cercetările curente vizează identificarea unor tratamente mai eficiente și mai ușor de administrat și de tolerat pentru SM recurent-remitentă; identificarea unor tratamente pentru subtipurile progresive; crearea unor strategii de neuroprotecție; și identificarea unor tratamente simptomatice eficiente.[104]
În anii 2000 și 2010 au fost aprobate câteva medicamente cu administrare orală a căror popularitate și frecvență de utilizare se așteaptă să crească.[105] În prezent, se află în stadiu de cercetare și alte medicamente cu administrare orală, unul dintre acestea fiind laquinimod, anunțat în august 2012, și aflat în faza a III-a de studiu, după rezultatele neconcludente obținute în fazele anterioare.[106] În același timp, se desfășoară studii care vizează creșterea eficacității tratamentelor deja existente și facilitarea administrării acestora. Sunt incluse aici medicamente noi precum interferon-β-1a pegilat, care se speră să poată fi administrat la intervale mai mari de timp, dar cu efecte similare.[107][108] Se așteaptă ca peginterferonul beta-1a să fie aprobat în 2013.[108]
Anticorpii monoclonali au suscitat și ei un interes deosebit. Anticorpii monoclonali alemtuzumab, daclizumab și CD20, precum rituximab, ocrelizumab și ofatumumab s-au dovedit a avea anumite avantaje și se află în stadiu de cercetare ca tratamente potențiale.[72] Utilizarea lor a fost însoțită însă și de efecte secundare potențial periculoase, în special infecții oportuniste.[105] Acestor cercetări li se adaugă și cele care vizează crearea unui test pentru anticorpii anti-virusului JC, care ar putea ajuta la identificarea pacienților care prezintă un risc mai mare de a se îmbolnăvi de leucoencefalopatie multifocală progresivă atunci când li se administrează natalizumab.[105] Deși este posibil ca anticorpii monoclonali să joace în viitor un anumit rol în tratamentul bolii, se crede că utilizarea acestora va fi una redusă, din cauza riscurilor asociate.[105]
O altă strategie de cercetare constă în evaluarea eficienței combinate a două sau mai multe medicamente.[109] Principalul motiv pentru utilizarea mai multor medicamente în cazul sclerozei multiple este acela că tratamentele în cauză vizează mecanisme diferite și, astfel, nu se exclud reciproc.[109] Sinergiile, situațiile în care un medicament potențează efectul unui alt medicament, sunt și ele posibile, dar acestea pot prezenta și dezavantaje, cum ar fi blocarea reciprocă a acțiunii medicamentelor administrate sau efecte secundare mai pronunțate.[109] Există studii clinice pentru terapia combinată, dar niciunul dintre acestea nu a indicat suficiente rezultate pozitive pentru a fi considerat un tratament eficient pentru SM.[109]
Cercetările privind neuroprotecția și tratamentele regenerative, precum terapia cu celule stem, deși extrem de importante, se află în stadii incipiente.[110] În același timp, nici pentru formele progresive ale bolii nu există tratamente eficiente. Multe dintre medicamentele cele mai recente, precum și cele la care se lucrează în prezent vor fi probabil evaluate ca tratamente pentru scleroza multiplă primar progresivă (SMPP) sau scleroza multiplă secundar progresivă (SMSP).[105]
Biomarkeri ai bolii[modificare | modificare sursă]

Deși criteriile de diagnostic nu se vor schimba în viitorul apropiat, în prezent se depun eforturi pentru descoperirea unor biomarkeri care să ajute la stabilirea diagnosticului și la anticiparea evoluției bolii.[105] Noile metode de diagnostic aflate în curs de cercetare includ studii cu anticorpi anti-mielină, cu ser și lichid cefalorahidian, dar niciunul dintre acestea nu a oferit rezultate pozitive certe.[112]
La ora actuală nu există investigații de laborator care să poată anticipa evoluția bolii. Au fost propuse câteva soluții care oferă speranțe, cum ar fi: interleukina-6, oxidul de azot și sintaza oxidului de azot, osteopontinul, și fetuina-A.[112] Întrucât evoluția SM se datorează degenerării neuronilor, rolul proteinelor care indică o pierdere a țesutului nervos, cum ar fi neurofilamentele, proteina tau și N-acetil aspartatul, se află în curs de cercetare.[112] În același timp, se încearcă identificarea unor biomarkeri care să diferențieze pacienții care vor răspunde la tratament de cei care nu vor răspunde la tratament.[112]
Se speră că îmbunătățirea tehnicilor de neuroimagistică, cum ar fi tomografia cu emisie de pozitroni (TEP) sau imagistica prin rezonanță magnetică (IRM), va facilita stabilirea diagnosticului și a evoluției bolii, deși efectele acestei îmbunătățiri în practica medicală de zi cu zi ar putea necesita decenii până să se concretizeze.[105] Există anumite tehnici IRM care și-au dovedit utilitatea în cadrul cercetărilor întreprinse și care ar putea fi incluse în practica clinică; printre acestea se numără IRM cu secvențe inversie dublă-revenire, IRM prin transfer de magnetizație, IRM prin tensor de difuzie, și imagistica prin rezonanță magnetică funcțională.[113] Comparativ cu tehnicile existente, aceste tehnici sunt concepute în mod specific pentru această boală, dar sunt lipsite încă de o anumită standardizare a protocoalelor de achiziție și în crearea valorilor normative.[113] În prezent se lucrează și la alte tehnici, printre acestea numărându-se și cele cu agenți de contrast, capabili să măsoare nivelurile macrofagelor periferice, ale inflamației sau ale disfuncției neuronale,[113] dar și tehnici care măsoară depunerile de fier, și care pot contribui la stabilirea rolului acestora în evoluția bolii sau în perfuzia cerebrală.[113] În același timp, noii radiotrasatori PET pot servi ca markeri ai proceselor modificate, precum inflamația creierului, patologia corticală, apoptoza sau remielinizarea.[114]
Insuficiența venoasă cronică cerebrospinală[modificare | modificare sursă]
În 2008, chirurgul vascular Paolo Zamboni a susținut că scleroza multiplă implică un proces de îngustare a vaselor care irigă creierul, proces pe care l-a denumit insuficiență venoasă cronică cerebrospinală (CCSVI). Zamboni a descoperit că toți pacienții cu SM incluși în studiul său prezentau CCSVI, i-a supus unei intervenții chirurgicale pentru a remedia problema, intervenție denumită ulterior în media „procedură de eliberare”, și a afirmat că 73% dintre pacienții respectivi au cunoscut o ameliorare a stării de sănătate.[115] Această teorie s-a bucurat de o atenție specială în media și în rândul pacienților care sufereau de SM, în special în Canada.[116] Cercetările lui Zamboni au ridicat semne de întrebare întrucât studiile clinice realizate nu au fost nici studii oarbe și nici studii controlate, ipotezele referitoare la factorii declanșatori ai bolii nefiind susținute de date confirmate.[117] În același timp, studiile ulterioare nu au identificat o relație similară între SM și CCSVI sau au identificat o relație nu la fel de evidentă între acestea,[118] astfel că ipoteza lui Zamboni a ridicat obiecții serioase.[119] „Procedura de eliberare” a fost criticată datorită faptului că a generat complicații grave și decesul pacienților, fără a avea niciun fel de beneficii dovedite.[117] În anul 2013, această abordare nu este recomandată în tratamentul sclerozei multiple.[120] În prezent, se desfășoară cercetări suplimentare privind ipoteza CCSVI.[121]
Vezi și[modificare | modificare sursă]
Note[modificare | modificare sursă]
- ^ Cross-network coupling of neural oscillations in the dynamic pain connectome reflects chronic neuropathic pain in multiple sclerosis[*] Verificați valoarea
|titlelink=(ajutor) - ^ Disease Ontology, accesat în
- ^ Monarch Disease Ontology release 2018-06-29[*] Verificați valoarea
|titlelink=(ajutor); - ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be Compston A, Coles A (). „Multiple sclerosis”. Lancet. 372 (9648): 1502–17. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977.
- ^ a b c d e f g h i j k l m Compston A, Coles A (). „Multiple sclerosis”. Lancet. 359 (9313): 1221–31. doi:10.1016/S0140-6736(02)08220-X. PMID 11955556.
- ^ Murray ED, Buttner EA, Price BH (). „Depression and Psychosis in Neurological Practice”. În Daroff R, Fenichel G, Jankovic J, Mazziotta J. Bradley's neurology in clinical practice (ed. 6th ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 1-4377-0434-4.
- ^ a b c d e f g h Lublin FD, Reingold SC; National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis (). „Defining the clinical course of multiple sclerosis: results of an international survey”. Neurology. 46 (4): 907–11. doi:10.1212/WNL.46.4.907. PMID 8780061.
- ^ Nakahara, J (2012 Feb). „Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy”. Clinical reviews in allergy & immunology. 42 (1): 26–34. PMID 22189514. Verificați datele pentru:
|date=(ajutor) - ^ a b c d e f g h Ascherio A, Munger KL (). „Environmental risk factors for multiple sclerosis. Part I: the role of infection”. Ann. Neurol. 61 (4): 288–99. doi:10.1002/ana.21117. PMID 17444504.
- ^ a b c Weinshenker BG (). „Natural history of multiple sclerosis”. Ann. Neurol. 36 (Suppl): S6–11. doi:10.1002/ana.410360704. PMID 8017890.
- ^ a b c d e f g World Health Organization (). Atlas: Multiple Sclerosis Resources in the World 2008 (PDF). Geneva: World Health Organization. pp. 15–16. ISBN 92-4-156375-3.
- ^ a b c d e f g h i j k l m Milo R, Kahana E (). „Multiple sclerosis: geoepidemiology, genetics and the environment”. Autoimmun Rev. 9 (5): A387–94. doi:10.1016/j.autrev.2009.11.010. PMID 19932200.
- ^ a b c Clanet M (). „Jean-Martin Charcot. 1825 to 1893” (PDF). Int MS J. 15 (2): 59–61. PMID 18782501.
* Charcot, J. (). „Histologie de la sclerose en plaques”. Gazette des hopitaux, Paris. 41: 554–5. - ^ Kurtzke JF (). „Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)”. Neurology. 33 (11): 1444–52. doi:10.1212/WNL.33.11.1444. PMID 6685237.
- ^ Amato MP, Ponziani G (). „Quantification of impairment in MS: discussion of the scales in use”. Mult. Scler. 5 (4): 216–9. PMID 10467378.
- ^ Rudick RA, Cutter G, Reingold S (). „The multiple sclerosis functional composite: a new clinical outcome measure for multiple sclerosis trials”. Mult. Scler. 8 (5): 359–65. PMID 12356200.
- ^ a b c d e f g h i Tsang, BK (2011 Dec). „Multiple sclerosis- diagnosis, management and prognosis”. Australian family physician. 40 (12): 948–55. PMID 22146321. Verificați datele pentru:
|date=(ajutor) - ^ a b Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (). „Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis”. Neuroepidemiology. 27 (1): 28–32. doi:10.1159/000094233. PMID 16804331.
- ^ Heesen C, Mohr DC, Huitinga I; et al. (). „Stress regulation in multiple sclerosis: current issues and concepts”. Mult. Scler. 13 (2): 143–8. doi:10.1177/1352458506070772. PMID 17439878.
- ^ Martinelli V (). „Trauma, stress and multiple sclerosis”. Neurol. Sci. 21 (4 Suppl 2): S849–52. doi:10.1007/s100720070024. PMID 11205361.
- ^ a b c d e f Marrie RA (). „Environmental risk factors in multiple sclerosis aetiology”. Lancet Neurol. 3 (12): 709–18. doi:10.1016/S1474-4422(04)00933-0. PMID 15556803.
- ^ a b c Alonso A, Hernán MA (). „Temporal trends in the incidence of multiple sclerosis: a systematic review”. Neurology. 71 (2): 129–35. doi:10.1212/01.wnl.0000316802.35974.34. PMID 18606967.
- ^ a b Pugliatti M, Sotgiu S, Rosati G (). „The worldwide prevalence of multiple sclerosis”. Clin Neurol Neurosurg. 104 (3): 182–91. PMID 12127652.
- ^ a b c d Ascherio A, Munger KL (). „Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors”. Ann. Neurol. 61 (6): 504–13. doi:10.1002/ana.21141. PMID 17492755.
- ^ Ascherio A, Munger KL, Simon KC (). „Vitamin D and multiple sclerosis”. Lancet Neurol. 9 (6): 599–612. doi:10.1016/S1474-4422(10)70086-7. PMID 20494325.
- ^ Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (). „Vitamin D: an evidence-based review”. J Am Board Fam Med. 22 (6): 698–706. doi:10.3122/jabfm.2009.06.090037. PMID 19897699.
- ^ Dyment DA, Ebers GC, Sadovnick AD (). „Genetics of multiple sclerosis”. Lancet Neurol. 3 (92): 104–10. doi:10.1016/S1474-4422(03)00663-X. PMID 14747002.
- ^ Hassan-Smith, G (2011 Oct). „Epidemiology and diagnosis of multiple sclerosis”. British journal of hospital medicine (London, England : 2005). 72 (10): M146–51. PMID 22041658. Verificați datele pentru:
|date=(ajutor) - ^ Rosati G (). „The prevalence of multiple sclerosis in the world: an update”. Neurol. Sci. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614.
- ^ a b c d Baranzini SE (). „Revealing the genetic basis of multiple sclerosis: are we there yet?”. Curr. Opin. Genet. Dev. 21 (3): 317–24. doi:10.1016/j.gde.2010.12.006. PMC 3105160
 . PMID 21247752.
. PMID 21247752.
- ^ a b Kurtzke JF (). „Epidemiologic evidence for multiple sclerosis as an infection”. Clin. Microbiol. Rev. 6 (4): 382–427. doi:10.1128/CMR.6.4.382. PMC 358295
 . PMID 8269393.
. PMID 8269393.
- ^ Gilden DH (). „Infectious causes of multiple sclerosis”. The Lancet Neurology. 4 (3): 195–202. doi:10.1016/S1474-4422(05)01017-3. PMID 15721830.
- ^ Spitsin S, Koprowski H (). „Role of uric acid in multiple sclerosis”. Curr. Top. Microbiol. Immunol. 318: 325–42. PMID 18219824.
- ^ a b Chari DM (). „Remyelination in multiple sclerosis”. Int. Rev. Neurobiol. 79: 589–620. doi:10.1016/S0074-7742(07)79026-8. PMID 17531860.
- ^ Pittock SJ, Lucchinetti CF (). „The pathology of MS: new insights and potential clinical applications”. Neurologist. 13 (2): 45–56. doi:10.1097/01.nrl.0000253065.31662.37. PMID 17351524.
- ^ Trojano M, Paolicelli D (). „The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes”. Neurol. Sci. 22 (Suppl 2): S98–102. doi:10.1007/s100720100044. PMID 11794488.
- ^ Poser CM, Brinar VV (). „Diagnostic criteria for multiple sclerosis: an historical review”. Clin Neurol Neurosurg. 106 (3): 147–58. doi:10.1016/j.clineuro.2004.02.004. PMID 15177763.
- ^ a b c d McDonald WI, Compston A, Edan G; et al. (). „Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis”. Ann. Neurol. 50 (1): 121–7. doi:10.1002/ana.1032. PMID 11456302.
- ^ Polman CH, Reingold SC, Edan G; et al. (). „Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria"”. Ann. Neurol. 58 (6): 840–6. doi:10.1002/ana.20703. PMID 16283615.
- ^ Rashid W, Miller DH (). „Recent advances in neuroimaging of multiple sclerosis”. Semin Neurol. 28 (1): 46–55. doi:10.1055/s-2007-1019127. PMID 18256986.
- ^ Link H, Huang YM (). „Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness”. J. Neuroimmunol. 180 (1–2): 17–28. doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427.
- ^ Gronseth GS, Ashman EJ (). „Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology”. Neurology. 54 (9): 1720–5. doi:10.1212/WNL.54.9.1720. PMID 10802774.
- ^ Pittock SJ, Rodriguez M (). „Benign multiple sclerosis: a distinct clinical entity with therapeutic implications”. Curr. Top. Microbiol. Immunol. 318: 1–17. doi:10.1007/978-3-540-73677-6_1. PMID 18219812.
- ^ Feinstein, A (). The clinical neuropsychiatry of multiple sclerosis (ed. 2nd ed.). Cambridge: Cambridge University Press. p. 20. ISBN 052185234X.
- ^ a b Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (). „Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis”. Lancet Neurol. 4 (5): 281–8. doi:10.1016/S1474-4422(05)70071-5. PMID 15847841.
- ^ Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (). „Secondary progressive multiple sclerosis: current knowledge and future challenges”. Lancet Neurol. 5 (4): 343–54. doi:10.1016/S1474-4422(06)70410-0. PMID 16545751.
- ^ a b c Miller DH, Leary SM (). „Primary-progressive multiple sclerosis”. Lancet Neurol. 6 (10): 903–12. doi:10.1016/S1474-4422(07)70243-0. PMID 17884680.
- ^ Stadelmann C, Brück W (). „Lessons from the neuropathology of atypical forms of multiple sclerosis”. Neurol. Sci. 25 (Suppl 4): S319–22. doi:10.1007/s10072-004-0333-1. PMID 15727225.
- ^ Format:Cite cochrane
- ^ Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care (pdf). London: Royal College of Physicians. . pp. 54–57. ISBN 1-86016-182-0. PMID 21290636. Accesat în .
|first1=lipsă|last1=în Authors list (ajutor) - ^ a b c He, D (2012 Dec 12). Zhou, Hongyu, ed. „Teriflunomide for multiple sclerosis”. Cochrane database of systematic reviews (Online). 12: CD009882. doi:10.1002/14651858.CD009882.pub2. PMID 23235682. Verificați datele pentru:
|date=(ajutor) - ^ „FDA approves new multiple sclerosis treatment Aubagio” (Press release). US FDA. . Accesat în .
- ^ a b „Biogen Idec's TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis” (Press release). Biogen Idec. . Arhivat din original la . Accesat în .
- ^ Manouchehrinia, A (2012 Oct). „Cost-effectiveness of disease-modifying therapies in multiple sclerosis”. Current neurology and neuroscience reports. 12 (5): 592–600. PMID 22782520. Verificați datele pentru:
|date=(ajutor) - ^ a b Hassan-Smith, G (2011 Nov). „Management and prognosis of multiple sclerosis”. British journal of hospital medicine (London, England : 2005). 72 (11): M174–6. PMID 22082979. Verificați datele pentru:
|date=(ajutor) - ^ Freedman MS (). „Long-term follow-up of clinical trials of multiple sclerosis therapies”. Neurology. 76 (1 Suppl 1): S26–34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679.
- ^ Qizilbash N, Mendez I, Sanchez-de la Rosa R (). „Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis”. Clin Ther. 34 (1): 159–176.e5. doi:10.1016/j.clinthera.2011.12.006. PMID 22284996.
- ^ Bates D (). „Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials”. Neurology. 76 (1 Suppl 1): S14–25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678.
- ^ Johnston J, So TY (). „First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview”. Drugs. 72 (9): 1195–211. doi:10.2165/11634010-000000000-00000. PMID 22642799.
- ^ Killestein J, Rudick RA, Polman CH (). „Oral treatment for multiple sclerosis”. Lancet Neurol. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
- ^ Kellerman, Rick D.; Edward N. Hanley Jr MD (). Conn's Current Therapy 2012: Expert Consult - Online and Print. Philadelphia: Saunders. p. 627. ISBN 1-4557-0738-4.
- ^ a b Martinelli Boneschi, F (2013 May 31). „Mitoxantrone for multiple sclerosis”. Cochrane database of systematic reviews (Online). 5: CD002127. PMID 23728638. Verificați datele pentru:
|date=(ajutor) - ^ Marriott, JJ (2010 May 4). „Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology”. Neurology. 74 (18): 1463–70. PMID 20439849. Verificați datele pentru:
|date=(ajutor) - ^ a b Balak, DM (2012 Dec). „Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review”. Multiple sclerosis (Houndmills, Basingstoke, England). 18 (12): 1705–17. PMID 22371220. Verificați datele pentru:
|date=(ajutor) - ^ Sládková T, Kostolanský F (). „The role of cytokines in the immune response to influenza A virus infection”. Acta Virol. 50 (3): 151–62. PMID 17131933.
- ^ Munari L, Lovati R, Boiko A (). Munari, Luca M., ed. „Therapy with glatiramer acetate for multiple sclerosis”. Cochrane database of systematic reviews (Online) (1): CD004678. doi:10.1002/14651858.CD004678. PMID 14974077.
- ^ Tremlett H, Oger J (). „Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis”. J. Neurol. 251 (11): 1297–303. doi:10.1007/s00415-004-0619-5. PMID 15592724.
- ^ Comi G (). „Treatment of multiple sclerosis: role of natalizumab”. Neurol. Sci. 30. Suppl 2 (S2): S155–8. doi:10.1007/s10072-009-0147-2. PMID 19882365.
- ^ Hunt, D (2012 Feb). „Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring”. Practical neurology. 12 (1): 25–35. PMID 22258169. Verificați datele pentru:
|date=(ajutor) - ^ a b c Killestein J, Rudick RA, Polman CH (). „Oral treatment for multiple sclerosis”. Lancet Neurol. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
- ^ „NDA 204063 - FDA Approved Labeling Text” (PDF). US Food and Drug Agency. . Accesat în .
„NDA Approval” (PDF). US Food and Drug Agency. . Accesat în . - ^ a b Saidha S, Eckstein C, Calabresi PA (). „New and emerging disease modifying therapies for multiple sclerosis”. Ann. N. Y. Acad. Sci. 1247: 117–37. doi:10.1111/j.1749-6632.2011.06272.x. PMID 22224673.
- ^ Kesselring J, Beer S (). „Symptomatic therapy and neurorehabilitation in multiple sclerosis”. Lancet Neurol. 4 (10): 643–52. doi:10.1016/S1474-4422(05)70193-9. PMID 16168933.
- ^ Khan F, Turner-Stokes L, Ng L, Kilpatrick T (). Khan, Fary, ed. „Multidisciplinary rehabilitation for adults with multiple sclerosis”. Cochrane Database Syst Rev (2): CD006036. doi:10.1002/14651858.CD006036.pub2. PMID 17443610.
- ^ a b Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (). „Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews”. Clinical rehabilitation. 19 (3): 247–54. doi:10.1191/0269215505cr870oa. PMID 15859525.
- ^ Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (). Steultjens, Esther EMJ, ed. „Occupational therapy for multiple sclerosis”. Cochrane database of systematic reviews (Online) (3): CD003608. doi:10.1002/14651858.CD003608. PMID 12917976.
- ^ Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A (). „Physical training and multiple sclerosis”. Ann Readapt Med Phys. 50 (6): 373–6, 369–72. doi:10.1016/j.annrmp.2007.04.004. PMID 17482708.
- ^ Rietberg MB, Brooks D, Uitdehaag BMJ, Kwakkel G (). Kwakkel, Gert, ed. „Exercise therapy for multiple sclerosis”. Cochrane Database of Systematic Reviews (1): CD003980. doi:10.1002/14651858.CD003980.pub2. PMID 15674920.
- ^ Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (). Thomas, Peter W, ed. „Psychological interventions for multiple sclerosis”. Cochrane Database of Systematic Reviews (1): CD004431. doi:10.1002/14651858.CD004431.pub2. PMID 16437487.
- ^ a b c d e f g Huntley A (). „A review of the evidence for efficacy of complementary and alternative medicines in MS”. Int MS J. 13 (1): 5–12, 4. PMID 16420779.
- ^ Olsen SA (). „A review of complementary and alternative medicine (CAM) by people with multiple sclerosis”. Occup Ther Int. 16 (1): 57–70. doi:10.1002/oti.266. PMID 19222053.
- ^ Jagannath, VA (2010 Dec 8). „Vitamin D for the management of multiple sclerosis”. Cochrane database of systematic reviews (Online) (12): CD008422. PMID 21154396. Verificați datele pentru:
|date=(ajutor) - ^ Farinotti M, Simi S, Di Pietrantonj C; et al. (). Farinotti, Mariangela, ed. „Dietary interventions for multiple sclerosis”. Cochrane database of systematic reviews (Online) (1): CD004192. doi:10.1002/14651858.CD004192.pub2. PMID 17253500.
- ^ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M. (). „N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis”. J Biol Chem. doi:10.1074/jbc.M111.277814. Epub 2011 Sep 29. Verificați valoarea
|doi=(ajutor). PMID 21965673. - ^ Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (). „Cannabis use in patients with multiple sclerosis”. Mult. Scler. 12 (5): 646–51. doi:10.1177/1352458506070947. PMID 17086912.
- ^ Bennett M, Heard R (). Bennett, Michael H, ed. „Hyperbaric oxygen therapy for multiple sclerosis”. Cochrane database of systematic reviews (Online) (1): CD003057. doi:10.1002/14651858.CD003057.pub2. PMID 14974004.
- ^ Adams, Tim (). „Gut instinct: the miracle of the parasitic hookworm”. The Observer.
- ^ a b c Phadke JG (). „Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland”. J. Neurol. Neurosurg. Psychiatr. 50 (5): 523–31. doi:10.1136/jnnp.50.5.523. PMC 1031962
 . PMID 3495637.
. PMID 3495637.
- ^ Myhr KM, Riise T, Vedeler C; et al. (). „Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension”. Mult. Scler. 7 (1): 59–65. PMID 11321195.
- ^ a b Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O (aprilie 2018). „Multiple sclerosis”. Lancet. 391 (10130): 1622–1636. doi:10.1016/S0140-6736(18)30481-1. PMID 29576504.
- ^ a b Oh J, Vidal-Jordana A, Montalban X (decembrie 2018). „Multiple sclerosis: clinical aspects”. Curr Opin Neurol. 31 (6): 752–759. doi:10.1097/WCO.0000000000000622. PMID 30300239.
- ^ „Mesenchymal Stem Cells for the Treatment of MS”. Accesat în .
- ^ Lunde HM, Assmus J, Myhr KM, Bø L, Grytten N (august 2017). „Survival and cause of death in multiple sclerosis: a 60-year longitudinal population study”. Journal of Neurology, Neurosurgery, and Psychiatry. 88 (8): 621–625. doi:10.1136/jnnp-2016-315238. PMC 5537547
 . PMID 28365589.
. PMID 28365589.
- ^ Lozano, R (2012 Dec 15). „Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010”. Lancet. 380 (9859): 2095–128. PMID 23245604. Verificați datele pentru:
|date=(ajutor) - ^ Scleroza multipla, 26 aprilie 2014, Demoiselle.ro, accesat la 26 aprilie 2014
- ^ a b Compston A (). „The 150th anniversary of the first depiction of the lesions of multiple sclerosis”. J. Neurol. Neurosurg. Psychiatr. 51 (10): 1249–52. doi:10.1136/jnnp.51.10.1249. PMC 1032909
 . PMID 3066846.
. PMID 3066846.
- ^ Lassmann H (). „The pathology of multiple sclerosis and its evolution”. Philos. Trans. R. Soc. Lond., B, Biol. Sci. 354 (1390): 1635–40. doi:10.1098/rstb.1999.0508. PMC 1692680
 . PMID 10603616.
. PMID 10603616.
- ^ Lassmann H (iulie 2005). „Multiple sclerosis pathology: evolution of pathogenetic concepts”. Brain Pathology. 15 (3): 217–22. doi:10.1111/j.1750-3639.2005.tb00523.x. PMID 16196388.
- ^ Medaer R (). „Does the history of multiple sclerosis go back as far as the 14th century?”. Acta Neurol. Scand. 60 (3): 189–92. doi:10.1111/j.1600-0447.1979.tb08970.x. PMID 390966.
- ^ Holmøy T (). „A Norse contribution to the history of neurological diseases”. Eur. Neurol. 55 (1): 57–8. doi:10.1159/000091431. PMID 16479124.
- ^ Firth, D (). The Case of August D`Esté. Cambridge: Cambridge University Press.
- ^ a b Pearce JM (). „Historical descriptions of multiple sclerosis”. Eur. Neurol. 54 (1): 49–53. doi:10.1159/000087387. PMID 16103678.
- ^ Barbellion, Wilhelm Nero Pilate (). The Journal of a Disappointed Man. New York: George H. Doran. ISBN 0-7012-1906-8.
- ^ Cohen JA (). „Emerging therapies for relapsing multiple sclerosis”. Arch. Neurol. 66 (7): 821–8. doi:10.1001/archneurol.2009.104. PMID 19597083.
- ^ a b c d e f g Miller AE (). „Multiple sclerosis: where will we be in 2020?”. Mt. Sinai J. Med. 78 (2): 268–79. doi:10.1002/msj.20242. PMID 21425270.
- ^ Jeffrey, susan (09 Aug 2012). „CONCERTO: A Third Phase 3 Trial for Laquinimod in MS”. Medscape Medical News. Accesat în 21 May 2013. Verificați datele pentru:
|date=(ajutor) - ^ Kieseier BC, Calabresi PA (). „PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis”. CNS Drugs. 26 (3): 205–14. doi:10.2165/11596970-000000000-00000. PMID 22201341.
- ^ a b „Biogen Idec Announces Positive Top-Line Results from Phase 3 Study of Peginterferon Beta-1a in Multiple Sclerosis” (Press release). Biogen Idec. . Arhivat din original la . Accesat în .
- ^ a b c d Milo R, Panitch H (). „Combination therapy in multiple sclerosis”. J. Neuroimmunol. 231 (1-2): 23–31. doi:10.1016/j.jneuroim.2010.10.021. PMID 21111490.
- ^ Luessi F, Siffrin V, Zipp F (). „Neurodegeneration in multiple sclerosis: novel treatment strategies”. Expert Rev Neurother. 12 (9): 1061–76; quiz 1077. doi:10.1586/ern.12.59. PMID 23039386.
- ^ Mehta V, Pei W, Yang G; et al. (). „Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions”. PLoS ONE. 8 (3): e57573. doi:10.1371/journal.pone.0057573. PMC 3597727
 . PMID 23516409.
. PMID 23516409.
- ^ a b c d Harris VK, Sadiq SA (). „Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making”. Mol Diagn Ther. 13 (4): 225–44. doi:10.2165/11313470-000000000-00000. PMID 19712003.
- ^ a b c d Filippi M, Rocca MA, De Stefano N; et al. (). „Magnetic resonance techniques in multiple sclerosis: the present and the future”. Arch. Neurol. 68 (12): 1514–20. doi:10.1001/archneurol.2011.914. PMID 22159052.
- ^ Kiferle L, Politis M, Muraro PA, Piccini P (). „Positron emission tomography imaging in multiple sclerosis-current status and future applications”. Eur. J. Neurol. 18 (2): 226–31. doi:10.1111/j.1468-1331.2010.03154.x. PMID 20636368.
- ^ Zamboni P, Galeotti R, Menegatti E; et al. (aprilie 2009). „Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis”. J. Neurol. Neurosurg. Psychiatr. 80 (4): 392–9. doi:10.1136/jnnp.2008.157164. PMC 2647682
 . PMID 19060024.
. PMID 19060024.
- ^ Pullman D, Zarzeczny A, Picard A (). „Media, politics and science policy: MS and evidence from the CCSVI Trenches”. BMC Med Ethics. 14: 6. doi:10.1186/1472-6939-14-6. PMC 3575396
 . PMID 23402260.
. PMID 23402260.
- ^ a b Qiu J (). „Venous abnormalities and multiple sclerosis: another breakthrough claim?”. Lancet Neurol. 9 (5): 464–5. doi:10.1016/S1474-4422(10)70098-3. PMID 20398855.
- ^ Ghezzi A, Comi G, Federico A (). „Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis”. Neurol. Sci. 32 (1): 17–21. doi:10.1007/s10072-010-0458-3. PMID 21161309.
- ^ Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW. (octombrie 2010). „Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis”. J NeuroIntervent Surg. 2 (4): 309–311. doi:10.1136/jnis.2010.003947. PMID 21990639.
- ^ Baracchini C, Atzori M, Gallo P (). „CCSVI and MS: no meaning, no fact”. Neurol. Sci. 34 (3): 269–79. doi:10.1007/s10072-012-1101-2. PMID 22569567.
- ^ van Zuuren, EJ (2012 Dec 12). „Percutaneous transluminal angioplasty for treatment of chronic cerebrospinal venous insufficiency (CCSVI) in multiple sclerosis patients”. Cochrane database of systematic reviews (Online). 12: CD009903. PMID 23235683. Verificați datele pentru:
|date=(ajutor)
Bibliografie[modificare | modificare sursă]
- Adams and Victor Priciples of Neurology, 8th edition.
- Orhun H. Kantarci, M.D, Genetics and Natural History of Multiple Sclerosis, Semin Neurol 2008;28:7–16.
- J. D. Lutton,R. Winston, T. C. Rodman, Multiple Sclerosis: Etiological Mechanisms and Future Directions, Exp Biol Med 229:12–20, 2004
- Graham G. Niepel, Cris S. Constantinescu, Aetiology and pathogenesis of multiple sclerosis, Hospital Pharmacist, jan 2003, Vol.10 Arhivat în , la Wayback Machine.
- Actinmed Arhivat în , la Wayback Machine.
Alte lucrări[modificare | modificare sursă]
- Langgartner M, Langgartner I, Drlicek M (). „The patient's journey: multiple sclerosis”. BMJ. 330 (7496): 885–8. doi:10.1136/bmj.330.7496.885. PMC 556161
 . PMID 15831874.
. PMID 15831874.
