Azotit de sodiu
| Azotit de sodiu | |
 | |
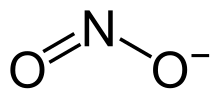 Formula structurală | |
 unitate celulară | |
| Denumiri | |
|---|---|
| Alte denumiri | E 250, nitrit de sodiu, azotit de natriu, nitrit de natriu |
| Identificare | |
| Număr CAS | 7632-00-0 |
| ChEMBL | CHEMBL93268 |
| PubChem CID | 23668193 |
| Informații generale | |
| Formulă chimică | NaNO2 |
| Aspect | solid culoare albă |
| Masă molară | 68,99 g/mol |
| Proprietăți | |
| Densitate | 2,17 g/cm3 |
| Starea de agregare | solidă |
| Punct de topire | 271 °C |
| Punct de fierbere | peste 320 °C (se descompune) |
| Solubilitate | bună în apă (820 g/l la 20 °C) |
| Aciditate (pKa) | ~9 |
| Structură cristalină | Sistem cristalin ortorombic |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Azotitul de sodiu este o sare a sodiului cu acidul azotos, cu formula chimică NaNO2. Este precursor pentru substanțe organice obținute industrial cum ar fi farmaceutice, coloranți, însă este cel mai cunoscut ca aditiv pentru mezeluri[2].
Proprietăți[modificare | modificare sursă]
Nitritul de sodiu se prezintă sub formă de cristale incolore, dizolvabil în apă cu absobție de căldură, soluția rezultată având o reacție alcalină. Punctul de topire al nitritului de sodiu este de 320 °C, temperatură la care se și descompune. La temperaturi înalte este inflamabil și se combină energic cu aluminiul, mai ales când acesta este sub formă de pulbere. El este folosit ca substanță reducătoare, în aer devine cu timpul nitrat de sodiu NaNO3. Cu acidul clorhidric formează nitrozamină.
Nitritul de sodiu este o substanță toxică (doză letală fiind de 4g), în combinație cu unele amine (nitroamine) fiind cancerigen.
Identificarea nitritului se face cu sulfat de fier (II) (FeSO4 · 7 H2O) care, în prezența nitritului, devine brun.
Produce trioxid de azot prin acidificare cu acid sulfuric[3].
Răspândire[modificare | modificare sursă]
În natură nitriții apar într-o etapă a ciclului azotului prin procesele nitrificare sau denitrificare. Din punct de vedere tehnic nitritul se obține prin combinația oxizilor de azot cu hidroxidul de sodiu (NaOH).
Utilizare[modificare | modificare sursă]
Este folosit în anumite condiții în industria alimentară ca aditiv alimentar (cu codul E 250) în procesul de conservare a produselor din carne în concentrație de 0,4 - 0,5 % în amestec cu sarea de bucătărie. Nitritul de sodiu stabilizează culoarea roșie a cărnii (formând, în combinație cu mioglobina, un pigment de culoare roșie, nitrosomioglobină, care participă la păstrarea aspectului proaspăt al produselor conservate) și are un efect antibacterian.[4]
În farmacologie și chimie servește la sinteza substanțelor colorante pe bază de azot, sau în tehnologia de galvanizare a metalelor și pentru prepararea materialelor anticorozive. Din cauza unor intoxicații cu azotat de sodiu, din anul 1980[5] este admis procentul maxim de 0,5% în saramurarea cărnurilor.
Note[modificare | modificare sursă]
- ^ „Azotit de sodiu”, SODIUM NITRITE (în engleză), PubChem, accesat în
- ^ Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (), „Nitrates and Nitrites”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_265
- ^ Ripan, Ceteanu, p. 317
- ^ Jay, James Monroe (). „13. Food Protection with Chemicals, and by Biocontrol”. Modern food microbiology, 7th ed. Springer. p. 790. ISBN 978-0-387-23180-8.
- ^ „Anlage 5 (zu § 5 Abs. 1 und § 7) Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind”. Arhivat din original la . Accesat în .
Bibliografie[modificare | modificare sursă]
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 24
- D. Negoiu, Tratat de chimie anorganică, editura Tehnică, vol.2, București, 1972
- Raluca Ripan: Manual de lucrări practice de chimie anorganică- vol I - Metaloizi, Editura de Stat Didactică și Pedagogică, 1961
- Raluca Ripan: Semimicroanaliza, Editura de Stat Didactică și Pedagogică, 1961
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză)
Legături externe[modificare | modificare sursă]
- Definiție pentru aditivul alimentar „E250” la infocons.ro (denumire și descriere).
| |||||
