Reacție de eliminare
Reacția de eliminare este, în chimia organică, un tip de reacție chimică în care doi substituenți sunt eliminați dintr-o moleculă.[1] Mecanismul de reacție poate fi într-o singură etapă (E2) sau în două etape (E1).
Reacția de eliminare este inversa reacției de adiție; de exemplu, hidratarea (adiția de apă) unei alchene cu obținerea unui alcool este reacția inversă deshidratării (eliminare de apă) alcoolilor cu obținere de alchene.
Eliminare unimoleculară (E1)[modificare | modificare sursă]
Eliminarea monomoleculară sau unimoleculară (E1) este un tip de reacție de eliminare care prezintă următoarele caracteristici:[2]
- Este o reacție ce se produce în două etape, mai exact ionizare și deprotonare:
- Ionizarea: legătura carbon-halogen se rupe cu formarea unui compus intermediar carbocationic;
- Deprotonarea: ce are loc la nivelul acestui carbocation.
- Este o reacție ce are de obicei loc la nivelul unor derivați halogenați alchilici terțiari, însă se poate face și la cele secundare.
- Viteza de reacție este influențată doar de concentrația halogenurii de alchil (a substratului), și nu a bazei, deoarece formarea carbocationului este etapa cea mai lentă, mai exact este etapa limitantă de viteză (cinetică de ordinul 1).[3]
- Reacția are de obicei loc în absența unei baze sau în prezența unei baze foarte slabe (condiții acide și temperaturi ridicate).
- Reacțiile de tipul E1 se află în competiție cu reacțiile SN1 datorită formării unui intermediar carbocationic comun.
Mecanismul de reacție poate fi reprezentat după cum urmează:

Un exemplu este piroliza unor esteri sulfonați ai mentolului:[4]

Eliminare bimoleculară (E2)[modificare | modificare sursă]
Eliminarea bimoleculară (E2) este un tip de reacție de eliminare care prezintă următoarele caracteristici:[5]
- Este o reacție ce se produce într-o singură etapă, fiind deci un exemplu de reacție concertată ce decurge printr-un singur intermediar denumit stare de tranziție.[3]
- Este o reacție ce are de obicei loc la nivelul unor derivați halogenați alchilici primari, însă se poate face și la cei secundari sau la alți compuși.
- Viteza de reacție este influențată de concentrația halogenurii de alchil și de cea a bazei, mai exact avem o cinetică de ordinul 2.[3]
- Reacția are de obicei loc în prezența unei baze îndeajuns de puternice pentru a putea elimina hidrogenul slab acid.
- Reacțiile de tipul E2 se află în competiție cu reacțiile SN2 în cazul în care baza este și un agent nucleofil (ceea ce este adevărat pentru majoritatea bazelor comune).
Mecanismul de reacție poate fi reprezentat după cum urmează:

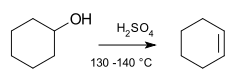
Exemple[modificare | modificare sursă]
Referințe[modificare | modificare sursă]
- ^ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7.
- ^ „The E1 Reaction and Its Mechanism”, Master Organic Chemistry, , accesat în
- ^ a b c Hans P. Latscha, Uli Kazmaier, Helmut A. Klein: Organische Chemie. 2002, Springer-Verlag, ISBN 3-540-42941-7.
- ^ Nash, J. J.; Leininger, M. A.; Keyes, K. (aprilie 2008). „Pyrolysis of Aryl Sulfonate Esters in the Absence of Solvent: E1 or E2? A Puzzle for the Organic Laboratory”. Journal of Chemical Education. 85 (4): 552. Bibcode:2008JChEd..85..552N. doi:10.1021/ed085p552.
- ^ „Mechanism of the E2 Reaction”, Master Organic Chemistry, , accesat în
| ||||||||||||||||||||
