Azotat de potasiu
| Azotat de potasiu | |
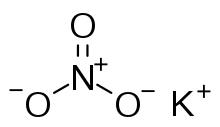 Formula structurală | |
 Sticlă de ceas cu azotat de potasiu | |
| Denumiri | |
|---|---|
| Alte denumiri | salpetru de India, nitrat de potasiu, salpetru |
| Identificare | |
| Număr CAS | 7757-79-1 |
| ChEMBL | CHEMBL1644029 |
| PubChem CID | 139063997, 516903 24434, 139063997, 516903 |
| Informații generale | |
| Formulă chimică | KNO3 |
| Aspect | pulbere albă cristalină |
| Masă molară | 101,11 g/mol |
| Proprietăți | |
| Densitate | 2,109 g/cm3 (16 °C) |
| Starea de agregare | solidă |
| Punct de topire | 334 °C |
| Punct de fierbere | >400 °C |
| Solubilitate | bună în apă (316 g/L la 20 °C) |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Azotatul de potasiu (Salpetrul de India) este o sare a potasiului cu acidul azotic.Azotatul de potasiu (KNO₃) este o sare ionică utilizată în agricultură ca îngrășământ, în industria alimentară pentru conservarea cărnii, și în pirotehnie datorită proprietăților sale oxidante. Apare sub formă de cristale albe, solubile în apă, și poate fi produs prin reacția dintre hidroxidul de potasiu și acidul azotic. Este important să fie manipulat cu grijă pentru a evita riscurile de incendiu și explozii.
Proprietate
[modificare | modificare sursă]Nitratul de potasiu se prezintă sub formă de cristale incolore, care se dizolvă cu absorbție de temperatură în apă. Prin încălzire la peste 400 °C se descompune în nitrit de potasiu și oxigen:
Nitratul de potasiu este mult mai higroscopic decât ceilalți nitrați.Azotatul uscat la temperatura ridicata este un oxidant puternic.
Utilizare
[modificare | modificare sursă]- Se folosește în procesul de saramurare al produselor alimentare
- La obținerea prafului de pușcă sau alte produse pirotehnice. Praful de pușcă "pulberea negră" este un amestec de azotat de potasiu, sulf și cărbune.
- Un amestec compus 24% Bor + 71% KNO3 + 5% (liant) (Metacrilat de polimetil) este inflamabil la temperaturi joase (−196 °C)
- Amestecul de 60% NaNO3+40% KNO3 se topește la 222 °C este un bun transportor de căldură, fiind folosit la celulele solare
- Băile de salpetru se folosesc la tratarea termică a aliajelor de aluminiu și magneziu
- Este folosit la producerea grenadelor fumigene
- Utilizat la obținerea îngrășămintelor chimice
Obținere
[modificare | modificare sursă]2KNO3(l) + C(s) = 2KNO2(l) + CO2(g).
Sunt metode numeroase de obținere din alte săruri combinate cu acidul azotic:
Bibliografie
[modificare | modificare sursă]- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 87
| |||||
- ^ „azotat de potasiu”, Saltpeter (în engleză), PubChem, accesat în







