Hemodializă
| Hemodializă | |
 Mașină de hemodializă | |
| Specialitate | nefrologie |
|---|---|
| Clasificare și resurse externe | |
| ICD-11 | |
| Modifică date / text | |
Hemodializa sau pur și simplu dializa, este un proces de purificare a sângelui unei persoane ai cărei rinichi nu funcționează normal. Acest tip de dializă realizează eliminarea extracorporală a deșeurilor, cum ar fi creatinină și uree și apă liberă din sânge atunci când rinichii sunt într-o stare de insuficiență renală. Hemodializa este una dintre cele trei terapii de substituție renală (celelalte două fiind transplantul de rinichi și dializa peritoneală). O metodă alternativă pentru separarea extracorporală a componentelor sanguine, cum ar fi plasma sau celulele, este afereza.
Hemodializa poate fi o terapie ambulatorie sau internat. Hemodializa de rutină se efectuează într-o unitate de dializă ambulatoriu, fie într-o cameră construită în acest scop într-un spital sau o clinică dedicată, independent. Mai rar hemodializa se face acasă. Tratamentele de dializă într-o clinică sunt inițiate și gestionate de personal specializat format din asistente medicale și tehnicieni; tratamentele de dializă la domiciliu pot fi auto-inițiate și gestionate sau efectuate în comun cu ajutorul unui ajutor instruit, care este, de obicei, un membru al familiei.[1]
Utilizări medicale
[modificare | modificare sursă]
Hemodializa este alegerea dializei pentru pacienții care au nevoie acută de dializă, și pentru mulți pacienți ca terapie de întreținere. Acesta oferă clearance-ul excelent, rapid de solutes.[2]
Un nefrolog (un specialist medical pentru rinichi) decide când este necesară hemodializa și diverșii parametri pentru un tratament de dializă. Acestea includ frecvența (câte tratamente pe săptămână), durata fiecărui tratament și debitul de sânge și soluție de dializă, precum și dimensiunea dializei. Compoziția soluției de dializă este, de asemenea, uneori ajustată în ceea ce privește nivelurile sale de sodiu și potasiu și bicarbonat. În general, cu cât dimensiunea corporală a unei persoane este mai mare, cu atât va avea nevoie de dializă. În America de Nord și UK, tratamentele de 3-4 ore (uneori până la 5 ore pentru pacienții mai mari) administrate de 3 ori pe săptămână sunt tipice. Sesiunile de două ori pe săptămână sunt limitate la pacienții care au o funcție renală reziduală substanțială. Patru sesiuni pe săptămână sunt adesea prescrise pentru pacienții mai mari, precum și pacienții care au probleme cu supraîncărcare a fluidelor. În cele din urmă, există un interes tot mai mare în efectuarea de hemodializă la doniciliu de zi cu zi, care este de 1,5 - 4 ore pe sesiune urmară de 5-7 ori pe săptămână, de obicei. Există, de asemenea, interes în dializă nocturnă, care implică dializarea unui pacient, de obicei la domiciliu, timp de 8-10 ore pe noapte, 3-6 nopți pe săptămână. Dializa nocturnă în centru, de 3-4 ori pe săptămână, este, de asemenea, oferită la o mână de unități de dializă din Statele Unite.
Efecte adverse
[modificare | modificare sursă]Dezavantaje
[modificare | modificare sursă]- Limitează independența, deoarece persoanele care urmează această procedură nu pot călători din cauza disponibilității proviziilor
- Necesită mai multe consumabile, cum ar fi calitatea înaltă a apei și de energie electrică
- Necesită o tehnologie fiabilă, cum ar fi aparatele de dializă
- Procedura este complicată și necesită ca personalul de îngrijire să aibă mai multe cunoștințe
- Necesită timp pentru a configura și curăța mașina de dializă, și cheltuieli cu mașinile și personalul asociat[2]
Complicații
[modificare | modificare sursă]Schimburi de fluide
[modificare | modificare sursă]Hemodializa implică adesea îndepărtarea lichidului [prin ultrafiltrare), deoarece majoritatea pacienților cu insuficiență renală prodic puțină sau deloc urină. Efectele secundare cauzate de eliminarea prea mult lichid și / sau eliminarea lichidului prea rapidă includ sângerângeri, oboseală, dureri în piept, crampe în picioare, greață și dureri de cap. Aceste simptome pot apărea în timpul tratamentului și pot persista după tratament; acestea sunt uneori denumite colectiv mahmureala dializei sau spălare a dializei. Severitatea acestor simptome este, de obicei, proporțională cu cantitatea și viteza de îndepărtare a lichidului. Cu toate acestea, impactul unei anumite cantități sau rata de îndepărtare a lichidului poate varia foarte mult de la o persoană la alta și de la o zi la alta. Aceste reacții adverse pot fi evitate și / sau severitatea lor diminuată prin limitarea aportului de lichide între tratamente sau creșterea dozei de dializă, de exemplu dializând mai des sau mai mult pe tratament decât standardul de trei ori pe săptămână, 3-4 ore pe program de tratament.
Despre acces
[modificare | modificare sursă]Deoarece hemodializa necesită acces la sistemul circulator, pacienții supuși hemodializei își pot expune sistemul circulator la microbi, ceea ce poate duce la bacteriemie, o infecție care afectează valvele inimii (endocardită) sau la o infecție care afectează oasele (osteomielită). Riscul de infecție variază în funcție de tipul de acces utilizat (vezi mai jos). Sângerarea poate apărea, de asemenea, din nou, riscul variază în funcție de tipul de acces utilizat. Infecțiile pot fi minimizate prin respectarea strictă a celor mai bune practici privind controlul infecției.
Dislocarea acului venos
[modificare | modificare sursă]Dislocarea venoasă a acului (VND) este o complicație fatală a hemodializei, în care pacientul suferă o pierdere rapidă de sânge datorită unui atașament șubred al acului la punctul de acces venos.[3]
Relativ la anticoagulante
[modificare | modificare sursă]Heparina nefracționată (UHF) este cel mai frecvent utilizat anticoagulant în hemodializă, deoarece este în general bine tolerată și poate fi inversată rapid cu sulfat de protamină. Heparina cu greutate moleculară mică (LMWH) este însă din ce în ce mai populară și este acum norma în Europa de Vest.[4] Comparativ cu UHF, LMWH are avantajul unui mod mai ușor de administrare și sângerare redusă, dar efectul nu poate fi ușor inversat.[5] Heparina poate provoca rar un număr scăzut de trombocite datorită unei reacții numite trombocitopenie indusă de heparină (HIT). La acești pacienți, pot fi utilizate anticoagulante alternative. Riscul de HIT este mai mic cu LMWH comparativ cu UHF. Chiar dacă HIT provoacă un număr scăzut de trombocite se poate predispune paradoxal tromboză.[6] La pacienții cu risc ridicat de sângerare, dializa se poate face fără anticoagulante.[7]
Sindromul primei utilizări
[modificare | modificare sursă]Sindromul de primă utilizare este o reacție anafilactică rară, dar severă la rinichiul artificial. Simptomele sale includ strănut, respirație șuierătoare, dificultăți de respirație, dureri de spate, dureri în piept, sau moarte subită. Aceasta poate fi cauzată de sterilizarea reziduală în rinichiul artificial sau de materialul membranei în sine. În ultimii ani, incidența sindromului de primă utilizare a scăzut, datorită utilizării crescute a sterilizării cu radiații ionizante, sterilizării cu abur sau a radiațiilor cu fascicul de electroni în locul sterilanților chimici, precum și a dezvoltării de noi membrane semipermeabile de biocompatibilitate. Trebuie luate în considerare întotdeauna noi metode de prelucrare a componentelor acceptabile anterior ale dializei. De exemplu, în 2008, o serie de reacții de primă utilizare, inclusiv decese, au apărut din cauza heparinei contaminate în timpul procesului de fabricație cu sulfat de condroitină suprasulfurat.[8]
Cardiovasculare
[modificare | modificare sursă]Complicațiile pe termen lung ale hemodializei includ amiloidoza asociată cu hemodializă, neuropatie și diferite forme de boli de inimă. Creșterea frecvenței și a duratei de tratament au fost demonstrate pentru a îmbunătăți supraîncărcarea cu lichide și mărirea inimii, care sunt frecvent observate la astfel de pacienți.[9][10] Datorită acestor complicații, prevalența utilizării medicina complementară și alternativă este ridicată în rândul pacienților supuși hemodializei.[11][12]
Deficit de vitamine
[modificare | modificare sursă]La unii pacienți cu hemodializă poate apărea deficit de acid folic.[13]
Dezechilibre electrolitice
[modificare | modificare sursă]Deși un lichid de dializat, care este o soluție care conține electroliți diluați, este utilizat pentru filtrarea sângelui, hemodializa poate provoca un dezechilibru electrolitic. Aceste dezechilibre pot deriva din concentrații anormale de potasiu (hipokalemie, hiperkalemie) și sodiu (hiponatremie, hipernatremie). Aceste dezechilibre electrolitice sunt asociate cu creșterea mortalității cardiovasculare.[14]
Mecanism și tehnică
[modificare | modificare sursă]
Principiul hemodializei este același cu alte metode de dializă; implică difuzie de soluții pe o membrană semipermeabilă. Hemodializa utilizează counter, unde dializa curge în direcția opusă fluxului sanguin în circuitul extracorporeal. Debitul de contracurent menține gradientul de concentrație pe membrană la un maxim și crește eficiența dializei.
Îndepărtarea lichidului ultrafiltrație se realizează prin modificarea presiunii hidrostatice a compartimentului de dializă, cauzând apei libere și unor soluții dizolvate să se deplaseze de-a lungul membranei de-a lungul unui gradient de presiune creat.
Soluția de dializă utilizată poate fi o soluție sterilizată de ioni minerali și se numește dializă. Ureea și alte deșeuri, inclusiv potasiul, și fosfatul difuzează în soluția de dializă. Cu toate acestea, concentrațiile de sodiu și clorură sunt similare cu cele ale plasmei normale pentru a preveni pierderea. Bicarbonatul de sodiu se adaugă într-o concentrație mai mare decât plasma pentru a corecta aciditatea sângelui. O cantitate mică de glucoză este, de asemenea, frecvent utilizată. Concentrația de electroliți din dializă este ajustată în funcție de starea pacientului înainte de dializă. Dacă se adaugă o concentrație mare de sodiu la dializă, pacientului i de poate face sete și ajunge să acumuleze fluide corporale, ceea ce poate duce la leziuni cardiace. Dimpotrivă, concentrații scăzute de sodiu în soluția de dializă au fost asociate cu o tensiune arterială scăzută și creșterea în greutate intradialitică, care sunt markeri ai rezultatelor îmbunătățite. Cu toate acestea, beneficiile utilizării unei concentrații scăzute de sodiu nu au fost încă demonstrate, deoarece acești pacienți pot suferi, de asemenea, de crampe, hipotensiune arterială intradialitică și sodiu scăzut în ser, care sunt simptome asociate cu un risc ridicat de mortalitate.[15]
Rețineți că acesta este un proces diferit de tehnica legată de hemofiltrare.
Acess
[modificare | modificare sursă]Trei metode primare sunt utilizate pentru a avea acces la sânge pentru hemodializă: un cateter intravenos, o fistulă arteriovenoasă (AV) și o grefă sintetică. Tipul de acces este influențat de factori precum cursul de timp așteptat al insuficienței renale a pacientului și starea vasculaturii acestuia. Pacienții pot avea mai multe proceduri de acces, de obicei, deoarece o fistula AV sau grefă este în curs de maturare și un cateter este încă utilizat. Plasarea unui cateter se face de obicei sub sedare ușoară, în timp ce fistulele și grefele necesită o operație.

Tipuri
[modificare | modificare sursă]Există trei tipuri de hemodializă: hemodializă convențională, hemodializă zilnică și hemodializă nocturnă. Mai jos este o adaptare și rezumat dintr-o broșură a Spitalului Ottawa.
Hemodializă convențională
[modificare | modificare sursă]Hemodializa convențională se face de obicei de trei ori pe săptămână, timp de aproximativ trei până la patru ore pentru fiecare tratament (Uneori, cinci ore pentru pacienții mai mari), în timpul căreia sângele pacientului este extras printr-un tub la o rată de 200-400 mL/min. Tubul este conectat la un ac de calibrul 15, 16 sau 17 introdus în fistulă sau grefa de dializă sau conectat la un port al unei mașini de dializă printr-un cateter. Sângele este apoi pompat prin mașina de dializă, iar apoi sângele procesat este pompat înapoi în fluxul sanguin al pacientului printr-un alt tub (conectat la un al doilea ac sau port). În timpul procedurii, tensiunea arterială a pacientului este monitorizată îndeaproape, iar dacă aceasta devine scăzută, sau pacientul dezvoltă orice alte semne de volum scăzut de sânge, cum ar fi greață, însoțitorul de dializă poate administra lichid suplimentar prin intermediul aparatului. În timpul tratamentului, întregul volum de sânge al pacientului (aproximativ 5000 cc) circulă prin aparat la fiecare 15 minute. În timpul acestui proces, pacientul dializat este expus la o valoare de apă pentru o săptămână pentru o persoană medie.
Hemodializă zilnică
[modificare | modificare sursă]Hemodializa zilnică este de obicei utilizată de acei pacienți care își fac propria dializă la domiciliu. Este mai puțin stresant (mai blând), dar are nevoie de acces mai frecvent. Acest lucru este simplu cu catetere, dar mai problematică cu fistule sau grefe. „Tehnica butonieră” poate fi utilizată pentru fistule care necesită acces frecvent. Hemodializa zilnică se face de obicei timp de 2 ore șase zile pe săptămână.
Hemodializă nocturnă
[modificare | modificare sursă]Procedura de hemodializă nocturnă este similară cu hemodializa convențională, cu excepția faptului că se efectuează de trei până la șase nopți pe săptămână și între șase și zece ore pe sesiune în timp ce pacientul doarme.[16]
Echipament
[modificare | modificare sursă]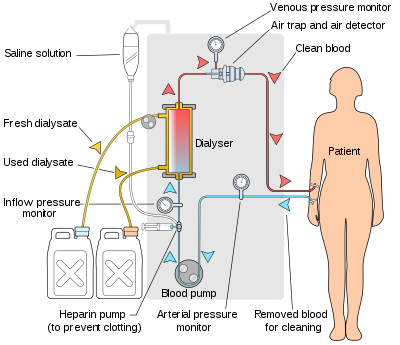
Aparatul de hemodializă pompează sângele pacientului și soluția de dializă prin dializor. Cele mai noi aparate de dializă de pe piață sunt foarte computerizate și monitorizează continuu o serie de parametri critici pentru siguranță, inclusiv debitul de sânge șisoluția de dializă; conductivitatea, temperatura și pH-ul soluției de dializă; și analiza dializatului pentru dovezi de scurgere de sânge sau prezență a aerului. Orice citire care este în afara intervalului normal declanșează o alarmă sonoră pentru a alerta tehnicianul pacientului care monitorizează pacientul. Producătorii de aparate de dializă includ companii precum Nipro, Fresenius, Gambro, Baxter, B. Braun, NxStage și Bellco.
Tipuri
[modificare | modificare sursă]Sistemul de apă
[modificare | modificare sursă]
Un sistem extins pentru purificarea apei este absolut necesar pentru hemodializă. Deoarece pacienții cu dializă sunt expuși la cantități mari de apă, care este amestecată cu concentrat de dializă pentru a forma soluția de dializă, chiar urme de contaminanți minerali sau bacterii endotoxine pot ajunge în sângele pacientului. Deoarece rinichii afectați nu pot îndeplini funcția dorită de îndepărtare a impurităților, ionii introduși în sânge prin apă se pot acumula până la niveluri periculoase, provocând numeroase simptome sau moarte. Aluminiul, cloramina, fluorul, cuprul și zincul, precum și fragmentele bacteriene și endotoxinele, au cauzat probleme în această privință.
Din acest motiv, apa utilizată în hemodializă este purificată cu atenție înainte de utilizare. Inițial, acesta este filtrată și reglată la temperatură, iar pH-ul său este corectat prin adăugarea unui acid sau a unei baze. Tampoane chimice, cum ar fi bicarbonatul și lactatul, pot fi adăugate alternativ pentru a regla pH-ul dializatului. Ambele tampoane pot stabiliza pH-ul soluției la nivel fiziologic, fără impact negativ asupra pacientului. Există unele dovezi de o reducere a incidenței de inima si probleme de sânge și evenimente de hipertensiune arterială atunci când se utilizează bicarbonat ca tampon pH-ul în comparație cu lactat. Cu toate acestea, ratele de mortalitate după utilizarea ambelor tampoane nu arată o diferență semnificativă.[17]
Soluția de dializă este apoi înmuiată. Apoi apa este rulată printr-un rezervor care conține cărbune activat pentru a adsorbi contaminanți organici. Purificarea primară se face apoi prin forțarea apei printr-o membrană cu porii foarte mici, o așa-numită membrană de osmoză inversă. Acest lucru permite trecerea apei, dar reține chiar și particule foarte mici, precum electroliții. Îndepărtarea finală a electroliților rămași se face prin trecerea apei printr-un rezervor cu rășini schimbătoare de ioni, care îndepărtează orice anioni sau cationi rămași și îi înlocuiesc cu ioni hidroxil și, respectiv, hidrogen, lăsând apă ultrapură.
Chiar și acest grad de purificare a apei poate fi insuficient. Tendința în ultima vreme este de a trece această apă purificată finală (după amestecarea cu concentrat de dializă) printr-o membrană de dializă. Acest lucru oferă un alt strat de protecție prin îndepărtarea impurităților, în special a celor de origine bacteriană, care s-au acumulat în apă după trecerea sa prin sistemul original de purificare a apei.
Odată ce apa purificată este amestecată cu concentrat de dializă, conductivitatea sa crește, deoarece apa care conține ioni încărcați conduce electricitatea. În timpul dializei, conductivitatea soluției de dializă este monitorizată continuu pentru a se asigura că apa și concentratul de dializă sunt amestecate în proporțiile corespunzătoare. Atât soluția de dializă concentrată excesiv, cât și soluția excesiv de diluată pot provoca probleme clinice severe.
Dializor
[modificare | modificare sursă]Dializorul este echipamentul care filtrează sângele. Aproape toate dializoare în uz astăzi sunt din soiul de fibre goale. Un pachet cilindric de fibre goale, ai căror pereți sunt compunși din membrană semi-permeabilă, este ancorat la fiecare capăt în „compus potting” (un fel de lipici). Acest ansamblu este apoi pus într-o carcasă cilindrică din plastic transparent, cu patru deschideri. Un port de deschidere sau de sânge la fiecare capăt al cilindrului comunică cu fiecare capăt al pachetului de fibre goale. Aceasta formează „compartimentul de sânge” al dializorului. Alte două porturi sunt tăiate în partea laterală a cilindrului. Acestea comunică cu spațiul din jurul fibrelor goale, „compartimentul de dializă”. Sângele este pompat prin porturile de sânge prin acest pachet de tuburi foarte subțiri capilare, iar soluția de dializă este pompată prin spațiul din jurul fibrelor. Declivitățile de presiune sunt aplicate atunci când este necesar pentru a muta lichidul din sânge în compartimentul dializă.
Membrană și flux
[modificare | modificare sursă]Membranele dializoarelor sunt cu diferite dimensiuni ale porilor. Cei cu dimensiuni mai mici ale porilor sunt numite „cu flux scăzut” și cele cu dimensiuni mai mari ale porilor sunt numite „cu flux ridicat.” Unele molecule mai mari, cum ar fi beta-2-microglobulina, nu sunt eliminate deloc cu dializoare cu flux scăzut; în ultima vreme, tendința a fost de a utiliza dializoare de flux ridicat. Cu toate acestea, astfel de dializoare necesită aparate de dializă mai noi și soluție de dializă de înaltă calitate pentru a controla rata de îndepărtare a lichidului în mod corespunzător și pentru a preveni refluxul de impurități din soluția de dializă în pacient prin membrană.
Membranele dializoarelor pentru a fi utilizate sunt realizate în principal din celuloză (derivat din bumbac linter). Suprafața acestor membrane nu era foarte biocompatibilă, deoarece grupurile hidroxile expuse se activau complementar în sângele care trecea prin membrană. Prin urmare, membrana de bază,celuloză „nesubstituită” a fost modificată. O modificare a fost de a acoperi aceste grupuri hidroxil cu grupuri de acetat (acetat de celuloză); o altă modificare a fost de a se amestecă în unii compuși care ar inhiba activarea complementului la suprafața membranei (celuloză modificată). Membranele originale de „celuloză nesubstituită” nu mai sunt utilizate pe scară largă, în timp ce acetatul de celuloză și dializoarele de celuloză modificate sunt încă utilizate. Membranele celulozice pot fi realizate fie în configurație cu flux scăzut, fie în configurație cu flux ridicat, în funcție de dimensiunea porilor.
Un alt grup de membrane sunt membranele fabricate din materiale sintetice, folosind polimeri, cum ar fi poliarilethersulfone, poliamidă, polivinilpirolidonă, policarbonat și poliacrilonitril. Aceste membrane sintetice activează complementul într-o măsură mai mică decât membranele celulozice nesubstituite. Cu toate acestea, ele sunt, în general, mai hidrofobe, ceea ce duce la creșterea adsorbției proteinelor la suprafața membranei, care, la rândul său, poate duce la activarea sistemului de completare.[18][19] Membranele sintetice pot fi realizate fie în configurație cu flux scăzut, fie în configurație cu flux ridicat, dar majoritatea sunt cu flux ridicat.
Nanotehnologia este folosită în unele dintre cele mai recente membrane cu flux ridicat pentru a crea o dimensiune uniformă a porilor. Scopul membranelor cu flux ridicat este de a trece molecule relativ mari, cum ar fi beta-2-microglobulina (MW 11,600 daltoni), dar nu pentru a trece albumina (MW ~ 66,400 daltoni). Fiecare membrană are porii într-o gamă largă de dimensiuni. Pe măsură ce dimensiunea porilor crește, unele dializoare cu flux ridicat încep să lase albumina să treacă din sânge în dializă. Acest lucru este considerat a fi nedorit, deși o școală de gândire susține că eliminarea unor albumine poate fi benefică în ceea ce privește eliminarea toxinelor uremice legate de proteine.
Fluxul membranei și rezultatul
[modificare | modificare sursă]Dacă folosind un dializer cu flux ridicat se îmbunătățesc rezultatele pacientul este oarecum controversat, dar mai multe studii importante au sugerat că are beneficii clinice. Studiul HEMO finanțat de NIH a comparat supraviețuirea și spitalizările la pacienții randomizați la dializă fie cu membrane cu flux scăzut, fie cu membrane cu flux ridicat. Deși rezultatul primar (mortalitatea cauzată de toate cauzele) nu a atins semnificația statistică în grupul randomizat pentru a utiliza membrane cu flux ridicat, mai multe rezultate secundare au fost mai bune în grupul cu flux ridicat.[20][21] O analiză recentă Cochrane a concluzionat că beneficiul alegerii membranei asupra rezultatelor nu a fost încă demonstrat, mai multe rezultate secundare au fost mai bune în grupul cu flux ridicat.[22] Un studiu colaborativ randomizat din Europa, studiul MPO (Membrane Permeabilies Outcomes),[23] privind compararea mortalității la pacienții care abia au început dializa utilizând fie membrane cu flux ridicat, fie membrane cu flux scăzut, a constatat o tendință nesemnificativă de îmbunătățire a supraviețuirii la cei care utilizează membrane cu flux ridicat și un beneficiu de supraviețuire la pacienții cu niveluri mai scăzute de albumină serică sau la diabetici.
Fluxul membranei și amiloidoza beta-2-microglobulină
[modificare | modificare sursă]Membranele de dializă cu flux ridicat și/sau hemodiafiltrarea intermitentă on-line (IHDF) pot fi, de asemenea, benefice în reducerea complicațiilor acumulării de beta-2-microglobulină. Deoarece beta-2-microglobulina este o moleculă mare, cu o greutate moleculară de aproximativ 11.600 daltoni, nu trece deloc prin membranele de dializă cu flux scăzut. Beta-2-M este eliminată prin dializă cu flux ridicat, dar este eliminată chiar mai eficient cu IHDF. După mai mulți ani (de obicei cel puțin 5-7), pacienții cu hemodializă încep să dezvolte complicații de la acumularea beta-2-M, inclusiv sindromul tunelului carpian, chisturi osoase și depozite ale acestui amiloid în articulații și alte țesuturi. Amiloidoza Beta-2-M poate provoca complicații foarte grave, inclusiv spondiloartropatie, și de multe ori este asociată cu probleme articulare la umăr. Studiile observaționale din Europa și Japonia au sugerat că utilizarea membranelor cu flux ridicat în modul dializă, sau IHDF, reduc complicațiile beta-2-M în comparație cu dializa regulată folosind o membrană cu flux scăzut.[24][25][26][27][28]
Dimensiunea și eficiența dializorului
[modificare | modificare sursă]Dializoarele vin în mai multe dimensiuni diferite. Un dializant mai mare, cu o membrană cu suprafață mai mare (A) va elimina, de obicei, mai multe solutes decât un dializor mai mic, în special la rate ridicate ale fluxului sanguin. Acest lucru depinde, de asemenea, de coeficientul de permeabilitate a membranei K0 pentru solutele în cauză. Deci, eficiența dializorului este de obicei exprimată ca K0A – produsul coeficientului de permeabilitate și al suprafeței. Majoritatea dializoarelor au suprafețe membranare cuprinse între 0,8 și 2,2 metri pătrați, iar valorile K0A variind de la aproximativ 500 la 1500 mL/min. K0A, exprimate în mL/min, pot fi considerate ca fiind clearance-ul maxim al unui dializor la un debit foarte mare de sânge și dializat.
Reutilizarea dializoarelor
[modificare | modificare sursă]Dializantul poate fi aruncat după fiecare tratament sau poate fi reutilizat. Reutilizarea necesită o procedură extinsă de dezinfectare la nivel înalt. Dializoarele reutilizate nu sunt partajate între pacienți. A existat o controversă inițială cu privire la posibilitatea de a reutilizarea dializoare înrăutățind rezultatele pacientului. Consensul de astăzi este că reutilizarea dializoarelor, dacă este făcută cu atenție și în mod corespunzător, produce rezultate similare cu utilizarea unică a dializoarelor.[29]
Diatyzer Reuse este o practică care a fost în jur de la inventarea produsului. Această practică include curățarea unui dializor utilizat care urmează să fie reutilizat de mai multe ori pentru același pacient. Clinicile de dializă reutilizează dializoarele pentru a deveni mai economice și pentru a reduce costurile ridicate ale dializei de unică folosință, care pot fi extrem de costisitoare și risipitoare. Dializoarele unice utilizate doar o singură dată și apoi aruncate duc la crearea unei mari cantități de bio-deșeuri medicale cu nici o milă pentru economiile de costuri. Dacă este făcută corect, reutilizarea dializoarelor poate fi foarte sigură pentru pacienții dializați.
Există două moduri de a reutiliza dializoarele, manuală și automatizată. Reutilizarea manuală implică curățarea manuală a unui dializant. Dializantul este semi-dezasamblat, apoi spălat în mod repetat înainte de a fi clătit cu apă. Acesta este apoi depozitat cu un dezinfectant lichid (PAA) timp de 18 + ore până la următoarea utilizare. Deși multe clinici din afara SUA folosesc această metodă, unele clinici sunt pentru trecerea spre un proces mai automatizat / raționalizat ca practica a dializei. Metoda mai nouă de reutilizare automată se realizează cu ajutorul unui dispozitiv medical care a început la începutul anilor 1980. Aceste dispozitive sunt benefice pentru clinicile de dializă care practică reutilizarea - în special pentru entitățile clinice de dializă mari - deoarece acestea permit mai multe cicluri pe zi. Dializantul este mai întâi pre-curățat de un tehnician, apoi curățat automat cu mașina printr-un proces de cicluri pas până când este în cele din urmă umplut cu dezinfectant lichid pentru depozitare. Deși reutilizarea automată este mai eficientă decât reutilizarea manuală, tehnologia mai nouă a stârnit și mai multe progrese în procesul de reutilizare. Atunci când sunt reutilizate de peste 15 ori cu metodologia actuală, dializorul poate pierde B2m, clearance-ul moleculei de mijloc și integritatea structurii porilor de fibre, care are potențialul de a reduce eficacitatea sesiunii de dializă a pacientului. În prezent, începând cu 2010, tehnologia de reprocesare mai nouă, mai avansată, a dovedit capacitatea de a elimina complet procesul manual de pre-curățare cu totul și a dovedit, de asemenea, potențialul de a regenera (restabili complet) toate funcțiile unui dializor la niveluri care sunt aproximativ echivalente cu o singură utilizare pentru mai mult de 40 de cicluri.[30] Ca ratele de rambursare medicală să scadă chiar mai mult, multe clinici de dializă continuă să funcționeze în mod eficient cu programe de reutilizare mai ales că procesul este mai ușor și mai raționalizat decât înainte.
Epidemiologie
[modificare | modificare sursă]Hemodializa a fost una dintre cele mai frecvente proceduri efectuate în spitalele din SUA în 2011, când au avut loc 909.000 de ședințe (o rată de 29 de ședințe la 10.000 de locuitori). Aceasta a fost o creștere de 68 la sută din 1997, când au existat 473.000 de ședințe. A fost a cincea cea mai frecventă procedură pentru pacienții cu vârsta cuprinsă între 45 și 64 de ani.[31]
Istorie
[modificare | modificare sursă]Mulți au jucat un rol în dezvoltarea dializei ca tratament practic pentru insuficiența renală, începând cu Thomas Graham din Glasgow, care a prezentat pentru prima dată principiile transportului solute pe o membrană semipermeabilă în 1854.[32] Rinichiul artificial a fost dezvoltat pentru prima dată de Abel, Rountree și Turner în 1913,[33] prima hemodializă la o ființă umană a fost realizată de Haas (28 februarie 1924)[34] și rinichiul artificial a fost dezvoltat într-un aparat util clinic de Kolff în 1943 – 1945.[35] Această cercetare a arătat că viața ar putea fi prelungită la pacienții care mor de insuficiență renală.
Willem Kolff a fost primul care a construit un dializor de lucru în 1943. Primul pacient tratat cu succes a fost o femeie de 67 de ani în comă uremică care și-a recăpătat cunoștința după 11 ore de hemodializă cu mașina de dializă a lui Kolff în 1945. La momentul creării sale, scopul lui Kolff a fost de a oferi suport de viață în timpul recuperării de insuficiență renală acută. După ce Al Doilea Război Mondial s-a încheiat, Kolff a donat cele cinci dializoare pe care le făcuse spitalelor din întreaga lume, inclusiv Spitalului Mount Sinai, New York Kolff i-a dat un set de planuri pentru mașina sa de hemodializă lui George Thorn de la Spitalul Peter Bent Brigham din Boston. Acest lucru a dus la fabricarea următoarei generații de dializoare Kolff, o mașină de dializă din oțel inoxidabil.
Potrivit lui McKellar (1999), o contribuție semnificativă la terapiile renale a fost făcută de chirurgul canadian Gordon Murray cu ajutorul a doi medici, un student la chimie și personal de cercetare. Munca lui Murray a fost desfășurată simultan și independent de cea a lui Kolff. Munca lui Murray a dus la primul rinichi artificial de succes construit în America de Nord în 1945-1946, care a fost folosit cu succes pentru a trata o femeie de 26 de ani dintr-o comă uraemică în Toronto. Dializorul „Murray-Roschlau” de a doua generație a fost inventat în 1952-1953. Planurile acestuia au fost furate de imigrantul german Erwin Halstrup, și a trecut drept al său („rinichiul artificial Halstrup-Baumann”).[36]
Prin 1950, inventarea de către Willem Kolff a dializorului a fost folosită pentru insuficiența renală acută, dar nu a fost văzută ca un tratament viabil pentru pacienții cu stadiul 5 de boală renală cronică. La acea vreme, medicii credeau că este imposibil ca pacienții să facă dializă pe termen nelimitat din două motive. În primul rând, au crezut că nici un dispozitiv de construit de om nu ar putea înlocui funcția rinichilor pe termen lung. În plus, un pacient supus dializei a suferit de vene și artere deteriorate, astfel încât, după mai multe tratamente, a devenit dificil să se găsească un vas pentru a accesa sângele pacientului.
Rinichiul original Kolff nu a fost foarte util clinic, deoarece nu a permis îndepărtarea excesului de lichid. Profesor suedez Nils Alwall[37] a încastrat o versiune modificată a acestui rinichi în interiorul unei canistre din oțel inoxidabil, la care ar putea fi aplicată o presiune negativă, efectuând în acest fel prima aplicare cu adevărat practică a hemodializei, care a fost făcută în 1946 la Universitatea din Lund. Alwall, de asemenea, a fost, fără îndoială, inventatorul șunului arteriovenos pentru dializă. El a raportat acest lucru pentru prima dată în 1948, unde a folosit un astfel de șunt arteriovenos la iepuri. Ulterior, el a folosit astfel de șunturi, realizate din sticlă, precum și dializorul său cu canistră, pentru a trata 1500 de pacienți cu insuficiență renală între 1946 și 1960, așa a raportat la Primul Congres Internațional de Nefrologie care a avut loc la Evian în septembrie 1960. Alwall a fost numit în funcția de președinte a nou createi catedre de nefrologie de la Universitatea din Lund în 1957. Ulterior, el a colaborat cu omul de afaceri suedez Holger Crafoord pentru a fonda una dintre companiile-cheie care ar fi fabricat echipamente de dializă în ultimii 50 de ani, Gambro. Istoria timpurie a dializei a fost revizuită de Stanley Shaldon.[38]
Belding H. Scribner, lucrând cu inginerul biomecanic Wayne Quinton, a modificat șunturile de sticlă folosite de Alwall făcându-le din teflon. O altă îmbunătățire cheie a fost de a le conecta la o bucată scurtă de tuburi de elastomer de silicon. Aceasta a stat la baza așa-numitului șunt Scribner, poate mai corect numit șuntul Quinton-Scribner. După tratament, accesul circulator ar fi fost păstrat deschis prin conectarea celor două tuburi din afara corpului folosind un tub mic de teflon în formă de U, care ar șuntat sângele din tub în arteră înapoi la tubul din venă.[39]
În 1962, Scribner a început prima unitate de dializă ambulatorie din lume, Seattle Artificial Kidney Center, redenumit mai târziu Northwest Kidney Centers. Imediat a apărut problema celor care ar trebui să i se administreze dializă, deoarece cererea a depășit cu mult capacitatea celor șase aparate de dializă din centru. Scribner a decis că nu va lua decizia cu privire la cine va primi dializă și cine nu. În schimb, alegerile ar fi făcute de un comitet anonim, care ar putea fi considerat unul dintre primele comitete bioetică
Pentru o istorie detaliată a încercărilor de succes și nereușite la dializă, inclusiv pionieri, ar fi Abel și Roundtree, Haas, și Necheles, a se vedea această revizuire de Kjellstrand.[40]
Vezi și
[modificare | modificare sursă]Referințe
[modificare | modificare sursă]- ^ „Kidney Failure: Choosing a Treatment That's Right for You”. National Kidney and Urologic Diseases Information Clearinghouse guidance. Arhivat din original la .
- ^ a b Daugirdas JT, Black PG, Ing TS (). Handbook of Dialysis (ed. 4th). Philadelphia, PA: Lippincott Williams & Wilkins, a Wolters Kluwer Business.
- ^ Van Waeleghem JP, Chamney M, Lindley EJ, Pancírová J (decembrie 2008). „Venous needle dislodgement: how to minimise the risks” (PDF). Journal of Renal Care. 34 (4): 163–8. doi:10.1111/j.1755-6686.2008.00047.x. PMID 19090893.
- ^ Cronin RE, Reilly RF (septembrie 2010). „Unfractionated heparin for hemodialysis: still the best option”. Seminars in Dialysis. 23 (5): 510–5. doi:10.1111/j.1525-139X.2010.00770.x. PMC 3229102
 . PMID 21039876.
. PMID 21039876.
- ^ Davenport A (august 2009). „Articol de revizuire: Heparină cu greutate moleculară scăzută ca anticoagulant alternativ la heparina nefracționată pentru tratamentele de rutină de hemodializă în ambulatoriu”. Nephrology. 14 (5): 455–61. doi:10.1111/j.1440-1797.2009.01135.x
 . PMID 19674314.
. PMID 19674314.
- ^ Dutt T, Schulz M (decembrie 2013). „Heparin-induced thrombocytopaenia (HIT)-an overview: what does the nephrologist need to know and do?”. Clinical Kidney Journal. 6 (6): 563–7. doi:10.1093/ckj/sft139. PMC 4438383
 . PMID 26069824.
. PMID 26069824.
- ^ Davenport A (iulie 2011). „What are the anticoagulation options for intermittent hemodialysis?”. Nature Reviews. Nephrology. 7 (9): 499–508. doi:10.1038/nrneph.2011.88. PMID 21727925.
- ^ Kishimoto TK, Viswanathan K, Ganguly T, et al. (). „Contaminated heparin associated with adverse clinical events and activation of the contact system”. N Engl J Med. 358 (23): 2457–67. doi:10.1056/NEJMoa0803200. PMC 3778681
 . PMID 18434646.
. PMID 18434646.
- ^ Ayus JC, Mizani MR, Achinger SG, Thadhani R, Go AS, Lee S (septembrie 2005). „Effects of short daily versus conventional hemodialysis on left ventricular hypertrophy and inflammatory markers: a prospective, controlled study”. Journal of the American Society of Nephrology. 16 (9): 2778–88. doi:10.1681/ASN.2005040392
 . PMID 16033855.
. PMID 16033855.
- ^ Weinreich T, De los Ríos T, Gauly A, Passlick-Deetjen J (). „Effects of an increase in time vs. frequency on cardiovascular parameters in chronic hemodialysis patients”. Clinical Nephrology. 66 (6): 433–9. doi:10.5414/CNP66433. PMID 17176915.
- ^ Heydari M, Hashempur MH, Zargaran A (). „Use of herbal remedies among patients undergoing hemodialysis”. Iran Journal of Kidney Diseases. 11 (1): 101–12. PMID 23883087.
- ^ Birdee GS, Phillips RS, Brown RS (). „Use of Complementary and Alternative Medicine among Patients with End-Stage Renal Disease”. Evidence-Based Complementary and Alternative Medicine. 2013: 1–6. doi:10.1155/2013/654109. PMC 3655568
 . PMID 23710227.
. PMID 23710227.
- ^ „Vitamin Deficiency Anemia”. Mayo Clinic.
- ^ Pirklbauer M (iulie 2020). „Hemodialysis treatment in patients with severe electrolyte disorders: Management of hyperkalemia and hyponatremia”. Hemodialysis International. International Symposium on Home Hemodialysis. 24 (3): 282–289. doi:10.1111/hdi.12845. PMC 7496587
 . PMID 32436307.
. PMID 32436307.
- ^ „Dialysate sodium levels for chronic haemodialysis”. www.cochrane.org (în engleză). Accesat în .
- ^ The Ottawa Hospital (TOH). Guide: Treatment options for chronic kidney disease. Ottawa, Ontario:The Ottawa Hospital Riverside Campus;2008
- ^ „Bicarbonate- versus lactate-buffered solutions for acute continuous haemodiafiltration or haemofiltration”. www.cochrane.org (în engleză). Accesat în .
- ^ Cheung AK (august 1990). „Biocompatibility of hemodialysis membranes”. Journal of the American Society of Nephrology. 1 (2): 150–61. PMID 2104259.
- ^ Andersson J, Ekdahl KN, Lambris JD, Nilsson B (mai 2005). „Binding of C3 fragments on top of adsorbed plasma proteins during complement activation on a model biomaterial surface”. Biomaterials. 26 (13): 1477–85. doi:10.1016/j.biomaterials.2004.05.011. PMID 15522749.
- ^ Eknoyan G, Beck GJ, Cheung AK, et al. (). „Effect of dialysis dose and membrane flux in maintenance hemodialysis”. New England Journal of Medicine. 347 (25): 2010–9. doi:10.1056/NEJMoa021583. PMID 12490682.
- ^ Cheung AK, Levin NW, Greene T, et al. (). „Effects of high-flux hemodialysis on clinical outcomes: results of the HEMO study”. Journal of the American Society of Nephrology. 14 (12): 3251–63. doi:10.1097/01.ASN.0000096373.13406.94
 . PMID 14638924.
. PMID 14638924.
- ^ Macleod AM, Campbell M, Cody JD, Daly C, Donaldson C, Grant A, et al. (iulie 2005). MacLeod AM, ed. „Cellulose, modified cellulose and synthetic membranes in the haemodialysis of patients with end-stage renal disease”. The Cochrane Database of Systematic Reviews (3): CD003234. doi:10.1002/14651858.CD003234.pub2. PMID 16034894.
- ^ Locatelli F, Martin-Malo A, Hannedouche T, et al. (). „Effect of Membrane Permeability on Survival of Hemodialysis Patients”. J Am Soc Nephrol. 20 (3): 645–54. doi:10.1681/ASN.2008060590. PMC 2653681
 . PMID 19092122.
. PMID 19092122.
- ^ van Ypersele de Strihou C, Jadoul M, Malghem J, Maldague B, Jamart J (). „Effect of dialysis membrane and patient's age on signs of dialysis-related amyloidosis. The Working Party on Dialysis Amyloidosis”. Kidney International. 39 (5): 1012–9. doi:10.1038/ki.1991.128. PMID 2067196.
- ^ KDOQI Clinical Practice Guidelines for Hemodialysis Adequacy, 2006 Updates. CPR 5. Arhivat în , la Wayback Machine.
- ^ Küchle C, Fricke H, Held E, Schiffl H (). „High-flux hemodialysis postpones clinical manifestation of dialysis-related amyloidosis”. American Journal of Nephrology. 16 (6): 484–8. doi:10.1159/000169048. PMID 8955759.
- ^ Koda Y, Nishi S, Miyazaki S, et al. (). „Switch from conventional to high-flux membrane reduces the risk of carpal tunnel syndrome and mortality of hemodialysis patients”. Kidney International. 52 (4): 1096–101. doi:10.1038/ki.1997.434. PMID 9328951.
- ^ Locatelli F, Mastrangelo F, Redaelli B, et al. (). „Effects of different membranes and dialysis technologies on patient treatment tolerance and nutritional parameters. The Italian Cooperative Dialysis Study Group”. Kidney International. 50 (4): 1293–302. doi:10.1038/ki.1996.441. PMID 8887291.
- ^ KDOQI Clinical Practice Guidelines for Hemodialysis Adequacy, 2006 Updates Arhivat în , la Wayback Machine.. CPR 5.
- ^ Strain N. „Dialysis Tech”. Dialysis Clinic.
- ^ Pfuntner A, Wier LM, Stocks C (octombrie 2013). Most Frequent Procedures Performed in U.S. Hospitals, 2011. HCUP Statistical Brief #165 (Raport). Rockville, MD.: Agency for Healthcare Research and Quality.
- ^ Graham T. The Bakerian lecture: on osmotic force. Philosophical Transactions of the Royal Society in London. 1854;144:177–228.
- ^ Abel JJ, Rowntree LG, Turner BB (). „On the removal of diffusible substances from the circulating blood by means of dialysis”. Transactions of the Association of American Physicians. 28: 51.
- ^ Paskalev DN (decembrie 2001). „Georg Haas (1886-1971): The forgotten hemodialysis pioneer” (PDF). Dialysis and Transplantation. 30 (12): 828–32. Arhivat din original (PDF) la .
- ^ Kolff WJ, Berk HT, ter Welle M, van der Ley AJ, van Dijk EC, van Noordwijk J (decembrie 1997). „The artificial kidney: a dialyser with a great area. 1944”. Journal of the American Society of Nephrology. 8 (12): 1959–65. PMID 9402100.
- ^ McKellar S (noiembrie 1999). „Gordon Murray and the artificial kidney in Canada”. Nephrology, Dialysis, Transplantation. 14 (11): 2766–70. doi:10.1093/ndt/14.11.2766
 . PMID 10534530.
. PMID 10534530.
- ^ University of Lund website: Nils Alwall. Arhivat în , la Wayback Machine.
- ^ Shaldon S. Development of Hemodialysis, From Access to Machine (presentation given during a symposium entitled: Excellence in Dialysis: Update in Nephrology; Karachi, Pakistan. October, 2002, as archived on HDCN
- ^ „NIDDK Contributions to Dialysis”. Arhivat din original la . Accesat în .
- ^ Kjellstrand CM. History of Dialysis, Men and Ideas. Talk given to the Nordic Nephrology Days Symposium, Lund, 1997, as archived on HDCN.
Legături externe
[modificare | modificare sursă]![]() Materiale media legate de hemodializa la Wikimedia Commons
Materiale media legate de hemodializa la Wikimedia Commons
- en Rinichii dumneavoastră și modul în care aceștia funcționează - Institutul Național de Diabet și Boli Digestive și Renale (NIDDK), NIH.
- en Metode de tratament pentru insuficiență renală – Institutul Național de Diabet și Boli Digestive și Renale (NIDDK), NIH.
- en Metode de tratament pentru insuficiență renală: Hemodializa – Informații de la Institutul National de Rinichi și Boli Urologice Clearinghouse, NIH.
