Acetonă
| Acetonă | |
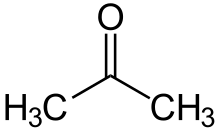 | |
| Nume IUPAC | Propanonă |
|---|---|
| Alte denumiri | Acetonă, Dimetilcetonă |
| Identificare | |
| Număr CAS | 67-64-1 |
| ChEMBL | CHEMBL14253 |
| PubChem CID | 180 |
| Informații generale | |
| Formulă chimică | C3H6O |
| Aspect | lichid incolor |
| Masă molară | 58,08 g/mol |
| Proprietăți | |
| Densitate | 0,7899 g/cm3 |
| Starea de agregare | lichidă |
| Punct de topire | -95 °C |
| Punct de fierbere | 56,5 °C |
| Presiune de vapori | 180 de millimetre of mercuryi |
| Indice de refracție(nD) | 1,3588 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acetona (cunoscută și sub denumirea de propanonă sau dimetilcetonă) este cea mai simplă cetonă. Este un lichid incolor cu miros caracteristic, fiind utilizat ca solvent organic și ca reactant într-o serie de procese de termoliză și reacții de sinteză în chimia organică. Ea face parte din grupa cetonelor, caracteristic pentru structura acetonei este gruparea carbonilică de care se leagă două grupări metil.
Proprietăți[modificare | modificare sursă]
Este un lichid incolor cu miros dulceag în concentrații mai ridicate înțepător, ușor inflamabil, în combinație cu aerul formează un amestec explosiv. Se amestecă în orice proporție cu apa și majoritatea solvenților.

Tautomerie ceto-enolică[modificare | modificare sursă]
Structura ceto (CH
3)
2C=O e în echilibru cu structura enol (CH
3)C(OH)=(CH
2). In acetonă vapori la temperatura ambientală, doar 0.00000024% din molecule sunt sub formă enol.[2]
Obținere[modificare | modificare sursă]
- Forma uzuală de obținere a acetonei constă în combinarea benzenului cu propena sau 2-cloropropan, cu obținerea izopropilbenzenului (cumenul) iar prin oxidare se formează hiperperoxid de cumen (R-O-OH) care în mediu acid se descompune în fenol și acetonă:
- O altă metodă de obținere se face prin deshidratarea și oxidarea la încălzire a alcoolului izopropilic C3H8O.
- A treia posibilitate de obținere este încălzirea acetatului de calciu care se descompune în acetonă și oxid de calciu:
Reacții[modificare | modificare sursă]
Exemplu caracteristic a formei de reacție a acetonei este acea cu combinațiile iodului:
La legătura dublă C=C se leagă iodul:
Următoarea fază este formarea din nou a grupării cetonice cu formare de hidrogen iodat:
Combustie[modificare | modificare sursă]
(CH3)2CO + 4O2 → 3CO2 + 3H2O
Utilizare[modificare | modificare sursă]
Acetona este folosită ca substanță solvent cu ajutorul căreia se extrage rășina, lipidele,uleiurile, colofoniul, acetatul de celuloză ca și în cosmetică pentru înlăturarea lacului de pe unghii. În acetonă se dizolvă ușor gazul acetilenă, ea mai este folosită în chimia organică în reacțiile de sinteză numite reacții de aldoadiție sau aldocondensare cu formare de pildă de alcool diacetonic C6H12O2
Acetona, împreună cu peroxidul de hidrogen (H2O2) este folosită la obținerea explosivului peroxid de acetonă (APEX, DADP sau TATP) (dimer: C6H12O4, trimer: C9H18O6).
Note[modificare | modificare sursă]
- ^ „Acetonă”, acetone (în engleză), PubChem, accesat în
- ^ Hine, Jack; Arata, Kazushi (). „Keto-Enol Tautomerism. II. The Calorimetrical Determination of the Equilibrium Constants for Keto-Enol Tautomerism for Cyclohexanone and Acetone”. Bulletin of the Chemical Society of Japan. 49 (11): 3089–3092. doi:10.1246/bcsj.49.3089
 .
.
Bibliografie[modificare | modificare sursă]
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 12
| ||||||||









