Fenol
| Fenol | |
 | |
 | |
 | |
| Nume IUPAC | Fenol |
|---|---|
| Alte denumiri | Acid carbolic Benzenol Hidroxibenzol Acid fenic/fenilic |
| Identificare | |
| Număr CAS | 108-95-2 |
| ChEMBL | CHEMBL14060 |
| PubChem CID | 20488062 996, 20488062 |
| Informații generale | |
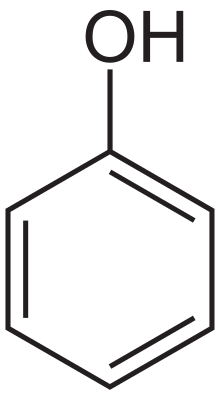
| Formulă chimică | C6H6O sau C6H5OH |
| Aspect | cristale albe, prin oxidare gălbui portocalii |
| Masă molară | 94,042 u.a.m.[1] |
| Proprietăți | |
| Densitate | 1,06 g/cm³ |
| Punct de topire | 109 Fahrenheiti |
| Punct de fierbere | 181,9 °C |
| Solubilitate | bună în apă |
| Presiune de vapori | 0,2 hPa (20 °C) |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Fenolul, de asemenea cunoscut și ca acid carbolic sau acid fenic, este un compus organic aromatic cu formula moleculară C6H5OH, fiind primul reprezentant al clasei fenolilor. Este un compus solid, cristalin, de culoare albă și volatil. Molecula este formată dintr-o grupare fenil (-C6H5) legată de o grupare hidroxil (-OH). Este ușor acid, și trebuie manipulat cu mare grijă deoarece poate cauza arsuri.
Grupa fenolilor
[modificare | modificare sursă]Fenolii, derivați ai fenolului, sunt compuși în care grupa funcțională -OH este legată de un atom de carbon aparținând unui nucleu aromatic. Numele fenolilor se formează prin adăugarea prefixului hidroxi- la numele hidrocarburii aromatice sau prin adăugarea sufixului -ol la rădăcina numelui hidrocarburii și ei fac parte din grupa fenolilor.
Proprietăți
[modificare | modificare sursă]Fenolul este de fapt un benzen la care s-a substituit o grupare hidroxilică, de acea are un caracter ușor acid. El are punctul de topire de ca 41 °C și punctul de fiebere de 182 °C. La temperatura camerei apare sub formă de cristale incolore care prin oxidare sau impurități pot avea o culoare roz până la roșu brun. Fenolul are un miros înțepător caracterisic aromat.In contrast cu alcoolii aromatici fenolii nu au caracter nucleofil de substituție, fiind ușor electronofil în poziția „para”, fenolul este de circa 1000 de ori mai activ ca benzenul.
Utilizare
[modificare | modificare sursă]Sir Joseph Lister folosește pentru prima oară fenolul în anul 1865 ca antiseptic la dezinfecția rănilor, dar din cauza caracterului iritant a fost înlocuit în chirurgie de alte antiseptice. Fenolul are un efect caustic asupra membranei celulei nervoase. Din cauza efectului bactericid se folosea ca dezinfectant, fiind folosit și la cultivarea plantelor producătoare de droguri ca ierbicid. Fenolul mai este folosit la producerea rășinilor artificiale ca bachelita care este un policondensat al fenolului și formaldehidei. În timpul celui de-al Doilea Război Mondial, prizonierii erau omorâți în lagărele germane cu injecții intracardiace cu fenol. La construcțiile de lemn se folosește adezivul format din fenol-rezorcină-formaldehidă.
Obținere
[modificare | modificare sursă]Sunt cunoscute mai multe metode de obținere a fenolului dintre care două metode sunt mai răspândite:
- Metoda oxidării cumenului (Sinteza fenolului după metoda Hock):
- Metoda acidului benzensulfonic cu hidroxid de sodiu (topirea alcalină a sărurilor acizilor sulfonici aromatici):




