Trimetilamină
| Trimetilamină | |
 | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 75-50-3 |
| ChEMBL | CHEMBL439723 |
| PubChem CID | 1146 |
| Formulă chimică | C₃H₉N[1] |
| Masă molară | 59,073 u.a.m.[1] |
| Punct de topire | −179 °F[2] |
| Punct de fierbere | 37 °F[2] |
| Solubilitate | 48 g/100 g[2] |
| Presiune de vapori | 1.454 mm Hg[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
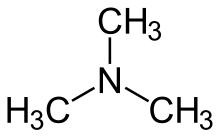
Trimetilamina (TMA) este un compus organic, o amină terțiară cu formula chimică N(CH3)3. Este un gaz (la temperatură ambientală) incolor, higroscopic și inflamabil. Se comercializează de obicei sub formă de soluție de concentrație 40%.[3] La concentrați mari prezintă un miros asemănător cu cel al amoniacului[4] și poate cauza necrozarea mucoaselor prin contact.[5]
Obținere
[modificare | modificare sursă]Trimetilamina se obține în urma reacției catalitice dintre amoniac și metanol:[3]
În urma reacției se mai obțin și dimetilamină (CH3)2NH și metilamină CH3NH2, ca produși secundari:
Se mai poate aplica și o reacție dintre clorura de amoniu și paraformaldehidă:[6]
Proprietăți chimice
[modificare | modificare sursă]Compusul prezintă caracter bazic, așadar poate fi protonat cu obținerea cationului de trimetilamoniu. Clorura de trimetilamoniu este un solid higroscopic și se prepară în urma reacției dintre trimetilamină și acid clorhidric:
Trimetilamina este un bun agent nucleofil, reacțiile sale având diverse aplicații în industria chimică: sinteza colinei, hidroxidului de tetrametilamoniu, a erbicidelor, a rășinilor schimbătoare de ioni cu caracter bazic și a unor coloranți bazici.[3][7]
Note
[modificare | modificare sursă]- ^ a b c „Trimetilamină”, trimethylamine (în engleză), PubChem, accesat în
- ^ a b c d http://www.cdc.gov/niosh/npg/npgd0636.html Lipsește sau este vid:
|title=(ajutor) - ^ a b c A. B. van Gysel, W. Musin „Methylamines” din Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. doi:10.1002/14356007.a16_535
- ^ „Trimetilamină”. Siad.com. Accesat în .
- ^ „Trimethylamine [MAK Value Documentation, 1983]”, The MAK-Collection for Occupational Health and Safety, Wiley-VCH Verlag GmbH & Co. KGaA, , pp. 1–9, doi:10.1002/3527600418.mb7550e0914, ISBN 978-3527600410
- ^ Roger Adams, B. K. Brown, „Trimethylamine”, Org. Synth.; Collective Volume, 1, p. 75
- ^ Ashford's Dictionary of Industrial Chemicals (ed. 3rd). . p. 9362. ISBN 978-0-9522674-3-0.





