Tiazol
| Tiazol | |
 | |
 | |
 | |
| Nume IUPAC | 1,3-tiazol |
|---|---|
| Identificare | |
| Număr CAS | 288-47-1 |
| ChEMBL | CHEMBL15605 |
| PubChem CID | 9256 |
| Informații generale | |
| Formulă chimică | C3H3NS |
| Aspect | lichid galben pal |
| Masă molară | 85,12 g/mol |
| Punct de fierbere | 116 - 118 °C |
| Fraze R | R10, R22, R36/37/38 |
| Fraze S | S26, S36/37 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
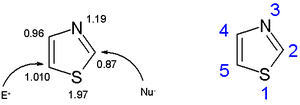
Tiazolul sau 1,3-tiazolul este un compus heterociclic ce conține azot și sulf, iar compușii derivați ai săi alcătuiesc familia tiazolilor. Tiazolul este un lichid galben pal cu un miros asemănător cu cel al piridinei și cu formula moleculară C3H3NS.[1] Nucleul tiazolic intră în structura tiaminei (vitaminei B1).
Structură[modificare | modificare sursă]
Tiazolii fac parte din familia azolilor, compuși hetereociclici care includ imidazolii și oxazolii. Tiazolii sunt asemănători din punct de vedere structural cu imidazolii, în care sulful tiazolic este înlocuit de un atom de azot. Nucleele tiazolice sunt planare și aromatice. Tiazolii sunt caracterizați printr-o delocalizare a electronilor pi mai mare decât în cazul oxazolilor analogi, având astfel o aromaticitate mai mare.
Sinteză[modificare | modificare sursă]
Există mai multe metode de a sintetiza în laborator tiazolul. Una dintre acestea, metoda Hantzsch (1889), presupune reacția dintre halocetone și tioamide. De exemplu, 2,4-dimetiltiazolul poate fi sintetizat din acetamidă, pentasulfură de fosfor și cloroacetonă.[2] Un alt exemplu [3] este reprezentat mai jos:
Biosinteza[modificare | modificare sursă]
În cadrul ființelor vii, nucleul tiazolic este utilizat în cadrul biosintezei de tiamină (vitamina B1).[4] Atomul de sulf din tiazol este derivat de la cisteină.
Referințe[modificare | modificare sursă]
- ^ Eicher, T.; Hauptmann, S. (). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications. ISBN 3-527-30720-6.
- ^ Schwarz, G. (), „2,4-Dimethylthiazole”, Org. Synth., 25: 35; Collective Volume, 3, p. 332
- ^ Alajarín, M.; Cabrera, J.; Pastor, A.; Sánchez-Andrada, P.; Bautista, D. (). „On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes”. J. Org. Chem. 71 (14): 5328–5339. doi:10.1021/jo060664c. PMID 16808523.
- ^ Kriek, M.; Martins, F.; Leonardi, R.; Fairhurst, S. A.; Lowe, D. J.; Roach, P. L. (). „Thiazole Synthase from Escherichia coli: An Investigation of the Substrates and Purified Proteins Required for Activity in vitro” (pdf). J. Biol. Chem. 282 (24): 17413–17423. doi:10.1074/jbc.M700782200. PMID 17403671.