Imagistică prin rezonanță magnetică
| Acest articol are nevoie de atenția unui expert în domeniu. Recrutați unul sau, dacă sunteți în măsură, ajutați chiar dumneavoastră la îmbunătățirea articolului! |
| Calitatea informațiilor sau a exprimării din acest articol sau secțiune trebuie îmbunătățită. Consultați manualul de stil și îndrumarul, apoi dați o mână de ajutor. Acest articol a fost etichetat în februarie 2016 |
Imagistica prin rezonanță magnetică (IRM), cunoscută și sub numele de tomografie prin rezonanță magnetică (TRM) sau imagistică prin rezonanță magnetică nucleară (RMN), este o tehnică non-invazivă de imagistică medicală utilizată pentru a investiga anatomia și procesele fiziologice ale corpului uman, în ambele cazuri de sănătate sau boală. Scanerele IRM utilizează câmpuri magnetice puternice, unde radio și gradienți de câmp pentru a forma imagini ale corpului.
Nu implică raze X și utilizarea radiațiilor ionizante, ceea ce o deosebește de scanarea CT sau CAT. Imagistica prin rezonanță magnetică este o aplicație medicală de rezonanță magnetică nucleară (RMN). RMN poate fi, de asemenea, utilizat pentru imagistică în alte aplicații IRM, cum ar fi spectroscopia IRM.

În timp ce pericolele cauzate de razele X sunt acum controlate în cele mai multe contexte medicale, IRM poate fi văzută ca o alegere mai bună decât o scanare CT. IRM este utilizat pe scară largă în spitale și clinici pentru diagnosticul medical, stadializarea bolii și urmărirea fără a expune corpul la radiații. Cu toate acestea, IRM-ul poate furniza adesea informații de diagnostic diferite în comparație cu CT. Pot exista riscuri și disconfort asociate scanărilor IRM. În comparație cu scanările CT, examinările IRM durează de obicei mai mult și sunt mai puternice și, totodată, au nevoie ca subiectul să intre într-un tub îngust. În plus, persoanele cu unele implante medicale sau alte metale nedemontabile din interiorul corpului nu ar putea să fie supuse unei examinări IRM în siguranță.
Anumite nuclee atomice sunt capabile să absoarbă și să emită energie de frecvență radio atunci când sunt plasate într-un câmp magnetic extern. În RMN-ul clinic și de cercetare, atomii de hidrogen sunt cel mai adesea folosiți pentru a genera un semnal detectabil de frecvență radio care este recepționat de către antene în imediata apropiere a anatomiei examinate. Atomii de hidrogen sunt abundenți în mod natural în oameni și în alte organisme biologice, în special în apă și grăsimi. Din acest motiv, cele mai multe scanări RMN vizează, în esență, locația apei și a grăsimilor din organism. Impulsurile undelor radio excizează tranziția energiei nucleare de spin, iar gradientele câmpului magnetic localizează semnalul în spațiu. Prin modificarea parametrilor secvenței pulsului, se pot genera contraste diferite între țesuturi pe baza proprietăților de relaxare ale atomilor de hidrogen din acestea.
De la dezvoltarea sa în anii 1970 și 1980, RMN sa dovedit a fi o tehnică extrem de versatilă de imagistică. În timp ce IRM este cel mai vizibil utilizat în medicina de diagnostic și în cercetarea biomedicală, ea poate fi utilizată și pentru a forma imagini cu obiecte ne-vii. Scanările RMN sunt capabile să producă o varietate de date chimice și fizice, în plus față de imagini spațiale detaliate. Creșterea susținută a cererii de RMN în cadrul sistemelor de sănătate a condus la preocupări legate de eficacitatea costurilor și de diagnosticul excesiv.[1][2]
Un câmp magnetic puternic (BO) pentru prima data aliniazǎ spinii fiecărui atom ai corpului uman (hidrogenul este utilizat în IRM-clinica) precesie într-o frecvență centrală care este dependentă de intensitatea câmpului magnetic. Pe măsură ce câmpul magnetic este îndreptat în jos de centrul mașinii de IRM, protonii hidrogenului se aliniaza fie către capul sau picioarele pacientului, cu aproximație 50% mergând către fiecare, anulându-se reciproc in mod eficient. Un număr foarte mic de protoni sunt de neegalat și nu sunt anulați, circa 1 la 2 la un milion. Apoi, un puls (B1) de frecvență radio (FR) care este specific pentru hidrogen, este aplicat de către mașina de IRM către partea corpului ce trebuie examinat. Acest puls face ca protonii neegalați să se rotească într-o direcție diferită la o frecvență specifică ([frecvența Larmor]). Totodată, o serie de magneți de gradient pedalează on și off, creind un gradient magnetic, care schimbǎ principalul câmp magnetic la un nivel specific, permițând imaginilor transversale să fie achiziționate. Atunci când pulsul FR încetează, ionii de hidrogen se întorc la starea lor nativă și eliberează energia absorbită de la impulsuri. Această emisie cu putere redusă (în intervalul pW) este detectată de bobinele receptoare în IRM și sunt trimise la un calculator, unde o transformare Fourier inversată (TFI) convertește semnalul de la protoni în date matematice (k-spațiu) într-o poză care poate fi interpretată de către clinician. Tehnica este utilizată pe scară largă în spitale pentru diagnostice medicale, stadializarea bolii și urmărirea fără expunere a corpului la radiații ionizante.
Mecanism[modificare | modificare sursă]
Constructie si fizica[modificare | modificare sursă]

Pentru a efectua un studiu, persoana este poziționată într-un scaner RMN care formează un câmp magnetic puternic în jurul zonei care va fi înregistrată. În majoritatea aplicațiilor medicale, protonii (atomii de hidrogen) din țesuturile care conțin molecule de apă creează un semnal care este procesat pentru a forma o imagine a corpului. În primul rând, energia dintr-un câmp magnetic oscilant este temporar aplicată pacientului la frecvența de rezonanță corespunzătoare. Atomii de hidrogen excitați emite un semnal de frecvență radio, care este măsurat printr-o bobină de recepție. Semnalul radio poate fi făcut pentru a codifica informațiile de poziție prin modificarea câmpului magnetic principal utilizând bobine de gradient. Pe măsură ce aceste bobine sunt activate și deconectate rapid, ele produc zgomotul repetitiv caracteristic unei scanări IRM. Contrastul dintre diferitele țesuturi este determinat de viteza la care atomii excitați revin la starea de echilibru. Agenții de contrast exogeni pot fi dat persoanei pentru a face imaginea mai clară.[3]
Componentele majore ale unui scaner IRM sunt magnetul principal care polarizează eșantionul, bobinele de ștanțare pentru corectarea schimbărilor în omogenitatea câmpului magnetic principal, sistemul de gradient care este utilizat pentru a localiza semnalul MR și sistemul RF, care excită proba și detectează semnalul RMN rezultat. Întregul sistem este controlat de unul sau mai multe computere.
RMN necesită un câmp magnetic care este atât puternic, cât și uniform. Forța de câmp a magnetului este măsurată în tesla - și în timp ce majoritatea sistemelor funcționează la 1,5 T, sistemele comerciale sunt disponibile între 0,2 și 7 T. Majoritatea magneților clinici sunt magneți superconductori, care necesită heliu lichid. Pozițiile inferioare ale câmpului pot fi atinse cu magneți permanenți, care sunt adesea utilizați în scanere IRM "deschise" pentru pacienții claustrofobi [4]. Recent, RMN a fost demonstrată și în domenii ultra-joase, adică în gama microtesla-to-millitesla, unde o calitate suficientă a semnalului este posibilă prin prepolarizare (de ordinul a 10-100 mT) și prin măsurarea câmpurilor de precesie Larmor la aproximativ 100 microtesla cu dispozitive de interferență superconductoare superconductoare (SQUID). [5][6][7]
T1 si T2[modificare | modificare sursă]
Fiecare țesut revine la starea sa de echilibru după excitație prin procesele de relaxare independente ale T1 (spin-lattice, adică magnetizarea în aceeași direcție cu câmpul magnetic static) și T2 (spin-spin, transversal la câmpul magnetic static). Pentru a crea o imagine ponderată T1, magnetizarea este permisă pentru a se recupera înainte de a măsura semnalul MR modificând timpul de repetare (TR). Această ponderare a imaginii este utilă pentru evaluarea cortexului cerebral, identificarea țesutului gras, caracterizarea leziunilor hepatice focale și, în general, pentru obținerea informațiilor morfologice, precum și pentru imagistica post-contrast. Pentru a crea o imagine ponderată T2, magnetizarea este permisă să se descompună înainte de a măsura semnalul MR modificând timpul de ecou (TE). Această ponderare a imaginii este utilă pentru detectarea edemelor și inflamațiilor, care dezvăluie leziuni ale materiei albe și evaluarea anatomiei zonale în prostată și uter.
Afișajul standard al imaginilor RMN reprezintă caracteristicile lichidului în imagini alb-negru, în care diferite țesuturi se dovedesc după cum urmează.
Diagnostic[modificare | modificare sursă]
Utilizare pentru diagnosticul unor organe sau sisteme[modificare | modificare sursă]
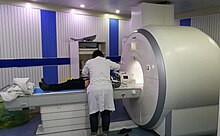
IRM are o gamă largă de aplicații în diagnosticul medical și se estimează că mai mult de 25.000 de scanere se utilizează în întreaga lume[8]. RMN afectează diagnosticul și tratamentul în multe specialități, deși efectul asupra rezultatelor îmbunătățite ale sănătății este incert[9][10].
RMN este investigarea alegerii în stadializarea preoperatorie a cancerului rectal și a prostatei și are un rol în diagnosticarea, stadializarea și urmărirea altor tumori.
RMN-ul are o gama larga de aplicații în diagnosticul medical și peste 25,000 de scanere sunt estimate a fi în utilizare în întreaga lume.[11] RMN-ul are un impact asupra diagnosticului si tratamentului în mai multe specialități, deși efectul asupra rezultatelor de sănătate îmbunatatite este incert.[12] Din moment ce RMN-ul nu utilizează radiații ionizante, utilizarea sa este, în general, favorizată în defavoarea CT-ului, chiar dacă ambele modalități ar putea aduce aceeași informație.[13] (În anumite cazuri, RMN-ul nu este preferat deoarece poate fi mai scump, s-ar pierde mai mult timp, și s-ar produce exacerbarea claustrofobica).
RMN-ul este, în general, o tehnica sigură, dar numărul de incidente care provoacă daune pacientului a crescut.[14] Contraindicațiile RMN-ului includ majoritatea implanturilor cohleare și stimulatoare cardiace, schije și corpuri metalice străine în ochi. Siguranța RMN-ului în timpul primului trimestru de sarcină este incert, dar ar putea fi de preferat în locul altor opțiuni.[15] Creșterea crescută a cererii pentru RMN-uri în cadrul industriei de asistență medicală a dus la preocupări legate de eficiența costurilor și supradiagnosticare.[16][17]
Neuroimagistica[modificare | modificare sursă]

RMN-ul este instrumentul de investigare ales pentru cancere neurologice, deoarece are o rezoluție mai bună decât CT-ul și oferă o vizualizare mai bună a fosei posterioare. Contrastul dintre substanta gri/cenușie și substanta alba face ca RMN-ul sa fie cea mai bună alegere pentru multe condiții ale sistemului nervos central, cum ar fi bolile demielinizante, demența, boli cerebrovasculare, boli infecțioase și epilepsie. [18] Deoarece multe imagini sunt luate la intervale de milisecunde între ele, se arată cum creierul răspunde la diferiți stimuli; cercetătorii pot studia apoi ambele anomalii ale creierului (funcționale și structurale) din tulburările psihologice .[19] RMN-ul este, de asemenea, utilizat în chirurgia RMN-ghidata stereotactic și chirurgia radio pentru tratamentul tumorilor intracraniene, marformații arterio-venoase și alte condiții chirurgicale tratabile utilizând un dispozitiv cunoscut ca N-localizer .[20][21][22][23][24][25][26]
Cardiovascular[modificare | modificare sursă]
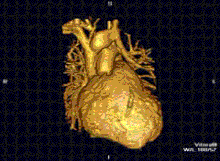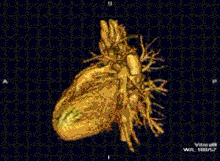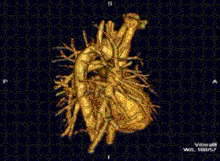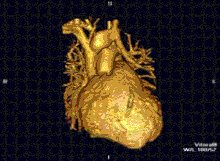
RMN-ul cardiac este complementar altor tehnici imagistice, cum ar fi ecocardiografia, CT-ul cardiac și medicina nucleară. Aplicațiile sale includ evaluarea ischemiei miocardice și viabilitatea, cardiomiopatii, miocardite, supraîncarcarea/supradozarea cu fier, boli vasculare și boli cardiace congenitale.[27]
Musculo-scheletice[modificare | modificare sursă]
Aplicațiile din sistemul musculo-scheletic includ imagistica măduvei spinării, evaluarea bolilor articulare și tumori ale țesuturilor moi. [28]
RMN la nivelul ficatului și la nivelul gastro-intestinal[modificare | modificare sursă]
RMN-ul hepatobiliar este folosit pentru a detecta și caracteriza leziuni ale canalelor hepatice, pancreatice și biliare. Tulburările focale sau difuze pot fi evaluate utilizând difuzia-ponderata, imagistica fazelor-opuse și secventele dinamice cu contrast înbunătățit. Agenții de contrast extracelulari sunt utilizați pe scară largă în RMN-ul ficatului și agenții hepatobiliari de contrast mai noi de asemenea dau posibilitatea de a efectua imagistica biliară functională. Imagisitica anatomică a canalelor hepatobiliare este realizată utilizând o secvență T2-concentrată semnificativ în rezonanța magnetică colangiopancreatografică (MRCP). Imagistica funcțională a pancreasului este realizată urmărind administrarea secretinei. Enterografia-RMN oferă o evaluare non-invazivă a bolilor inflamatorii intestinale și a tumorilor intestinului subțire. Colonografia-RMN poate juca un rol în detectarea de polipi mari la pacienții cu risc crescut de cancer colorectal.[29][30][31][32]
RMN funcțional[modificare | modificare sursă]
RMN funcțional (fRMN) este folosit pentru a înțelege cum diferite părți ale creierului răspund la stimuli exteriori sau la activități pasive într-o stare de repaus. Nivelul dependent de oxigenare a sângelui (BOLD) - RMN măsoară răspunsul hemodinamic la activitatea neuronală tranzitorie care rezultă dintr-o schimbare a raportului dintre oxihemoglobină și deoxihemoglobină. Metodele statistice sunt utilizate pentru a construi o hartă parametrică 3D a creierului indicând regiunile cortexului care demonstrează o schimbare semnificativă a activității, ca răspuns la sarcină. fRMN are aplicații în domeniul cercetării comportamentului uman și in cel cognitiv, precum și în planificarea neurochirurgiei din zone elocvente ale creierului. [33][34]
Angiografie[modificare | modificare sursă]
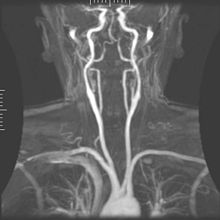
Rezonantele magnetice (MRA) generează imagini ale arterelor pentru a le evalua pentru stenoză (îngustare anormală) sau anevrisme (dilatări ale peretelui vascular, expuse riscului ruperii). MRA este adesea folosit pentru a evalua arterele gâtului și creierului, aorta toracică și abdominală, arterele renale și picioarele (numită "run-off"). O varietate de tehnici pot fi utilizate pentru generarea imaginilor, cum ar fi administrarea unui agent de contrast paramagnetic (gadoliniu) sau folosind o tehnică cunoscută sub denumirea de "îmbunătățire în legătură cu fluxul" (de exemplu, secvențe 2D și 3D de timp de zbor) cea mai mare parte a semnalului de pe o imagine se datorează sângelui care sa mutat recent în acel avion (vezi, de asemenea, RMN FLASH). Tehnicile care implică acumularea de faze (cunoscute sub numele de angiografie cu contrast de fază) pot fi, de asemenea, folosite pentru a genera hărți ale vitezei de curgere cu ușurință și cu precizie. Rezonanța cu rezonanță magnetică (MRV) este o procedură similară utilizată pentru a imagina vene. În această metodă, țesutul este acum excitat inferior, în timp ce semnalul este adunat în planul imediat superior celui de excitație - imaginând astfel sângele venos care sa mutat recent de pe planul excitat.
Agenti de contrast[modificare | modificare sursă]
RMN pentru imagistica structurilor anatomice sau a fluxului sanguin nu necesită agenți de contrast deoarece diferitele proprietăți ale țesuturilor sau sângelui asigură contraste naturale. Cu toate acestea, pentru tipurile mai specifice de imagistică, agenții de contrast exogeni pot fi administrați intravenos, oral sau intraarticular. [3] Cele mai frecvent utilizate agenți de contrast intravenos se bazează pe chelați ai gadoliniumului [35] În general, acești agenți s-au dovedit mai siguri decât agenții de contrast iodați utilizați în radiografia cu raze X sau CT. Reacțiile anafilactoide sunt rare, aparând în aproximativ. 0,03-0,1%. [36] Un interes deosebit îl reprezintă incidența mai mică a nefrotoxicității, comparativ cu medicamentele iodate, atunci când este administrată în doze uzuale - acest lucru a făcut ca RMN-ul să mărească contrastul cu o opțiune pentru pacienții cu insuficiență renală, care altfel nu ar putea suferi CT cu contrast crescut.[37]
Deși agenții gadolinici s-au dovedit utili la pacienții cu insuficiență renală, la pacienții cu insuficiență renală severă care necesită dializă există riscul unei boli rare, dar grave, fibrozei sistemice nefrogenice, care poate fi legată de utilizarea anumitor agenți care conțin gadoliniu. Cel mai frecvent legat este gadodiamida, dar și alți agenți au fost legați.[38] Deși nu a fost stabilită definitiv o legătură de cauzalitate, orientările actuale din Statele Unite sunt că pacienții dializați ar trebui să primească numai agenți gadolinici acolo unde este esențial și că dializa trebuie efectuată cât mai curând posibil după scanare pentru a îndepărta prompt agentul din organism.[39][40] În Europa, unde sunt disponibili mai mulți agenți care conțin gadoliniu, a fost eliberată o clasificare a agenților în funcție de riscurile potențiale.[41][42] Recent, un nou agent de contrast numit gadoxetate, denumirea comercială Eovist (SUA) sau Primovist (UE), a fost aprobat pentru utilizare de diagnostic: acesta are avantajul teoretic al unei căi duale de excreție.[43]
Secvente[modificare | modificare sursă]
O secvență RMN este o setare specială a impulsurilor și gradientilor de radiofrecvență, rezultând într-un aspect particular al imaginii. [44] De asemenea, ponderarea T1 și T2 poate fi descrisă ca secvențe RMN.
Acest tabel nu include secvențe neobișnuite și experimentale.
Alte configuratii specializate[modificare | modificare sursă]
Spectroscopia cu rezonanță magnetică[modificare | modificare sursă]
Spectroscopia cu rezonanță magnetică (MRS) este utilizată pentru a măsura nivelurile diferitelor metaboliți în țesuturile corpului. Semnalul MR produce un spectru de rezonanțe care corespunde aranjamentelor moleculare diferite ale izotopului fiind "excitat". Această semnătură este utilizată pentru a diagnostica anumite tulburări metabolice, în special cele care afectează creierul [45] și pentru a furniza informații despre metabolismul tumoral[46].
Imagistica spectroscopică prin rezonanță magnetică (MRSI) combină atât metode spectroscopice, cât și metode imagistice pentru a produce spectre localizate spațial din interiorul eșantionului sau pacientului. Rezoluția spațială este mult mai mică (limitată de SNR disponibilă), dar spectrele din fiecare voxel conțin informații despre mulți metaboliți. Deoarece semnalul disponibil este folosit pentru a codifica informații spațiale și spectrale, MRSI necesită un SNR înalt, realizabil doar la intensități mai mari ale câmpului (3 T și peste).
RMN în timp real[modificare | modificare sursă]
RMN în timp real se referă la monitorizarea continuă ("filmare") a obiectelor în mișcare în timp real. Deși multe strategii diferite au fost dezvoltate de la începutul anilor 2000, o evoluție recentă a raportat o tehnică în timp real a RMN bazată pe FLASH radial și reconstrucție iterativă, care oferă o rezoluție temporală de 20 până la 30 de milisecunde pentru imagini cu o rezoluție în plan de 1,5 2,0 mm. Noua metodă promite să adauge informații importante despre afecțiunile articulațiilor și inimii. În multe cazuri, examinările RMN pot deveni mai ușoare și mai confortabile pentru pacienți. [47]
MRI interventional[modificare | modificare sursă]
Lipsa de efecte dăunătoare asupra pacientului și a operatorului fac RMN bine adaptate pentru radiologia intervențională, în cazul în care imaginile produse de un scanner IRM ghidează proceduri minim invazive. Astfel de proceduri trebuie să se facă fără instrumentele feromagnetice.[48]
Un subgrup specializat de creștere a RMN-ului intervențional este IRM intraoperator, în care medicii folosesc un RMN în chirurgie. Unele sisteme MRI specializate permit imagistica concomitentă cu procedura chirurgicală. Mai tipic, totuși, este că procedura chirurgicală este întreruptă temporar, astfel încât RMN poate verifica succesul procedurii sau poate ghida operația chirurgicală ulterioară.[49]
Rezonanța magnetică ghidată cu ultrasunete[modificare | modificare sursă]
În terapia cu MRgFUS, fasciculele cu ultrasunete sunt focalizate pe un ghid țesut și controlat utilizând imagistica termică MR și datorită depunerii semnificative a energiei la foc, temperatura în țesut crește până la 65 ° C (150 ° F), distrugând complet aceasta. Această tehnologie poate realiza o ablație precisă a țesutului bolnav. Imagistica MR oferă o vedere tridimensională a țesutului țintă, permițând o focalizare precisă a energiei cu ultrasunete. Imagistica MR oferă imagini termice cantitative, în timp real, ale zonei tratate. Acest lucru permite medicului să se asigure că temperatura generată în timpul fiecărui ciclu de energie cu ultrasunete este suficientă pentru a provoca ablația termică în țesutul dorit și, dacă nu, pentru a adapta parametrii pentru a asigura un tratament eficient[50].
Imagistica multinucleară[modificare | modificare sursă]
Hidrogenul este cel mai frecvent imaginat nucleu în RMN, deoarece este prezent în țesuturile biologice în mare abundență și datorită raportului ridicat giromagnetic, care dă un semnal puternic. Cu toate acestea, orice nucleu cu spin net nuclear ar putea fi imaginat cu RMN. Astfel de nuclee includ heliu-3, litiu-7, carbon-13, fluor-19, oxigen-17, sodiu-23, fosfor-31 și xenon-129. 23Na și 31P sunt în mod natural abundente în organism, astfel încât pot fi imaginate direct. Izotopii gazoși cum ar fi 3He sau 129Xe trebuie hiperpolarizați și apoi inhalați, deoarece densitatea lor nucleară este prea mică pentru a obține un semnal util în condiții normale. 17O și 19F pot fi administrate în cantități suficiente în formă lichidă (de ex. 17O-apă) că hiperpolarizarea nu este o necesitate. Utilizarea heliului sau a xenonului are avantajul unui zgomot de fond redus și, prin urmare, deoarece aceste elemente nu sunt prezente în mod normal în țesuturile biologice. [51]
Mai mult decât atât, nucleul oricărui atom care are o rotație nucleară netă și care este legat la un atom de hidrogen ar putea fi imaginat prin RMN de transfer de magnetizare heteronucleară care ar imagina nucleul hidrogen cu raport ridicat de giromagnetică în locul nucleului cu raport scăzut giromagnetic care este legat de atomul de hidrogen.[52] În principiu, RMN-ul de transfer de magnezie hetereo-nucleară ar putea fi utilizat pentru a detecta prezența sau absența legăturilor chimice specifice. [53][54]
Imagistica multi-nucleară este în prezent o tehnică de cercetare în prezent. Cu toate acestea, aplicațiile potențiale includ imagistică funcțională și imagistică a organelor văzute prost pe IRM 1H (de exemplu, plămâni și oase) sau ca agenți alternativi de contrast. Inhalația hipopolarizată 3He poate fi utilizată pentru a imagina distribuția spațiilor de aer în plămâni. Soluțiile injectabile conținând 13C sau bulele stabilizate de 129Xe hiperpolarizate au fost studiate ca agenți de contrast pentru angiografie și perfuzie. 31P poate furniza informații despre densitatea și structura osoasă, precum și despre imagistica funcțională a creierului. Imagistica multilinucleară deține potențialul de a schimba distribuția de litiu în creierul uman, găsind acest element ca un medicament important pentru cei cu afecțiuni cum ar fi tulburarea bipolară.
Imagistica moleculară prin RMN[modificare | modificare sursă]
IRM are avantajul de a avea o rezoluție spațială foarte mare și este foarte apt la imagistica morfologică și imagistică funcțională. IRM are însă mai multe dezavantaje. În primul rând, RMN are o sensibilitate de aproximativ 10-3 mol / l la 10-5 mol / l, care, în comparație cu alte tipuri de imagini, poate fi foarte limitator. Această problemă rezultă din faptul că diferența de populație dintre stările de spin nucleare este foarte mică la temperatura camerei. De exemplu, la 1,5 teslas, o intensitate tipică a câmpului pentru RMN clinic, diferența dintre stările de energie ridicată și cea redusă este de aproximativ 9 molecule la 2 milioane. Îmbunătățirile pentru creșterea sensibilității la MR includ creșterea intensității câmpului magnetic și hiperpolarizarea prin pompare optică sau polarizare nucleară dinamică. Există, de asemenea, o varietate de scheme de amplificare a semnalului bazate pe schimbul chimic care măresc sensibilitatea.
Pentru a realiza imagistica moleculară a biomarkerilor de boală utilizând RMN, sunt necesare agenți de contrast orientați RMN cu specificitate ridicată și relaxivitate ridicată (sensibilitate). Până în prezent, multe studii au fost dedicate dezvoltării de agenți de contrast orientați-RMN pentru a realiza imagistica moleculară prin IRM. În mod obișnuit, au fost aplicate peptide, anticorpi sau liganzi mici și domenii de proteină mică, cum ar fi agenți HER-2, pentru a realiza țintirea. Pentru a spori sensibilitatea agenților de contrast, aceste fragmente de țintire sunt, de obicei, legate de agenți de contrast MRI cu încărcături utile sau agenți de contrast MRI cu relaxivități ridicate.[55] O nouă clasă de agenți de contrast MR (MR) care au fost vizate de gene a fost introdusă pentru a arăta acțiunea genetică a proteinelor mARN unice și a factorilor de transcripție genetică[56][57] Acest CA nou poate urmări celulele cu ARNm unic, microRNA și virus; răspunsul țesutului la inflamația creierului viu.[58] Rapoartele MR schimbă expresia genică cu corelație pozitivă cu analiza TaqMan, microscopia optică și electronică.
Economie[modificare | modificare sursă]

În Marea Britanie, prețul unui scanner clinic de 1,5-tesla IRM este de aproximativ 920.000 de lire sterline / 1,4 milioane de dolari, costul de întreținere de-a lungul vieții fiind similar cu cel al costului de achiziție [74]. În Olanda, scanerul mediu IRM costă aproximativ 1 milion de euro, [75] cu un RMN 7-T fiind utilizat de UMC Utrecht în decembrie 2007, costând 7 milioane de euro. [76] Construirea de apartamente MRI ar putea costa până la 500.000 USD / 370.000 € sau mai mult, în funcție de domeniul de aplicare al proiectului. Sistemele RMN pre-polarizate (PMRI) care utilizează electromagneți rezistenți au arătat promisiunea ca o alternativă ieftină și au avantaje specifice pentru imagistica articulară în apropierea implanturilor metalice, cu toate acestea ele sunt probabil nepotrivite pentru aplicații de rutină întregi sau neuroimagistice.
Scanerele IRM au devenit surse importante de venit pentru furnizorii de asistență medicală din SUA. Acest lucru se datorează ratelor favorabile de rambursare de la asigurători și de la programele guvernamentale federale. Rambursarea rambursării este furnizată în două componente, o taxă pentru echipamente pentru performanța și funcționarea efectivă a scanării RMN și o taxă profesională pentru revizuirea de către radiolog a imaginilor și / sau datelor. În nord-estul SUA, o taxă pentru echipament ar putea fi de 3.500 de dolari / 2.600 de euro, iar o taxă profesionistă ar putea fi de 350 $ / 260 €, [79] deși taxele efective primite de proprietarul echipamentului și medicul de interpret sunt adesea mult mai mici și depind de ratele negociate cu companiile de asigurari sau determinate de programul de taxe Medicare. De exemplu, un grup de chirurgi ortopedici din Illinois a facturat o taxă de 1,116 USD / 825 USD pentru un RMN pentru genunchi în 2007, însă rambursarea în Medicare în 2007 a fost de numai 470,91 / 350 EUR. [80] Multe companii de asigurări solicită aprobarea în avans a unei proceduri RMN ca o condiție pentru acoperire.
În SUA, Legea privind reducerea deficitului din 2005 a redus în mod semnificativ ratele de rambursare plătite de programele federale de asigurare pentru componenta de echipament a mai multor scanări, schimbând peisajul economic. Mulți asigurători privați au urmat exemplul. [Citare necesară]
În SUA, un RMN al creierului, cu și fără contrast, facturat la Medicare Part B, implică, în medie, o plată tehnică de 403 USD / 300 EUR și o plată separată a radiologului de 93 USD / 70 EUR. [81] În Franța, costul unui examen RMN este de aproximativ 150 EUR / 205 USD. Aceasta acoperă trei scanări de bază, inclusiv unul cu un agent de contrast intravenos, precum și o consultare cu tehnicianul și un raport scris către medicul pacientului. [82] În Japonia, costul unei examinări RMN (excluzând costul materialului de contrast și al filmelor) variază de la 155 USD / 115 EUR la 180 USD / 133 EUR, cu o taxă suplimentară pentru radiolog profesionist de 17 USD / 12,50 EUR. În India, costul unui examen RMN, inclusiv taxa pentru opinia radiologului, se situează în jurul valorii de Rs 3000-4000 (37-49 EUR / 50-60 USD), excluzând costul materialului de contrast. În Marea Britanie, prețul de vânzare cu amănuntul pentru o scanare RMN variază în mod privat între 350 și 700 de lire sterline (405-810 euro). [84]
Siguranță[modificare | modificare sursă]
RMN este, în general, o tehnică sigură, deși pot apărea vătămări ca urmare a unor proceduri de siguranță nereușite sau a unei erori umane[59]. Contraindicațiile la IRM includ majoritatea implanturilor cohleare și stimulatoare cardiace, șrapnel și corpuri străine metalice în ochi. Siguranța RMN în timpul primului trimestru de sarcină este incertă, dar poate fi preferabilă altor opțiuni.[60] Deoarece RMN nu utilizează nici o radiație ionizantă, utilizarea sa este în general favorizată, mai degrabă în comparație cu CT, atunci când oricare dintre modalități ar putea genera aceleași informații.[13] În anumite cazuri, RMN nu este preferată, deoarece poate fi mai costisitoare, consumatoare de timp și excesiv de claustrofobie.
IRM utilizează magneți puternici și, prin urmare, poate face ca materialele magnetice să se deplaseze la viteze mari care prezintă riscuri. Au avut loc decese.
Societățile medicale stabilesc proceduri pentru medicii care ar trebui să utilizeze IRM pe pacienți și nu recomandă utilizarea excesivă. RMN poate detecta probleme de sănătate sau poate confirma un diagnostic, însă societățile medicale recomandă adesea ca RMN să nu fie prima procedură pentru crearea unui plan de diagnosticare sau gestionare a plângerii unui pacient. Un caz comun este utilizarea IRM pentru a căuta o cauză a durerii la nivelul spatelui; Colegiul American de Medici, de exemplu, recomandă împotriva acestei proceduri ca fiind puțin probabil să ducă la un rezultat pozitiv pentru pacient.[61]
Artefacte[modificare | modificare sursă]

Artefactul RMN este un artefact vizual, adică o anomalie în timpul reprezentării vizuale. Multe artefacte diferite pot apărea în timpul imaginii prin rezonanță magnetică (RMN), unele afectând calitatea diagnosticului, în timp ce altele pot fi confundate cu patologia. Artefactele pot fi clasificate ca fiind legate de pacient, dependente de prelucrarea semnalului și legate de hardware (mașină).[62] Artefactele rămân problematice în imagistica prin rezonanță magnetică (IRM). Unele afectează calitatea examinării, în timp ce altele pot fi confundate cu patologia.
Utilizare non-medicala[modificare | modificare sursă]
RMN este utilizat industrial în principal pentru analiza de rutină a substanțelor chimice. Tehnica de rezonanță magnetică nucleară este, de asemenea, utilizată, de exemplu, pentru a măsura raportul dintre apă și grăsime din alimente, monitorizarea fluxului de fluide corozive în țevi sau pentru a studia structurile moleculare, cum ar fi catalizatorii. [63]
Fiind neinvazivă și nedăunătoare, IRM poate fi utilizată pentru a studia anatomia plantelor, procesele de transport al apei și echilibrul hidric al acestora. De asemenea, se aplică în radiologia veterinară în scopuri de diagnosticare.[64] În afara acesteia, utilizarea sa în zoologie este limitată din cauza costului ridicat; dar poate fi folosită la multe specii.[65]
În paleontologie este folosit pentru a examina structura fosilelor.[66]
Imagistica medico-legală oferă o documentație grafică a unei autopsii, ceea ce nu oferă autopsia manuală. Scanarea CT oferă o imagistică rapidă a întregului corp a alterărilor scheletice și parenchimatoase, în timp ce imagistica RMN oferă o reprezentare mai bună a patologiei țesuturilor moi.[67] Dar IRM este mai scumpă și necesită mai mult timp pentru a fi utilizată. În plus, calitatea imagisticii RM se deteriorează sub 10 °C.[68]
Istoric[modificare | modificare sursă]
La sfarsitul anilor '70, fizicienii Peter Mansfield si Paul Lauterbur au dezvoltat tehnici legate de IRM, cum ar fi tehnica echo-planar imagistica (EPI). [69] Mansfield și Lauterbur au primit Premiul Nobel pentru Fiziologie sau Medicină din 2003 pentru "descoperirile privind imagistica prin rezonanță magnetică".
Referințe[modificare | modificare sursă]
- ^ Format:Irrelevant citationSmith-Bindman R, Miglioretti DL, Johnson E, Lee C, Feigelson HS, Flynn M, et al. (iunie 2012). „Use of diagnostic imaging studies and associated radiation exposure for patients enrolled in large integrated health care systems, 1996-2010”. JAMA. 307 (22): 2400–9. doi:10.1001/jama.2012.5960. PMC 3859870
 . PMID 22692172.
. PMID 22692172.
- ^ Health at a glance 2009 OECD indicators. Health at a Glance. . doi:10.1787/health_glance-2009-en. ISBN 978-92-64-07555-9.
- ^ a b McRobbie DW (). MRI from picture to proton. Cambridge, UK; New York: Cambridge University Press. ISBN 978-0-521-68384-5.
- ^ „Guildford company gets FDA approval for bedside MRI”. New Haven Register. . Arhivat din original la . Accesat în .
- ^ McDermott R, Lee S, ten Haken B, Trabesinger AH, Pines A, Clarke J (mai 2004). „Microtesla MRI with a superconducting quantum interference device”. Proceedings of the National Academy of Sciences of the United States of America. 101 (21): 7857–61. Bibcode:2004PNAS..101.7857M. doi:10.1073/pnas.0402382101
 . PMC 419521
. PMC 419521  . PMID 15141077.
. PMID 15141077.
- ^ Zotev VS, Matlashov AN, Volegov PL, Urbaitis AV, Espy MA, Kraus RH (). „SQUID-based instrumentation for ultralow-field MRI”. Superconductor Science and Technology. 20 (11): S367–73. arXiv:0705.0661
 . Bibcode:2007SuScT..20S.367Z. doi:10.1088/0953-2048/20/11/S13.
. Bibcode:2007SuScT..20S.367Z. doi:10.1088/0953-2048/20/11/S13.
- ^ Vesanen PT, Nieminen JO, Zevenhoven KC, Dabek J, Parkkonen LT, Zhdanov AV, et al. (iunie 2013). „Hybrid ultra-low-field MRI and magnetoencephalography system based on a commercial whole-head neuromagnetometer”. Magnetic Resonance in Medicine. 69 (6): 1795–804. doi:10.1002/mrm.24413. PMID 22807201.
- ^ „Magnetic Resonance, a critical peer-reviewed introduction”. European Magnetic Resonance Forum. Accesat în .
- ^ Consumer Reports; American College of Physicians. presented by ABIM Foundation. „Five Things Physicians and Patients Should Question” (PDF). Choosing Wisely. Arhivat din original (PDF) la . Accesat în .
- ^ Consumer Reports; American College of Physicians (aprilie 2012). „Imaging tests for lower-back pain: Why you probably don't need them” (PDF). High Value Care. Arhivat din original (PDF) la . Accesat în .
- ^ "Magnetic Resonance, a critical peer-reviewed introduction".
- ^ Hollingworth W, Todd CJ, Bell MI, Arafat Q, Girling S, Karia KR, Dixon AK (2000).
- ^ a b „iRefer”. Royal College of Radiologists. Arhivat din original la . Accesat în .
- ^ "Manufacturer and User Facility Device Experience".
- ^ Wang PI, Chong ST, Kielar AZ, Kelly AM, Knoepp UD, Mazza MB, Goodsitt MM (2012).
- ^ Heavey S, Costa H, Pye H, Burt EC, Jenkinson S, Lewis GR, et al. (mai 2019). „PEOPLE: PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens”. The Prostate. 79 (7): 768–777. doi:10.1002/pros.23782. PMC 6618051
 . PMID 30807665.
. PMID 30807665.
- ^ Heavey S, Haider A, Sridhar A, Pye H, Shaw G, Freeman A, Whitaker H (octombrie 2019). „Use of Magnetic Resonance Imaging and Biopsy Data to Guide Sampling Procedures for Prostate Cancer Biobanking”. Journal of Visualized Experiments (152). doi:10.3791/60216
 . PMID 31657791.
. PMID 31657791.
- ^ American Society of Neuroradiology (2013).
- ^ Nolen-Hoeksema, Susan (2014).
- ^ Brown RA, Nelson JA (2012).
- ^ Brown RA, Nelson JA (2015).
- ^ Brown RA (2015).
- ^ Brown RA (2015).
- ^ Leksell L, Leksell D, Schwebel J (1985).
- ^ Thomas DG, Davis CH, Ingram S, Olney JS, Bydder GM, Young IR (1986).
- ^ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH Jr, Cosman E, Ganz E (1987).
- ^ "ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 Appropriateness Criteria for Cardiac Computed Tomography and Cardiac Magnetic Resonance Imaging".
- ^ Helms, C (2008).
- ^ Frydrychowicz A, Lubner MG, Brown JJ, Merkle EM, Nagle SK, Rofsky NM, Reeder SB (2012).
- ^ Sandrasegaran K, Lin C, Akisik FM, Tann M (2010).
- ^ Masselli G, Gualdi G (2012).
- ^ Zijta FM, Bipat S, Stoker J (2010).
- ^ Giussani C, Roux FE, Ojemann J, Sganzerla EP, Pirillo D, Papagno C (2010).
- ^ Heeger DJ, Ress D (2002).
- ^ Rinck PA (). „Chapter 13: Contrast Agents”. Magnetic Resonance in Medicine.
- ^ Murphy KJ, Brunberg JA, Cohan RH (octombrie 1996). „Adverse reactions to gadolinium contrast media: a review of 36 cases”. AJR. American Journal of Roentgenology. 167 (4): 847–9. doi:10.2214/ajr.167.4.8819369
 . PMID 8819369.
. PMID 8819369.
- ^ „ACR guideline”. guideline.gov. . Arhivat din original la . Accesat în .
- ^ Thomsen HS, Morcos SK, Dawson P (noiembrie 2006). „Is there a causal relation between the administration of gadolinium based contrast media and the development of nephrogenic systemic fibrosis (NSF)?”. Clinical Radiology. 61 (11): 905–6. doi:10.1016/j.crad.2006.09.003. PMID 17018301.
- ^ „FDA Drug Safety Communication: New warnings for using gadolinium-based contrast agents in patients with kidney dysfunction”. Information on Gadolinium-Based Contrast Agents. U.S. Food and Drug Administration. . Accesat în .
- ^ „FDA Public Health Advisory: Gadolinium-containing Contrast Agents for Magnetic Resonance Imaging”. fda.gov. Arhivat din original la .
- ^ „Gadolinium-containing contrast agents: new advice to minimise the risk of nephrogenic systemic fibrosis”. Drug Safety Update. 3 (6): 3. ianuarie 2010.
- ^ „MRI Questions and Answers” (PDF). Concord, CA: International Society for Magnetic Resonance in Medicine. Accesat în .
- ^ „Response to the FDA's May 23, 2007, Nephrogenic Systemic Fibrosis Update1 — Radiology”. Radiological Society of North America. . Arhivat din original la . Accesat în .
- ^ Jones J, Gaillard F. „MRI sequences (overview)”. Radiopaedia. Accesat în .
- ^ Landheer K, Schulte RF, Treacy MS, Swanberg KM, Juchem C (aprilie 2020). „Theoretical description of modern 1 H in Vivo magnetic resonance spectroscopic pulse sequences”. Journal of Magnetic Resonance Imaging. 51 (4): 1008–1029. doi:10.1002/jmri.26846. PMID 31273880.
- ^ Golder W (iunie 2004). „Magnetic resonance spectroscopy in clinical oncology”. Onkologie. 27 (3): 304–9. doi:10.1159/000077983. PMID 15249722.
- ^ Uyanik I, Lindner P, Tsiamyrtzis P, Shah D, Tsekos NV, Pavlidis IT (). Functional Imaging and Modeling of the Heart. Lecture Notes in Computer Science. 7945. pp. 466–473. doi:10.1007/978-3-642-38899-6_55. ISBN 978-3-642-38898-9. ISSN 0302-9743.
- ^ Lewin JS (mai 1999). „Interventional MR imaging: concepts, systems, and applications in neuroradiology”. AJNR. American Journal of Neuroradiology. 20 (5): 735–48. PMC 7056143
 . PMID 10369339.
. PMID 10369339.
- ^ Sisk JE (). The Gale Encyclopedia of Nursing and Allied Health (ed. 3rd). Farmington, MI: Gale. ISBN 9781414498881 – via Credo Reference.
- ^ Cline HE, Schenck JF, Hynynen K, Watkins RD, Souza SP, Jolesz FA (). „MR-guided focused ultrasound surgery”. Journal of Computer Assisted Tomography. 16 (6): 956–65. doi:10.1097/00004728-199211000-00024. PMID 1430448.
- ^ Sisk JE (). The Gale Encyclopedia of Nursing and Allied Health (ed. 3rd). Farmington, MI: Gale. ISBN 9781414498881 – via Credo Reference.
- ^ Hurd RE, John BK (). „Gradient-enhanced proton-detected heteronuclear multiple-quantum coherence spectroscopy”. Journal of Magnetic Resonance. 91 (3): 648–53. Bibcode:1991JMagR..91..648H. doi:10.1016/0022-2364(91)90395-a.
- ^ Brown RA, Venters RA, Tang PP, Spicer LD (). „A Test for Scaler Coupling between Heteronuclei Using Gradient-Enhanced Proton-Detected HMQC Spectroscopy”. Journal of Magnetic Resonance, Series A. 113 (1): 117–19. Bibcode:1995JMagR.113..117B. doi:10.1006/jmra.1995.1064.
- ^ Miller AF, Egan LA, Townsend CA (martie 1997). „Measurement of the degree of coupled isotopic enrichment of different positions in an antibiotic peptide by NMR”. Journal of Magnetic Resonance. 125 (1): 120–31. Bibcode:1997JMagR.125..120M. doi:10.1006/jmre.1997.1107. PMID 9245367.
- ^ Xue S, Qiao J, Pu F, Cameron M, Yang JJ (). „Design of a novel class of protein-based magnetic resonance imaging contrast agents for the molecular imaging of cancer biomarkers”. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 5 (2): 163–79. doi:10.1002/wnan.1205. PMC 4011496
 . PMID 23335551.
. PMID 23335551.
- ^ Liu CH, Kim YR, Ren JQ, Eichler F, Rosen BR, Liu PK (ianuarie 2007). „Imaging cerebral gene transcripts in live animals”. The Journal of Neuroscience. 27 (3): 713–22. doi:10.1523/JNEUROSCI.4660-06.2007. PMC 2647966
 . PMID 17234603.
. PMID 17234603.
- ^ Liu CH, Ren J, Liu CM, Liu PK (ianuarie 2014). „Intracellular gene transcription factor protein-guided MRI by DNA aptamers in vivo”. FASEB Journal. 28 (1): 464–73. doi:10.1096/fj.13-234229. PMC 3868842
 . PMID 24115049.
. PMID 24115049.
- ^ Liu CH, You Z, Liu CM, Kim YR, Whalen MJ, Rosen BR, Liu PK (martie 2009). „Diffusion-weighted magnetic resonance imaging reversal by gene knockdown of matrix metalloproteinase-9 activities in live animal brains”. The Journal of Neuroscience. 29 (11): 3508–17. doi:10.1523/JNEUROSCI.5332-08.2009. PMC 2726707
 . PMID 19295156.
. PMID 19295156.
- ^ Watson RE (). „Lessons Learned from MRI Safety Events”. Current Radiology Reports. 3 (10). doi:10.1007/s40134-015-0122-z.
- ^ Mervak BM, Altun E, McGinty KA, Hyslop WB, Semelka RC, Burke LM (martie 2019). „MRI in pregnancy: Indications and practical considerations”. Journal of Magnetic Resonance Imaging. 49 (3): 621–631. doi:10.1002/jmri.26317. PMID 30701610.
- ^ Mansouri M, Aran S, Harvey HB, Shaqdan KW, Abujudeh HH (aprilie 2016). „Rates of safety incident reporting in MRI in a large academic medical center”. Journal of Magnetic Resonance Imaging. John Wiley and Sons. 43 (4): 998–1007. doi:10.1002/jmri.25055. PMID 26483127.
- ^ Erasmus LJ, Hurter D, Naude M, Kritzinger HG, Acho S (). „A short overview of MRI artefacts”. South African Journal of Radiology. 8 (2): 13. doi:10.4102/sajr.v8i2.127
 .
.
- ^ Rinck PA (). „Chapter Nineteen Non-Medical Applications of NMR and MRI”. Magnetic Resonance (ed. 11th). Accesat în .
- ^ Van As H (). „Intact plant MRI for the study of cell water relations, membrane permeability, cell-to-cell and long distance water transport”. Journal of Experimental Botany. Oxford University Press (OUP). 58 (4): 743–56. doi:10.1093/jxb/erl157
 . PMID 17175554.
. PMID 17175554.
- ^ Ziegler A, Kunth M, Mueller S, Bock C, Pohmann R, Schröder L, Faber C, Giribet G (). „Application of magnetic resonance imaging in zoology”. Zoomorphology. Springer Science and Business Media LLC. 130 (4): 227–254. doi:10.1007/s00435-011-0138-8. hdl:11858/00-001M-0000-0013-B8B0-B
 . ISSN 0720-213X.
. ISSN 0720-213X.
- ^ Giovannetti G, Guerrini A, Salvadori PA (iulie 2016). „Magnetic resonance spectroscopy and imaging for the study of fossils”. Magnetic Resonance Imaging. Elsevier BV. 34 (6): 730–742. doi:10.1016/j.mri.2016.03.010. PMID 26979538.
- ^ Filograna L, Pugliese L, Muto M, Tatulli D, Guglielmi G, Thali MJ, Floris R (februarie 2019). „A Practical Guide to Virtual Autopsy: Why, When and How”. Seminars in Ultrasound, CT, and MR. 40 (1): 56–66. doi:10.1053/j.sult.2018.10.011. PMID 30686369.
- ^ Ruder TD, Thali MJ, Hatch GM (aprilie 2014). „Essentials of forensic post-mortem MR imaging in adults”. The British Journal of Radiology. 87 (1036): 20130567. doi:10.1259/bjr.20130567. PMC 4067017
 . PMID 24191122.
. PMID 24191122.
- ^ Mansfield P, Grannell PK (). „"Diffraction" and microscopy in solids and liquids by NMR”. Physical Review B. 12 (9): 3618–34. Bibcode:1975PhRvB..12.3618M. doi:10.1103/physrevb.12.3618.

