Corticosuprarenala
| Corticosuprarenala (i.e. cortexul adrenal) | |
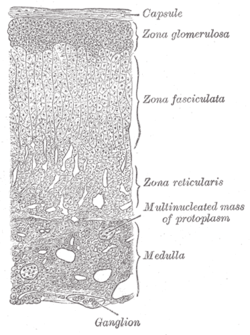 Straturile corticosuprarenalei | |
 Corticosuprarenala | |
| Detalii | |
|---|---|
| Latină | cortex glandulae suprarenalis |
| Originea embrionară | Mesoderm[1] |
| Parte din | Glandă suprarenală |
| Resurse externe | |
| Gray's | p.1278 |
| TA | A11.5.00.007 A13.2.03.005 |
| FMA | 15632 |
| Terminologie anatomică | |
Corticosuprarenala (cortexul suprarenal) reprezintă regiunea corticală (i.e. exterioară), alcătuind cea mai mare parte a glandei suprarenale. Este împărțită în trei zone separate: zona glomerulară (lat. zona glomerulosa), zona fasciculată (lat. zona fasciculata) și zona reticulară (lat. zona reticularis). Fiecare zonă este responsabilă pentru producția unor hormoni specifici. Reprezintă totodată un sit secundar de sinteză a hormonilor androgenilor.
Straturi[modificare | modificare sursă]
Cortexul suprarenal cuprinde trei straturi, reglate de hormoni diferiți, după cum se menționează mai jos. Această delimitare histologică poate fi observată la nivel microscopic, unde fiecare zonă poate fi recunoscută pe baza caracteristicilor structurale. [2]
- Zona glomerulară
- Stratul cel mai extern, zona glomerulară, este locul de producere al aldosteronului (un mineralocorticoid). Sinteza și secreția de aldosteron sunt reglate, în principal, de sistemul renină-angiotensină-aldosteron. Celulele zonei glomerulare exprimă o enzimă specifică - aldosteron sintaza (numită și CYP11B2). [3] [4] Aldosteronul este, în mare parte, responsabil pentru reglarea pe termen lung a presiunii arteriale.[5] Efectele aldosteronului se manifestă asupra tubului contort distal și ductului colector ai nefronului, crescând reabsorbția sodiului, alături de excreția potasiului (de către celulele principale) și a ionilor de hidrogen (de către celulele intercalate ale ductului colector). Totodată, ca răspuns la stimularea produsă de aldosteron, retenția de sodiu crește si la nivelul colonului distal și a glandelor sudoripare. Deși producția susținută de aldosteron necesită calciu, care intră în țesut prin canale de Ca2+ voltaj-dependente, celulele izolate din zona glomerulară sunt considerate inexcitabile, având un voltaj membranar prea mare (i.e. membrană hiperpolarizată) pentru a permite activarea canalelor de Ca2+.[6]
- Secreția de aldosteron este stimulată și de hormonul adrenocorticotrop (ACTH) [7], deși acesta are doar un rol permisiv - cantitatea de ACTH nu influențează cantitatea de aldosteron secretat. În schimb, absența totală de ACTH reduce drastic cantitatea secretată de aldosteron.[8]
- Zona fasciculată
- Situată între zona glomerulară și zona reticulară, celulele zonei fasciculate sintetizează și secretă glucocorticoizi, precum 11-deoxicorticosteronul, corticosteronul și cortizolul. La om, principalul hormon care stimulează secreția de cortizol este ACTH-ul, produs și eliberat de hipofiza anterioară.[7] S-a demonstrat că capacitatea steroidogenică a zonei fasciculate crește, la sugari, în timpul bolii.
- Zona reticulară
- Stratul cel mai intern al corticosuprarenalei, zona reticulară, produce, la om, hormoni androgeni, în principal dehidroepiandrosteron (DHEA), sulfat de dehidroepiandrosteron (DHEA-S) și androstendionă (precursorul testosteronului). Secreția de androgeni este stimulată și de ACTH. [7]
Sinteza hormonală[modificare | modificare sursă]

Precursorul steroizilor sintetizați în cortexul suprarenal este colesterolul care este stocat în vezicule. Colesterolul poate fi sintetizat de novo în cortexul suprarenal. Cu toate acestea, principala sursă de colesterol este colesterolul livrat de lipoproteinele circulante (LDL și HDL). [9]
Etapele specifice ce au loc la nivelul corticosuprarenalei, în vederea producerii aldosteronului și cortizolului, sunt:
- Progesteron → (hidroxilare la C21) → 11-Deoxicorticosteron → (alte două hidroxilări la C11 și C18) → Aldosteron
- Progesteron → (hidroxilare la C17) → 17-alfa-hidroxiprogesteron → (hidroxilare la C21) → 11-Deoxicortizol → (hidroxilare la C11) → Cortizol
Patologie[modificare | modificare sursă]
- Insuficiența suprarenală (hipoadrenalismul), numită și boala Addison, reprezintă hipoproducția de hormoni corticosuprarenali, fiind cel mai adesea cauzată de atrofia țesutului corticosuprarenal, ca urmare a unei boli autoimune.[10] În țările în curs de dezvoltare, boala Addison este cel mai adesea atribuită tuberculozei.[11] Simptomele cele mai importante pentru boala Addison sunt: deficiența de mineralocorticoizi (rezultând descreșterea marcată a lichidului extracelular, hiponatremie, hiperkaliemie, acidoză), deficiența de glucocorticoizi (tulburări în metabolismul energetic și oboseală, datorită gluconeogenezei deficitare, precum și datorită mobilizării deficitare a acizilor grași și proteinelor din țesuturi), și hiperpigmentație (datorată producției excesive de melanină ce se presupune că apare ca urmare a deteriorării sistemului de feedback-negativ cortisol-ACTH, acesta din urmă având același efect asupra melanocitelor ca MSH-ul).[10] Persoana netratată poate murit în decurs de câteva zile.[10]
- Hipersecreția de hormoni adrenocorticali se numește sindrom Cushing. Acesta poate apărea ca urmare a adenoamelor de la nivel pituitar, funcționării anormale a hipotalamusului, secreției ectopice sau adenoamelor adrenale (i.e. suprarenale).[10] Simptomele cele mai importante pentru sindromul Cushing sunt: hiperglicemia (ca urmare a gluconeogenezei excesive), pierdere proteică (în special din mușchi, neafectate rămân doar ficatul și etritrocitele), sistem imunitar deprimat și osteoporoză.[10] Persoanele cu sindrom Cushing prezintă pernuțe de grăsime pe spate ("cocoașa de bizon"), obezitate abdominală (abdomen "în pendul"), vergeturi, față hipertrofiată (în formă de lună plină) etc.[12]
- Aldosteronismul primar (i.e. sindromul Conn) apare ca urmare a hipersecreției de aldosteron cauzată de o tumoră în zona glomerulară a corticosuprarenalei.[10] În cazuri mai rare, poate fi cauzat de hiperplasticitatea țesutului corticosuprarenal,[10] când celulele secretoare de aldosteron capătă o pondere mai mare în totalul de celule corticosuprarenale față de normal. Principalul efect este hipokaliemia, care poate duce uneori la episoade de paralizie musculară. [10]
- Sindromul adrenogenital apare ca urmare a tumorilor corticosuprarenale, ce determină hipersecreția de hormoni androgeni. În cazul femeii, aceasta duce la dezvoltarea de caracteristici specifice masculine (voce groasă, păr facial, hipertrofia clitorisului etc.).[10] La copiii de sex masculin, apare dezvoltarea precoce a organului sexual, precum și a caracterelor sexuale secundare.[10] În cazul bărbaților, acest sindrom poate trece neobservat. [10]
Vezi și[modificare | modificare sursă]
Referințe[modificare | modificare sursă]
- ^ „Embryology of the adrenal gland”. Accesat în .
- ^ Whitehead, Saffron A.; Nussey, Stephen (). Endocrinology: an integrated approach. Oxford: BIOS. p. 122. ISBN 978-1-85996-252-7.
- ^ „The product of the CYP11B2 gene is required for aldosterone biosynthesis in the human adrenal cortex”. Mol. Endocrinol. 5 (10): 1513–22. octombrie 1991. doi:10.1210/mend-5-10-1513. PMID 1775135.
- ^ „Cloning and expression of a rat cytochrome P-450 11 beta-hydroxylase/aldosterone synthase (CYP11B2) cDNA variant”. Biochem. Biophys. Res. Commun. 194 (1): 112–7. iulie 1993. doi:10.1006/bbrc.1993.1792. PMID 8333830.
- ^ Marieb Human Anatomy & Physiology 9th edition, chapter:16, page:629, question number:14
- ^ „Zona glomerulosa cells of the mouse adrenal cortex are intrinsic electrical oscillators”. J. Clin. Invest. 122 (6): 2046–53. iunie 2012. doi:10.1172/JCI61996. PMC 3966877
 . PMID 22546854.
. PMID 22546854.
- ^ a b c „Selective increases in adrenal steroidogenic capacity during acute respiratory disease in infants”. Eur J Endocrinol. 133 (5): 552–6. . doi:10.1530/eje.0.1330552. PMID 7581984.
- ^ Hall, John E. (), Guyton and Hall textbook of medical physiology, Michael E. Hall (ed. Fourteenth edition), p. 962, ISBN 978-0-323-64003-9, OCLC 1159243083
- ^ „Cholesterol Biosynthesis and Trafficking in Cortisol-Producing Lesions of the Adrenal Cortex”. J Clin Endocrinol Metab. 100 (10): 3660–7. . doi:10.1210/jc.2015-2212. PMC 4596036
 . PMID 26204136.
. PMID 26204136.
- ^ a b c d e f g h i j k Guyton, Arthur C. (), Textbook of medical physiology, John E. Hall (ed. 10th ed), Saunders, pp. 880–883, ISBN 0-7216-8677-X, OCLC 43701921, accesat în
- ^ Grainger & Allison's diagnostic radiology : a textbook of medical imaging., Andy Adam, Adrian K. Dixon, Jonathan H. Gillard, Cornelia Schaefer-Prokop, David J. Allison (ed. Sixth edition), , p. 1031, ISBN 978-0-7020-6128-8, OCLC 871067912, accesat în
- ^ Salma, Shaik (), „Case Report on Steroid Induced Cushing Syndrome”, Journal of Drug Delivery and Therapeutics, 9 (4-s), pp. 598–600, doi:10.22270/jddt.v9i4-s.3269, ISSN 2250-1177, accesat în
