Punct critic (termodinamică)
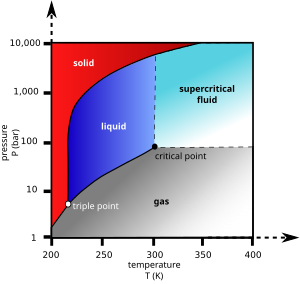

În termodinamică, se numește punct critic starea unui corp pur, caracterizată prin aceea că densitatea fazei lichide este egală cu densitatea fazei gazoase. Pe diagrama de stare presiune-temperatură, curba de echilibru lichid-gaz care începe în punctul triplu se termină în punctul critic, definit prin temperatura critică Tc și presiunea critică pc.
La punctul critic, căldura latentă de vaporizare este zero, iar toate proprietățile celor două faze (capacitate termică masică, indice de refracție etc.) devin identice. Pe diagrama de fază presiune-volum, izoterma critică T = Tc prezintă un punct de inflexiune, determinat de condițiile[1][2][3]
La temperaturi și presiuni care depășesc punctul critic, nu se mai pot distinge o fază lichidă și o fază gazoasă. Dacă temperatura și presiunea variază astfel încât punctul reprezentativ pe diagrama presiune-temperatură să se deplaseze fără a traversa curba de echilibru, în loc de o transformare de fază se observă o evoluție continuă (această evoluție continuă se numește transformare de fază de speța a doua sau de ordinul al doilea), de la proprietățile unui lichid (la presiune înaltă și temperatură relativ joasă) la proprietățile unui gaz. Materia în această stare este numită fluid supracritic. O transformare vizibilă de la faza lichidă la cea gazoasă (vaporizare) sau invers, de la gaz la lichid (condensare) are loc doar atunci când se traversează curba de echilibru.
Note
[modificare | modificare sursă]Bibliografie
[modificare | modificare sursă]- Enrico Fermi: Thermodynamics, Dover, 1956, pp. 63–69. ISBN-13: 978-0-486-60361-2, ISBN-10: 0-486-60361-X.
- Gregory H. Wannier: Statistical physics, Dover, 1966, pp. 251–255. ISBN 0-48665401-X.
Legături externe
[modificare | modificare sursă]- Équilibre liquide-vapeur, la www.sciences.univ-nantes.fr (accesat la 26 ianuarie 2018)
| |||||||||||||



