Oxidare Swern
Oxidarea Swern este o reacție de oxidare organică prin care are loc transformarea unui alcool primar sau secundar la o aldehidă sau o cetonă. Reacția a fost denumită după Daniel Swern și se realizează cu clorură de oxalil, dimetilsulfoxid (DMSO) și o bază organică, precum trietilamina (Et3N).[1][2][3] Reacția prezintă avantajul de a se desfășura în condiții blânde și de a avea o mare toleranță asupra multor grupe funcționale.[4][5][6][7]

Produșii secundari ai oxidării Swern sunt dimetilsulfură (Me2S), monoxid de carbon (CO), dioxid de carbon (CO2) și clorură de trietilamoniu (Et3NHCl, când se folosește trietilamina ca bază). Monoxidul de carbon este toxic, iar sulfura de dimetil are un miros puternic, de aceea reacția se face sub nișă.[8][9][10]
Mecanism de reacție[modificare | modificare sursă]
Prima etapă a mecanismului oxidării Swern este reacția dintre DMSO (1a), care prezintă structura de rezonanță 1b, cu clorura de oxalil (2). Primul intermediar obținut (3) se descompune rapid cu eliminare de dioxid de carbon și monoxid de carbon, obținându-se clorura de cloro(dimetil)sulfoniu (4).[11]
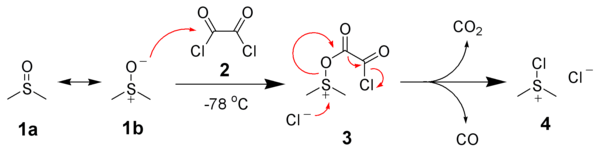
Apoi are loc adiția alcoolului (5) la clorura de cloro(dimetil)sulfoniu (4) cu obținerea unui ion intermediar alcoxi-sulfoniu (6) (la o temperatură de -78°C).[11] Prin adiția a cel puțin 2 echivalenți bazici - de obicei trietilamină - are loc deprotonarea ionul intermediar cu obținerea unei sulfilide (7). Prin intermediul unei stări de tranziție pentaciclice, sulfilida 7 se va descompune la sufură de dimetil și la compusul carbonilic corespunzător (8).[11]

Dacă temperatura de reacție nu este menținută în jurul valorii de -78°C, reacția poate evolua cu obținerea unor tioacetali micști.[11]
Note[modificare | modificare sursă]
- ^ Omura, K.; Swern, D. (). „Oxidation of alcohols by "activated" dimethyl sulfoxide. A preparative, steric and mechanistic study”. Tetrahedron. 34 (11): 1651–1660. doi:10.1016/0040-4020(78)80197-5.
- ^ Mancuso, A. J.; Brownfain, D. S.; Swern, D. (). „Structure of the dimethyl sulfoxide-oxalyl chloride reaction product. Oxidation of heteroaromatic and diverse alcohols to carbonyl compounds”. J. Org. Chem. 44 (23): 4148–4150. doi:10.1021/jo01337a028.
- ^ Mancuso, A. J.; Huang, S.-L.; Swern, D. (). „Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide "activated" by oxalyl chloride”. J. Org. Chem. 43 (12): 2480–2482. doi:10.1021/jo00406a041.
- ^ Dondoni, A.; Perrone, D. (), „Synthesis of 1,1-Dimethyl Ethyl-(S)-4-formyl-2,2-dimethyl-3-oxazolidinecarboxylate by Oxidation of the Alcohol”, Org. Synth.; Collective Volume, 10, p. 320
- ^ Bishop, R. (), „9-Thiabicyclo[3.3.1]nonane-2,6-dione”, Org. Synth.; Collective Volume, 9, p. 692
- ^ Leopold, E. J. (), „Selective hydroboration of a 1,3,7-triene: Homogeraniol”, Org. Synth.; Collective Volume, 7, p. 258
- ^ Tojo, G.; Fernández, M. (). Oxidation of alcohols to aldehydes and ketones: A guide to current common practice. Springer. ISBN 0-387-23607-4.
- ^ Mancuso, A. J.; Swern, D. (). „Activated dimethyl sulfoxide: Useful reagents for synthesis”. Synthesis (Review). 1981 (03): 165–185. doi:10.1055/s-1981-29377.
- ^ Tidwell, T. T. (). „Oxidation of alcohols to carbonyl compounds via alkoxysulfonium ylides: The Moffatt, Swern, and related oxidations”. Org. React. (Review). 39: 297–572. doi:10.1002/0471264180.or039.03.
- ^ Tidwell, T. T. (). „Oxidation of alcohols by activated dimethyl sulfoxide and related reactions: An update”. Synthesis (Review). 1990 (10): 857–870. doi:10.1055/s-1990-27036.
- ^ a b c d Organic Chemistry Portal, Swern Oxidation: the mechanism of the Swern Oxidation, accesat în
