Reacție Reimer-Tiemann
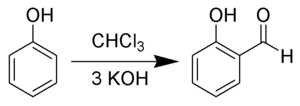
Reacția Reimer-Tiemann este o reacție organică utilizată pentru formilarea fenolilor în poziția orto, și se realizează cu cloroform în mediu de hidroxid de potasiu.[1][2][3][4][5] Cel mai simplu exemplu aplicabil este reacția de conversie a fenolului la aldehidă salicilică. Reacția a fost denumită după Karl Reimer (1845-1883)[6][7] și Ferdinand Tiemann (1848-1899).
Mecanism de reacție[modificare | modificare sursă]
Cloroformul (1) este deprotonat în mediul puternic bazic (de obicei realizat cu ajutorul unui hidroxid tare), formând un carbanion (2) care suferă ușor o alfa-eliminare cu obținerea diclorocarbenei (3). Această specie este intermediarul care va reacționa cu fenolul (4) de asemenea deprotonat în mediu bazic, care este de fapt ionul fenoxid (5). Sarcina negativă este delocalizată pe nucleul aromatic, ceea ce imprimă un caracter nucleofil pronunțat. Prin atacul nucleofil al diclorocarbenei se obține un intermediar fenol substituit cu diclorometil (7). După ce are loc o reacție de hidroliză bazică, se formează produsul final (9).[8]

Variante[modificare | modificare sursă]
Reacția Reimer-Tiemann este aplicabilă și altor compuși aromatici hidroxilați, precum sunt naftolii.[9]
Dacă în locul cloroformului se folosește tetraclorură de carbon, în urma reacției Reimer-Tiemann se pot obține în schimb acizi fenolici (de exemplu, din fenol se obține acid salicilic).[10]
Note[modificare | modificare sursă]
- ^ Reimer, K.; Tiemann, Ferd. (). „Ueber die Einwirkung von Chloroform auf Phenole und besonders aromatische Oxysäuren in alkalischer Lösung” [On the effect of chloroform on phenols and particularly aromatic oxyacids in alkaline solution]. Berichte der Deutschen Chemischen Gesellschaft. 9 (2): 1268–1278. doi:10.1002/cber.18760090270.
- ^ Wynberg, Hans (). „The Reimer-Tiemann Reaction”. Chemical Reviews. 60 (2): 169–184. doi:10.1021/cr60204a003.
- ^ Wynberg, Hans and Meijer, Egbert, Hans; Meijer, Egbert W. (). The Reimer–Tiemann Reaction. p. 14. doi:10.1002/0471264180.or028.01. ISBN 9780471264187.
- ^ Dauben, William G. (). „The Reimer-Tiemann Reaction”. Organic Reactions, Volume 28. Hoboken, NJ: Wiley-Interscience. pp. 1–36. doi:10.1002/0471264180.or028.01. ISBN 978-0471861416.
- ^ Wynberg, Hans (). The Reimer–Tiemann Reaction. Comprehensive Organic Synthesis. 2. pp. 769–775. doi:10.1016/B978-0-08-052349-1.00048-2. ISBN 978-0-08-052349-1.
- ^ Reimer, K. (). „Ueber eine neue Bildungsweise aromatischer Aldehyde” [On a new way of forming aromatic aldehydes]. Berichte der Deutschen Chemischen Gesellschaft (în German). 9: 423–424. doi:10.1002/cber.187600901134.
- ^ Reimer, Karl (1883) "Sitzung vom 22. Januar 1883". Berichte der deutschen chemischen Gesellschaft. 16, p. 101.
- ^ Hine, Jack; Van Der Veen, James M. (decembrie 1959). „The Mechanism of the Reimer-Tiemann Reaction”. Journal of the American Chemical Society. 81 (24): 6446–6449. doi:10.1021/ja01533a028.
- ^ Russell, Alfred; Lockhart, Luther B. (). „2-HYDROXY-1-NAPHTHALDEHYDE”. Organic Syntheses. 22: 63. doi:10.15227/orgsyn.022.0063.
- ^ Gaonkar, A.V.; Kirtany, J.K. (). „ChemInform Abstract: Reimer-Tiemann Reaction Using Carbon Tetrachloride”. ChemInform. 22 (41): 1991. doi:10.1002/chin.199141092.
