Bisulfit
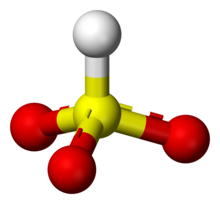
Un bisulfit (numit și hidrogenosulfit) este un anion cu formula HSO3−. Sărurile care conțin ionul de HSO3− sunt denumite bisulfiți, cunoscute și sub numele de leșii sulfitice. De exemplu, bisulfitul de sodiu are formula chimică NaHSO3.
Structură[modificare | modificare sursă]

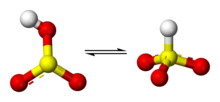
Unele dovezi sugerează că protonul din ionul bisulfit este situat pe stomul de sulf, dând naștere la o simetrie C3v. Cu toate acestea, există unele dovezi din spectroscopia 17O NMR care sugerezază că cele două forme tautomerice ale HSO3− coexistă în echilibru dinamic, unul în care un proton este atașat de sulf (HSO3−) și una care proton este atașat de oxigen (HOSO2−a).[1] Structura cu simetria C3v este susținută de cristalografia cu raze X, iar în soluție apoasă, de către spectroscopia Raman (ν(S–H) = 2500 cm-1).
Reacții[modificare | modificare sursă]
Sărurile de bisulfit sunt de obicei preparate în urma tratamentului soluțiilor alcaline cu exces de dioxid de sulf:
- SO2 + NaOH → NaHSO3
HSO3− este o bază conjugată al acidului sulfuros:
- H2SO3 ⇌ HSO3− + H+
Medicină[modificare | modificare sursă]
Sărurile de bisulfit sunt aditivi comuni pentru adrenalină, în scopul de a preveni oxidarea acesteia către adrenocrom, fapt care ar duce la inactivare. Uneori, bisulfiții pot provoca o reacție alergică. Acest lucru este diferit de alergiile la sulfamide comune. Cantitatea de bisulfit din antialgice, responsabilă de determinarea reacțiilor de hipersensibilitate de tip 1, a fost determinată de Fraser și Huang.[2]
Vezi și[modificare | modificare sursă]
Referințe[modificare | modificare sursă]
- ^ Horner, D. A.; Connick, R. E. (). „Equilibrium quotient for the isomerization of bisulfite ion from HSO3− to SO3H−”. Inorganic Chemistry. 25 (14): 2414–2417. doi:10.1021/ic00234a026. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor)Mai multe valori specificate pentru|DOI=și|doi=(ajutor) - ^ Fraser, W. A.; Huang, A. S. (). „Are sulfites additives really safe?”. New England Journal of Medicine. 311 (8): 542. doi:10.1056/NEJM198408233110824. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor)Mai multe valori specificate pentru|DOI=și|doi=(ajutor)
