Amoniac
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |
| Amoniac | |
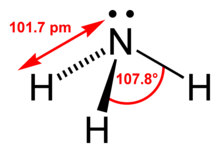 Structura moleculei de amoniac | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Soluție de amoniac |
| Identificare | |
| Număr CAS | 7664-41-7 |
| ChEMBL | CHEMBL1160819 |
| PubChem CID | 222 |
| Informații generale | |
| Formulă chimică | NH3 |
| Aspect | gaz incolor |
| Masă molară | 17 g/mol |
| Proprietăți | |
| Densitate | 0,7198 kg/m3 |
| Starea de agregare | gaz |
| Punct de topire | -77,73 |
| Punct de fierbere | -33,5 |
| Solubilitate | 541 g/l |
| Anion | Azot |
| Cation | Hidrogen |
| Duritate (Scara Mohs) | - |
| Presiune de vapori | 8,5 atmosferă fizicăi[2] |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Amoniacul este un compus chimic format dintr-un atom de azot și trei atomi de hidrogen. Denumirea provine de la clorura de amoniu, care a fost pentru prima dată descoperită în „Oaza lui Ammon” azi „Oaza Siwa”, Egipt. Starea de agregare a amoniacului fiind gazoasă, având proprietățile chimice unei baze, toxice cu miros înțepător, mai ușor ca aerul.
Amoniacul are un important rol, fiind precursor sau constituent al multor compuși organici, printre care se numără: aminele, amidele, aminoacizii (și de aici peptide, proteine) etc.
Proprietăți[modificare | modificare sursă]
Amoniacul este ușor solubil în apă la temperatura de 0 °C, se dizolvă 90,7 g amoniac în 100 ml de apă, soluție cu un miros înțepător și cu o reacție alcalină.
Amoniacul lichid dizolvă metale alcaline, alcalino-pământoase și aluminiu.
Amoniacul sub formă de gaz într-un amestec între 15,5 - 30 % cu aerul este exploziv. La contactul cu suprafețe cu o temperatură de peste 630 °C se descompune în apă și azot, reacție de descompunere care este catalizată prin prezența unui metal, care coboară temperatura de descompunere de la 630 °C la 300 °C.
Amoniacul gaz are acțiune caustică în contact cu suprafețele umede, fiind iritant al pielii, mucoaselor căilor respiratorii, digestive sau ochilor. O concentrație de amoniac de 0,5% în aerul inspirat produce în timp de 30-60 de minute moartea.
Structură[modificare | modificare sursă]
Molecula de amoniac are o structură piramidal-trigonală, având suprafețe tetraedrice, care au în colț un atom de azot cu o pereche liberă de electroni. Amoniacul are un caracter amfoter, formează baze prin acceptare de protoni dând naștere la ioni a sărurilor de amoniu, sau are proprietăți acide prin pierdere de protoni în prezența bazelor tari formând ioni de amide:
Producere pe cale sintetică[modificare | modificare sursă]
Producerea pe scară industrială a amoniacului este realizată într-un procent de 90 % din azot și hidrogen (în raport de 1:3) după procedeul Haber-Bosch, procedeu descoperit de chimiștii germani Fritz Haber (1868–1934) și Carl Bosch (1874–1940).
Acest procedeu obține amoniacul dintr-un amestec gazos de hidrogen și azot, în prezența unui catalizator de oxid de fier Fe3O4, K2O, CaO, Al2O3 și bioxid de siliciu SiO2 supus la o presiune de 300 bari și o temperatură de 450 °C.
Utilizare[modificare | modificare sursă]
Amoniacul este unul din produsele principale ale industriei chimice. În prezent producția mondială de amoniac ajunge la cca. 125 milioane tone, pentru această producție fiind necesară 3% din energia mondială.
- Cea mai mare parte a cantității de amoniac produsă este folosită pentru îngrășămintele chimice pe bază de azot (aproximativ 88% la nivelul anului 2014). Aplicate pe sol, aceste îngrășăminte ajută la obținerea unor randamente sporite la culturile cerealiere, cum ar fi porumbul și grâul. În întreaga lume se aplică circa 110 milioane de tone anual de astfel de îngrășăminte.
- Amoniacul lichid este folosit în agregatele frigorifice, sau la distilare fracționată în cercetarea carbonului (Institutul Max Planck Germania).
- De asemenea este utilizat în industria textilă, sau la plasticizarea lemnului prin tratare cu o soluție cu amoniac.
- În metalurgie este folosit ca gaz de protecție în timpul tratării termice a metalului
- Folosit sub formă de soluție în curățătoriile chimice, ca și după acțiunile de dezinfectare, la neutralizarea clorului sau formaldehidei (formolului).
- La curățarea aerului de fumul produs de emisia motoarelor cu ardere internă
- În medicină sau industria farmaceutică la preparare de medicamente, sau în producerea explozibililor
- O acțiune patogenă o are amoniacul în stomac produs cu ajutorul enzimei „urează” de bacteria Helicobacter pylori o cauză frecventă a ulcerului gastric.
Note[modificare | modificare sursă]
| |||||



