Mioglobină
Mioglobina (abreviat Mb) este o proteină prezentă în fibrele musculare scheletice și cardiace, cu rol în legarea oxigenului. Aceasta este prezentă la majoritatea vertebratelor și la aproape toate mamiferele. Mioglobina poate fi găsită în sânge doar atunci când aceasta este eliberată în urma unei leziuni musculare.
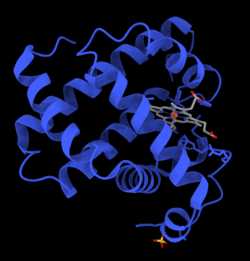
Mioglobina este o proteină globulară formată dintr-un singur lanț de 154 de aminoacizi, conținând o grupare hem înfășurat de o apoproteină. Este format din opt alfa-helixuri și un miez hidrofob. Are o greutate moleculară de 16700 daltoni, și este cel mai important pigment care transportă oxigen din țesuturile musculare. Spre deosebire de hemoglobina din sânge, mioglobina nu se leagă cooperativ de oxigen, legarea oxigenului de mioglobină nefiind afectată deci de presiunea oxigenului în țesuturile înconjurătoare. Concentrațiile mari de mioglobină din celulele musculare permit organismelor să țină respirația un timp mai îndelungat. Mamiferele marine, cum ar fi balenele și focile, prezintă o concentrație crescută de mioglobină în mușchi.
Mioglobina a fost prima proteină a cărei structură tri-dimensională a fost dezvăluită. În 1958, John Kendrew și asociații au determinat cu succes structura mioglobinei folosind cristalografie cu raze X de înaltă rezoluție. Pentru această descoperire, John Kendrew a primit în 1962 Premiul Nobel pentru Chimie împreună cu Max Perutz. În ciuda faptului că este una din cele mai studiate proteine în biologie, funcția propriu-zisă fiziologică nu a fost încă definitiv stabilită: șoarecii modificați genetic astfel încât să nu prezinte mioglobină sunt viabili, dar au arătat o reducere de 30% a funcției sistolice. Ei s-au adaptat la acest deficit prin mecanism hipoxic și vasodilatație crescută.